Студент растворил 0,6 г серебра нитрата в 30 мл воды очищенной, профильтровал через стеклянный фильтр №1 в отпускной флакон оранжевого стекла, закрыл пластмассовой пробкой, обвязал бумажным колпачком, оформил к отпуску этикеткой «Наружное».
Удовлетврительно ли изготовлена лекарственная форма?
Решение. Лекарственная форма изготовлена неудовлетворительно. Раствор серебра нитрата готовят на свежеперегнанной воде очищенной, не содержащей хлоридов. Флакон опечатывают (т. к. вещество относится к списку А), оформляют этикеткой «Наружное», на которой полностью должна быть продублирована вся пропись, и предупредительными надписями: «Обращаться с осторожностью», «Хранить в прохладном месте», «Хранить в защищенном от света месте». Выписывают сигнатуру.
8.Возьми: Раствора Люголя 25 мл
Выдай. Обозначь. По 5 капель 2 раза в день на молоке.
После необходимых расчетов был составлен ППК (обратная сторона):
Калия йодида 0,5
Воды очищенной до 25 мл
Общий объем 25 мл
Так вот как он выглядит чистый раствор нитрата серебра😊
Правильно ли проведены расчеты?
Решение. Раствор Люголя для внутреннего применения готовят по стандартной прописи: Йода 1,0
Калия йодида 2,0
Воды очищенной до 20 мл
Общий объем 20 мл
20 мл раствора Люголя — 1,0 г йода
25 мл раствора Люголя – х г йода
х = 25 · = 1,25 г йода
20 мл раствора Люголя — 2,0 г йода
25 мл раствора Люголя – х г йода
х = 25 · = 2,5 г йода.
Исходя из проведенных расчетов, следует, что ППК составлен неправильно. Все расчеты должны быть указаны на обратной стороне ППК.
Обучающий и контролирующий тест с эталонами ответов
Примечание: правильные ответы напечатаны шрифтом с подчеркиванием..
- Истинные растворы – это:
1. молекулярно-дисперсные системы, образованные дифильными макромолекулами
2. ионно-дисперсные системы, образованные отдельными гидратированными ионами
и молекулами в равновесных количествах
3. гетерогенные дисперсные системы, размер частиц которых лежит в пределах 1 – 100 нм (0,1 мкм)
4. гетерогенные грубодисперсные системы, размер частиц которых колеблется в пределах от 0,1 мкм до 10 мкм и более
5. грубодисперсные системы, в которых и дисперсная фаза, и дисперсная среда представлены жидкостями, которые взаиморастворимы или мало взаиморастворимы Размер дисперсной фазы обычно колеблется от 1 до 150 мкм
- Лекарственные вещества в жидких лекарственных формах могут быть в следующих агрегатных состояниях:
- твердом
- жидком
- газообразном
- все ответы верны
- Растворы как лекарственная форма имеют ряд преимуществ, за исключением:
- высокая биодоступность и быстрое наступление терапевтического эффекта
- исключается раздражающее действие на слизистые оболочки
- простота и удобство применения
- возможность маскирования вкуса
- устойчивы при хранении
- Растворы как лекарственная форма имеют ряд недостатков, за исключением:
- нестабильность
- непортативность
- в форме растворов более отчетливо ощущается неприятный вкус некоторых лекарственных веществ
- простота и удобство применения
- Установите соответствие:
Теории растворения: 1. Оррениуса
Получение НИТРАТА СЕРЕБРА
3. Каблукова
а) физическая теория, которая отрицала взаимодействие между молекулами растворителя и растворенного вещества. Растворы приравнивались к механическим смесям
б) химическая теория, которая утверждала, что между молекулами растворителя и растворенного вещества существует взаимодействие, при этом образуются нестойкие соединения типа сольватов
в) теория, согласно которой растворы отличаются от механических смесей однородностью, а от химических соединений переменностью состава
Источник: studfile.net
Большая Энциклопедия Нефти и Газа
В большинстве случаев осадительное титрование основано на использовании стандартного раствора нитрата серебра ; этот метод иногда называют аргентометрическим методом. В табл. 8 — 2 приведены типичные примеры применения аргентометрии. Заметим, что многие из указанных определений основаны на осаждении определяемого компонента измеренным избытком раствора нитрата серебра с последующим титрованием стандартным раствором роданида калия по Фольгарду. Оба эти реагента доступны в виде первичных стандартов, однако роданид калия несколько гигроскопичен, что затрудняет его взвешивание при повышенной влажности. Растворы нитрата серебра и роданида калия устойчивы неограниченно долгое время. [16]
При титровании раствора, содержащего ионы хлора, стандартным раствором нитрата серебра образуется осадок AgCl. [17]
При титровании раствора, содержащего ионы хлора, стандартным раствором нитрата серебра образуется осадок AgCl. Зная величину произведения растворимости AgCl и концентрации ионов титруемого ( С1 -) и стандартного ( Ag) растворов, можно легко вычислить изменения [ Ag ] и [ С1 — ] в любой момент титрования. [18]
При титровании раствора, содержащего ионы хлора, стандартным раствором нитрата серебра образуется осадок AgCl. Зная величину произведения растворимости AgCl и концентрации ионов титруемого ( СГ) и стандартного ( Ag) растворов, можно легко вычислить изменения [ Ag ] и [ СП в любой момент титрования. [19]
При титровании раствора, содержащего ионы хлора, стандартным раствором нитрата серебра образуется осадок AgCl. Зная величину произведения растворимости AgCl и концентрации ионов титруемого ( СГ) и стандартного ( Ag) растворов, можно легко вычислить изменения [ Ag ] и [ СГ ] в любой момент титрования. [20]
Он служит, например, эталоном для установки нормальности стандартных растворов нитрата серебра и нитрата закисной ртути, применяется в биохимических исследованиях. [21]
Количество серебра рассчитывают по титру раствора дитиаона, установленному по стандартному раствору нитрата серебра . [22]
Международный ампер — это сила тока, при прохождении которого через стандартный раствор нитрата серебра осаждается 1 11800 мг серебра в секунду. [24]
В методе определения С1 — — иона по Фольгарду известное количество стандартного раствора нитрата серебра добавляют к неизвестному раствору. После отделения осадка AgCl избыток AgNOa оттитровывают KSCN. Конечную точку обратного титрования определяют по индикатору — иону Fe3, так как незначительный избыток SCN — иона образует с Fe3 красные комплексы. [25]
Очевидно, самым классическим из всех осадительных титрований является определение хлорида стандартным раствором нитрата серебра . Рассмотрим детальна это титрование, построив кривую титрования, обсудим методы, используемые для обнаружения точки эквивалентности. [26]
Пробу фильтрата бурового раствора ( нейтрализованную, если она щелочная) титруют стандартным раствором нитрата серебра с использованием хромата калия в качестве индикатора. Результаты анализа выражают в частях иона хлорида на миллион, хотя концентрацию фактически измеряют в миллиграммах ионов С1 на 1 л фильтрата. Для определения содержания хлоридов в растворе на углеводородной основе пробу разбавляют смесью Эксосоля и изопропилового спирта ( 3: 1) и дистиллированной водой, нейтрализуют по фенолфталеину, а затем титруют обычным путем. [27]
Крутизну характеристики электродной функции S проверяют, измеряя потенциал электрода в двух стандартных растворах нитрата серебра со значениями pAg 4 0 и 5 0 при температуре 20 0 1 С. Если S 56 3 мВ / pAg, электрод пригоден к работе. Первые два-три дня ежедневно проверяют крутизну характеристики электрода, а при последующей эксплуатации один раз в неделю. [28]
Применительно к определению хлорид-иона метод Фольгарда состоит в добавлении к пробе измеренного избытка стандартного раствора нитрата серебра и обратном титровании избытка стандартным раствором роданида калия. [29]
Для этого к раствору, содержащему Hg ( II), добавляют избыток стандартного раствора цианида калия и оттитровывают стандартным раствором нитрата серебра . [30]
Источник: www.ngpedia.ru
Осадительное титрование. Аргентометрия, сульфатометрия
Метод осадительного тирования основан на применении титрантов, которые образуют малорастворимые соединения с анализируемым веществом. В осадительном титровании используют реакции образования труднорастворимых соединений. К реакциям осаждения в титриметрическом методе предъявляются следующие требования:
- ● достаточно малая растворимость осадка;
- ● быстрое образование осадка при добавлении титранта;
- ● наличие индикаторов, позволяющих установить точку эквивалентности;
- ● минимальное соосаждение примесей.
К осадительному титрованию относят аргентометрию, меркурометрию, меркуриметрию и сульфатометрию.
Аргентометрия применяется главным образом для определения галогенидов:
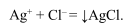
Основным рабочим раствором является нитрат серебра. Этим методом можно определить любые элементы, входящие в состав анионов, образующих с серебром нерастворимые осадки. Хранят растворы соли нитрата серебра в темной склянке.
Большинство веществ обладают ограниченной растворимостью, т. е. в системе имеется осадок и насыщенный раствор.
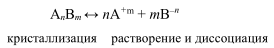
Процесс обратимый, гетерогенный, протекает на поверхности раздела двух фаз. Константа равновесия
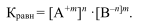
Эта величина называется произведением растворимости (ПР). ПР — произведение концентраций ионов электролита, содержащихся в его насыщенном растворе при данной температуре. Эта величина постоянная, используется на практике для малорастворимых электролитов. Например:

Наряду с раствором AgNO 3 используют растворы тиоционатов KCNS и NH 4 CNS. К анализируемому раствору галогенидов добавляют избыток титованного раствора:
AgNO 3 и непрореагировавшее серебро оттитровывают тиоционатом в присутствии ионов Fe +3 .
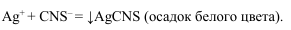
Как только все ионы серебра будут связаны, начнут вступать в реакцию ионы железа:
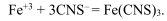
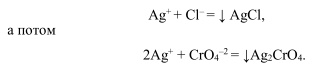
Образуется осадок темно-красного цвета. Хромат серебра начнет выпадать в осадок после того, как выпадет в осадок весь хлорид серебра, потому что растворимость хромата серебра больше растворимости хлорида серебра. Визуально наблюдаем побурение белого осадка.
Меркурометрический метод титриметрического анализа основан на применении титрованных растворов солей ртути(I) (меркуроионов). При взаимодействии [Hg2]+2 -ионов с хлоридами, бромидами, иодидами и т. д. образуются осадки малорастворимых галогенидов Hg2Cl2, Hg2 Br2, Hg2I2, например
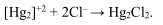
Меркуриметрия — метод, основанный на применении в качестве титранта раствора солей ртути (II). При взаимодействии Hg +2 с хлорид ионами образуется слабодиссоциированное соединение:
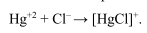
После достижения точки эквивалентности в титруемом растворе появляются избыточные Нg+2 -ионы, которые обнаруживают при помощи соответствующего индикатора, образующего с Hg+2 окрашенные соединения.
Этот метод гораздо дешевле метода аргентометрии, но соли ртути ядовиты, это является недостатком метода. В качестве индикатора используют дифенилкарбазон, дающий изменение цвета на фиолетовый в точке эквивалентности.
Сульфатометрия — титрование растворами серной кислоты и хлоридом бария. Используется метод для определения ионов сульфата и бария.
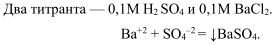
Индикатор — ортаниловый А. Изменение окраски розовая — фиолетовая.
Похожие записи:
А Вам помог наш сайт? Мы будем рады если Вы оставите несколько хороших слов о нас.
- (0)
- Главная страница (0)
- Каталог (0)
- Документы (5)
- Федеральные законы (4)
- Постановления Правительства РФ (0)
- Приказы Минздрав РФ (1)
- Фармацевтическая технология (19)
- Фармацевтическая химия (77)
- Фармакология (206)
- Фармакогнозия (71)
- Управление и экономика фармации (81)
- Токсикологическая химия (98)
- Патологическая физиология (129)
- Нормальная физиология (64)
- Органическая химия (19)
- Микробиология (126)
- ГО, МК, МПЗ, военная токсикология (110)
- Биохимия (46)
- Аналитическая химия (30)
- Патологическая анатомия (37)
- Стоматология (41)
- Анатомия (172)
- Биотехнология (19)
- Кардиология (61)
- Ревматология (13)
- Неврология (62)
- Геронтология (11)
- Латинский язык (0)
- Акушерство и гинекология (108)
- Дерматовенерология (49)
- Биология (121)
- Гигиена (63)
- Химия общая (20)
- Химия физическая (4)
- Судебная медицина (29)
- Нефрология (18)
- Этика и деонтология (61)
- Ботаника (75)
- Анатомия лучевая (76)
- Иммунология, аллергология (30)
- Офтальмология (15)
- Фармацевтическая технология (4)
- Фармацевтическая химия (8)
- Фармакология (71)
- Фармакогнозия (20)
- Управление и экономика фармации (29)
- Токсикологическая химия (5)
- Патологическая физиология (74)
- Нормальная физиология (8)
- Микробиология (5)
- Биохимия (10)
- Аналитическая химия (30)
- ГО, МК, МПЗ, военная токсикология (7)
- Биотехнология (1)
- Стоматология (6)
- Анатомия (6)
- Дерматовенерология (5)
- Акушерство и гинекология (3)
- Гигиена (0)
- НМО (8)
- Токсикологическая химия (1)
- Токсикологическая химия Т. Х. Вергейчик (9)
- Основы фармацевтической биотехнологии (13)
- Фармтехнология (21)
- Фармацевтическая химия (23)
- Фармакогнозия (97)
- Управление и экономика фармации (8)
- Биотехнология (10)
- Биохимия (1)
- Государственная фармакопея (ГФ) (405)
Источник: farmf.ru