Из предложенного перечня выберите два вещества, которые наиболее легко подвергаются гидрированию.
- циклопропан
- циклобутан
- циклогексан
- циклопентан
- метилциклопентан
Из предложенного перечня выберите два вещества, которые преимущественно образуются при пропускании газообразного хлора на свету через бензол и толуол соответственно.
Из предложенного перечня выберите два ряда веществ, каждое из которых не обесцвечивает бромную воду.
- этан, этилен, ацетилен
- хлорэтан, пропан, бензол
- стирол, этилен, ацетилен
- толуо…
Из предложенного перечня выберите два вещества, взаимодействие с которыми характерно для предельных одноатомных спиртов.
Запишите номера выбранных …
Источник: examer.ru
Ацетон: состав и свойства

ОКИСЛЕНИЕ АЦЕТОНА ОКСИДОМ ХРОМА 6
Что представляет собой ацетон? Состав данного органического соединения следующий: три атома углерода, шесть атомов водорода, один атом кислорода. Проанализируем основные физические и химические свойства данного соединения, способы получения, а также рассмотрим основные области его применения.
Краткая справка
Ацетон, состав и свойства которого рассмотрим подробнее, является органическим веществом, простейшим представителем насыщенных карбонильных соединений – кетонов. В переводе с латинского языка, он означает – уксус. Раньше ацетон, состав которого еще не был изучен, синтезировали из ацетатов, а готовый кетон являлся сырьем для получения ледяной уксусной кислоты.
Только в середине девятнадцатого века немецким химиком Леопольдом Гмелиным в научный лексикон был введен термин «ацетон».

История открытия
Ацетон, состав которого был изучен только в девятнадцатом веке Жано-Батистом Дюма и Юстусом фон Либихом, впервые удалось открыть Андреасу Либавиусу в конце 16 века. Вещество удалось синтезировать в процессе сухой перегонки соли – ацетата свинца.
До начала двадцатого века этот представитель кетонов получили путем коксования древесины.
Во время первой мировой войны ацетон, состав которого в настоящее время известен даже школьникам, стали производить иными способами.

Физические свойства
Ацетон является бесцветной подвижной летучей жидкостью, обладающей резким запахом. Данное органическое соединение неограниченно смешивается с водой, бензолом, диэтиловым эфиром, метанолом, сложными эфирами. В быту практически все используют растворитель – ацетон, состав которого рассматривается в рамках курса органической химии.
Цветная реакция на ацетон
Химические свойства
Одним из самых реакционноспособных кетонов является ацетон. Формула и свойства этого органического соединения рассматриваются в рамках карбонильных соединений. В щелочной среде он взаимодействует в альдольную самоконденсацию, продуктом реакции является диацетоновый спирт.
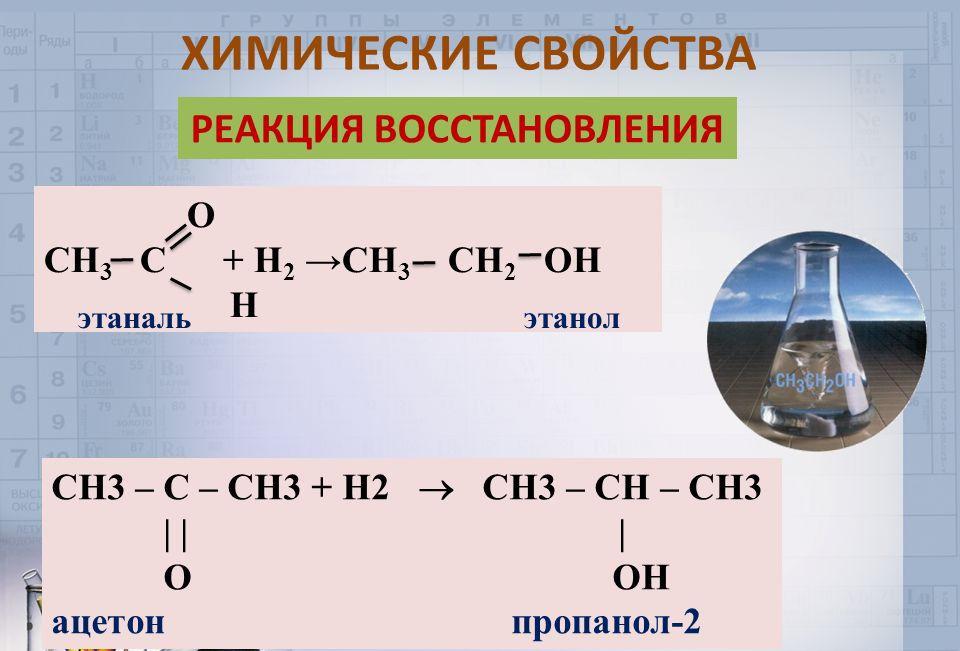
Под воздействием цинка данный кетон восстанавливается до пинакона. В рамках пиролиза получают кетен. Как любое органическое соединения, ацетон сгорает в атмосфере кислорода с образованием углекислого газа и водяного пара. Процесс является экзотермическим, сопровождается выделением значительного количества теплоты.
Качественной реакцией на данное соединения является взаимодействие в щелочной среде с нитропруссидом натрия. При наличии ацетона появляется интенсивный красный цвет, который по мере добавления в раствор уксусной кислоты становится красно-фиолетовым.
Химический состав ацетона (наличие двойной связи между атомом кислорода и углерода) объясняет отсутствие у данного органического соединения способности вступать в реакции окисления с аммиачным раствором оксида серебра и свежеприготовленным гидроксидом меди (2).
Получение диметилкетона
В настоящее время в мире производят около 6,9 миллионов тонн ацетона в год. Аналитик отмечают стабильный рост у потребителей спроса на этот кетон, в результате чего химики разрабатывают новые варианты его экономичного синтеза. В промышленных масштабах диметилкетон получают из пропена прямым либо косвенным путем.
При кумольном способе ацетон является подобным продуктом синтеза из бензола фенола. Выделяют три стадии данного производства. Сначала пропеном бензол алкилируется, продуктом взаимодействия является кумол. На второй и третьей стадиях он окисляется атмосферном кислородом до гидропероксида. В кислой среде это соединение разлагается на ацетон и фенол.
Вторая промышленная технология получения ацетона основывается на каталитическом окислении в паровой фазе изопропанола. При прямом окислении в жидкой фазе пропена в присутствии катализатора (хлорида палладия) также можно получать ацетон.
Среди методов, которые не подходят для промышленных объемов из-за несущественного выхода продукта, отметим и брожение крахмала под воздействием бактерий.

Области применения
Ацетон часто применяют в производстве в виде растворителя. Данное вещество отлично обезжиривает поверхности, растворяет хлоркаучук, эпоксидные смолы, полистирол, разные органические вещества. Именно данный кетон применяют для растворения нитратов и целлюлозы.
В фармацевтической промышленности соединение применяется в качестве главного сырья для синтеза метилметакрилата, окиси мезитила, ацетонциангидрина, уксусного ангидрида, диацетонового спирта.
Это органическое кислородсодержащее соединение является отличным средством для удаления с поверхности остатков жира. В чистом виде ацетон применяют для растворения разных лаков и грунтовок. В настоящее время данный представитель класса кетонов применяется не только в качестве отличного органического растворителя, но и как исходное вещество для промышленного синтеза полиуретанов, эпоксидных смол, поликарбонатов, взрывчатых соединений. Также он необходим для хранения ацетилена, так как этот алкин имеет повышенную взрывоопасность, его нельзя оставлять в чистом виде. Ацетилен размещают в специальных емкостях, которые содержат пористый материал, пропитанный диметилкетоном.
Среди интересных фактов, касающихся использования ацетона, отметим приготовлением с его участием охлаждающих бань в смеси с жидким аммиаком и «сухим льдом».
В научно-исследовательских лабораториях диметилкетон, являющийся первым представителем класса, необходим для мытья грязной химической посуды. Причина такого оригинального применения ацетона заключается в его незначительной токсичности, отличной летучести, прекрасной растворимости в воде. С помощью ацетона можно достаточно быстро высушить посуду и просушивать неорганические малоактивные соединения, не вступающие с ним в химическое взаимодействие.
Чтобы провести очистку данного кетона в лабораторных условиях, его перегоняют с небольшим количеством перманганата калия.
Обнаружить присутствие ацетона в смеси органических соединений можно с помощью взаимодействия с растворами фурфурола, нитропруссида натрия, йода.
Источник: fb.ru
Ацетон

Ацетон (диметилкетон, пропанон-2) — органическое вещество, имеющее формулу CH3—C(O)—CH3 (C3H6O), простейший представитель насыщенных кетонов.
Своё название ацетон получил от лат. acetum — уксус. Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту. В 1848 году немецкий профессор медицины и химии Леопольд Гмелин ввёл термин в официальное употребление, использовав старое немецкое слово Aketon (кетон, ацетон), которое также берёт корни от латинского acetum.

Открытие

— первым открыл ацетон
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны очень быстро стимулировал создание новых методов производства.
Физические свойства
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее.
Основные термодинамические свойства ацетона:
- Поверхностное натяжение (20 °C): 23,7 мН/м
- Стандартная энтальпия образования ΔH (298 К): −247,7 кДж/моль (ж)
- Стандартная энтропия образования S (298 К): 200 Дж/моль·K (ж)
- Стандартная мольная теплоемкость Cp (298 К): 125 Дж/моль·K (ж)
- Энтальпия плавления ΔHпл: 5,69 кДж/моль
- Энтальпия кипения ΔHкип: 29,1 кДж/моль
- Теплота сгорания Qp: 1829,4 кДж/моль
- Критическое давление: 4,7 МПа
- Критическая плотность: 0,273 г/см 3
- Динамическая вязкость жидкостей и газов:
- 0,36 мПа·с (10 °C)
- 0,295 мПа·с (25 °C)
- 0,28 мПа·с (41 °C)
Термохимические свойства:
- Температура вспышки в воздухе: (-20 °C)
- Температура самовоспламенения на воздухе: 465 °C
- Пределы взрывоопасных концентраций: 2,6-12,8 %
Оптические свойства:
- Показатель преломления (для D-линии натрия):
- 1,3591 (20 °C)
- 1,3588 (25 °C)
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Ацетон образуется при ацетоновом (ацетон-бутиловом) брожении углеводов, вызываемом Clostridium acetobutylicus. В результате образуется ацетон и бутанол-1, а также ряд побочных примесей. В качестве промышленного такой метод получения ацетона был популярен в XIX — начале XX вв., но был вытеснен технологиями химического синтеза.

Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение:
Под действием щелочей вступает в альдольную самоконденсацию, с образованием диацетонового спирта:
Восстанавливается цинком до пинакона:
При пиролизе (700 °C) образует кетен:
Легко присоединяет циановодород с образованием ацетонциангидрина:
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Hal2 + 2NaOH ⟶ NaHal + NaOHal + H2O
Качественной реакцией на диметилкетон есть наличие интенсивно-красной окраски с нитропруссидом натрия в щелочной среде. При добавлении CH3COOH окраска переходит в красно-фиолетовую.
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии.
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
По данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.

Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Ацетон служит также сырьём для синтеза уксусного ангидрида, кетена, диацетонового спирта и многих других соединений.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.

Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму), взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм и токсикология
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии.
Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Источник: chem.ru