СЕРЕБРО
Свойства. Серебро-белый блестящий металл, в тонких пленках и проходящем свете-голубого цвета. Кристаллизуется в гранецентрир. кубич. решетке, а = 0,4086 нм, z = 4, пространств. группа Fm3m; т. пл. 961,93 °С, т. кип. 2167°С; плотн.
10,491 г/см 3 ; 25,36 Дж/(моль·К); D H пл 11,30 кДж/моль, D H исп 251,5 кДж/моль; 42,55 Дж/(моль·К); ур-ния температурной зависимости давления пара над жидким серебром lgp(aтм) = -1,368·10 4 /Т+ 5.615, плотн. жидкого серебра d = = 10,465 — 9,67·10 -4 Т г/см 3 ; t крит 4395°С, p крит 33,6 МПа и u крит 339 см 3 /моль. Серебро обладает наиб. теплопроводностью и электрич. проводимостью: r 1,59 (0°С) и 8,4 мкОм·см (960 °С), теплопроводность 419 (293 К) и 377 Вт/(м·К) при 773 К. Примеси в серебре уменьшают его · теплопроводность и электрич. проводимость. Серебро диамагнитно, его магн. восприимчивость (—0,181·10 -9 ) не зависит от т-ры; коэф. Холла —0,9·10 10 . Серебро обладает высокой отражат. способностью: в ИК диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95% и снижается до 10% при длине волны 320 нм. Серебро-мягкий и пластичный металл; предел текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу 148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
FG vs AG vs SG vs MG — What’s the difference & how do you pick?
Из благородных металлов серебро-наиб. реакционноспособно. Тем не менее серебро химически мало активно и легко вытесняется из своих соед. более активными металлами.
Углем, Н 2 и др. восстановителями ионы серебра восстанавливаются до Ag 0 . Стандартный электродный потенциал Ag + /Ag 0 0,799 В. При комнатной т-ре серебро не взаимод. с О 2 воздуха, но при нагр. до 170°С покрывается пленкой оксида Ag 2 O. Озон в присут. влаги окисляет серебро до высших оксидов-Ag 2 O 2 и Ag 2 O 3 . При взаимод. нагретого серебра с S или Н 2 S в присут. О 2 образуется серебра сульфид Ag 2 S. Халькогены, фосфор, мышьяк и углерод реагируют с нагретым серебром с образованием соответствующих бинарных соединений.
Серебро легко раств. в разб. и конц. HNO 3 с образованием серебра нитрата AgNO 3 . При нагр. Ag раств. и в конц. H 2 SO 4 , давая сульфат Ag 2 SO 4 . Галогены в присут. влаги, а также конц. галогеноводород-ные к-ты медленно реагируют с металлическим серебром, давая серебра галогениды AgX. В присут.
О 2 серебро легко раств. в р-рах цианидов щелочных металлов с образованием комплексных цианидов M 1 [Ag(CN) 2 ]. Расплавл. щелочи и орг. к-ты не действуют на металлическое серебро.
Известны многочисл. комплексные соединения серебра, в к-рых координац. число серебра равно 2, 3 и 4.
Большинство соед. Ag(I) плохо раств. в воде, за исключением AgF, AgNO 3 , AgClO 4 и AgClO 3 . Соли серебра-бесцв. или слегка желтоватые в-ва. На свету почти все соед. Ag(I) разлагаются до свободного серебра и при этом окрашиваются в серый или черный цвет, что используется в фотографии. Соединения серебра термодинамически мало устойчивы, причем углерод- и азотсодержащие соед.
Ag(I) способны к разложению со взрывом.
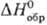
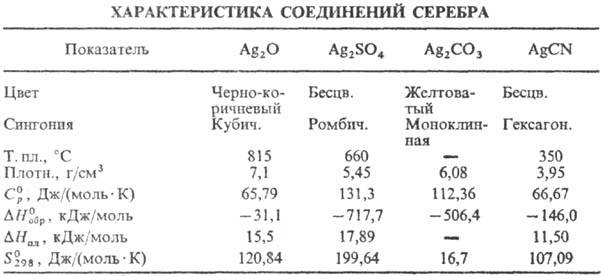
Оксид Ag(I) (гемиоксид) Ag 2 O при нагр. выше 100°С разлагается до Ag и О 2 ; р-римость в воде 1,3·10 3 г в 100 г воды (см. также табл.); водные р-ры Ag 2 O имеют щелочную р-цию вследствие частичного образования AgOH; в водной суспензии легко восстанавливается до металлического серебра водородом, СО, металлами и др. восстановителями; раств. в к-тах, водном NH 3 , цианидах и тиосульфатах щелочных металлов с образованием соответствующих простых и комплексных солей Ag(I); теряет на свету О 2 ; диамагнитен; получают при обработке р-ра AgNO 3 щелочами, применяют в гопкалитовых патронах противогазов, как окислитель в орг. синтезе; водные р-ры-антисептич. ср-во. Монооксид Ag 2 O 2 (или Ag I Ag III O 2 )-серые кристаллы моноклинной сингонии; разлагается выше 100 °С; —24,7 кДж/моль; получают окислением серебра или Ag 2 О озоном, анодным окислением серебра, используют для изготовления электродов в серебряно-цинковых элементах и аккумуляторах.
Гидроксид AgOH, по непроверенным сведениям, м.б. получен в виде неустойчивого белого осадка при обработке р-ра AgNO 3 в этаноле спиртовым р-ром КОН при — 45 °С; обладает амфотерными св-вами с преобладанием диссоциации по щелочному типу; для бесконечно разб. р-ров -124,36 кДж/моль, 61,70 Дж/(моль · К).
Сульфат Ag 2 SO 4 при 427°С переходит из ромбич. a -модификации в гексагон. b -модификацию, D H перехода 18,64 кДж/моль; выше 1100°С разлагается до Ag, SO 2 и О 2 ; р-римость в воде 0,8 г в 100 г при 20°С; в сернокислотных р-рах легко восстанавливается FeSO 4 , Zn и Mg до Ag 0 ; получают действием конц. H 2 SO 4 на Ag или Ag 2 O или обменной р-цией р-римых солей серебра с сульфатами металлов, в избытке H 2 SO 4 образуются гидросульфат AgHSO 4 и ад-дукты Ag 2 SO 4 c H 2 SO 4 .
Карбонат Ag 2 СО 3 выше 120 °С разлагается до Ag, CO 2 и О 2 ; р-римость в воде 3·10 -3 г в 100 г, раств. в водном NH 3 , цианидах и тиосульфатах щелочных металлов, с карбонатами др. металлов образует двойные карбонаты; получают действием р-ров карбонатов или гидрокарбонатов металлов на AgNO 3 .
Цианид AgCN практически не раств. в воде (2·10 -5 г в 100 г), в водном р-ре с избытком KCN образует комплексный цианоаргентат K[Ag(CN) 2 ], при действии к-т на цианоаргентаты выделяется синильная к-та HCN; получают действием р-ров KCN или NaCN на стехиометрич. кол-во AgNO 3 ; компонент электролитов при гальванич. серебрении, применяют также в произ-ве нитрилов и изо-нитрилов; ПДК 0,3 мг/м 3 (в пересчете на HCN).
Специфич. хим. св-во серебра-способность легко образовывать коллоидное серебро в р-ре при восстановлении соединений серебра или при диспергировании компактного металла. Золи серебра окрашены в разл. цвета-от фиолетового до оранжевого—в зависимости от размера частиц металла и способа получения золя. Серебро в коллоидном состоянии-энергичный восстановитель, катализатор окисления, бактерицидный препарат (колларгол, протаргол). Бактерицидные св-ва присущи и металлическому серебру: при концентрации серебра в р-ре 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
С еребро хорошо адсорбирует газы, такие, как Н 2 , О 2 , Аr и др. Так, при 500 °С Ag может поглощать до 5 объемов О 2 . При охлаждении жидкого серебра, содержащего растворенный в нем О 2 , выделение газа может происходить со взрывом.
Серебро образует множество интерметаллидов и сплавов с др. металлами. Так, с Pd и Аu серебро дает непрерывный ряд твердых р-ров, с Сu, Ni и Pb-эвтектич. сплавы, а с остальными металлами — интерметаллиды разл. состава. Введение металлов в серебро часто улучшает его мех. и хим. св-ва.
Получение. Первая стадия переработки всех серебросо-держащих руд-флотац. и гравитац. обогащение. Дальнейшие методы выделения серебра зависят от типа руды и содержания серебра и делятся на пирометаллургич. и гидрометаллургические.
Полиметаллич. сульфидные руды не поддаются прямой гидрометаллургич. переработке и их вначале подвергают обжигу-окислительному, восстановительному (или хлорирующему). При обжиге свинцовых руд Ag 2 S концентрируется в оксиде Рb и затем в металлич. Рb. Для выделения серебра из Рb применяют методы Паркеса и Паттинсо-на.
По методу Паркеса серебросодержащий Рb плавят вместе с Zn и серебро концентрируется в Zn в виде интерметаллидов. После отгонки Zn остаток купелируют (нагревают в печи в потоке воздуха) и отделяют сырое металлическое серебро от оксидов остальных металлов.
При переработке медных руд после окислит. и восстановит. плавок получают сплавы Сu с Ag, из к-рых серебро выделяют электролизом. Из сплава отливают аноды и при их растворении Си осаждается на катоде, а серебро концентрируется в шламе.
Собственно серебряные руды перерабатывают после обогащения методом цианирования, для чего руду обрабатывают в водном р-ре NaCN или KCN в присут. О 2 и затем серебро извлекают из комплексных цианидов восстановлением металлами или с использованием анионитов. В осн. история, интерес представляет сейчас амальгамный метод извлечения серебра, по к-рому руда смешивается в р-ре с Hg и хлоридами, при этом образуется амальгама серебра; из нее после отгонки Hg получают сырое серебро.
Для получения серебра высокой чистоты (99,999%) сырой металл подвергают электролитич. аффинажу в р-ре AgNO 3 с осаждением серебра на катоде (примеси переходят в шлам).
Все серебросодержащие отходы пром-сти (отработанные фотоматериалы, контакты, источники питания и т. п.) также подвергаются переработке с целью извлечения вторичного серебра, к-рое вновь расходуется в пром-сти в кол-ве 60-70% от общего потребления серебра.
Определение. Качественно серебро обнаруживают по цветным р-циям образования комплексов серебра с использованием орг. N- и S-содержащих реагентов (производные роданина, фе-нилтиомочевины, дитизона и т.п.). Применяют также восстановление серебра из р-ра до металла и микрокристаллич. р-ции образования AgCl, Ag 2 Cr 2 O 7 и комплекса серебра с уротропином.
Количественно серебро определяют гравиметрически (осаждение серебра в виде AgCl или комплекса серебра с бензотриазолом), титриметрически по Фольгарду с использованием р-ров KCNS или NH 4 CNS в присут. железо-аммониевых квасцов. Применяют колориметрич. методы с использованием производных роданина и дитизона, каталиметрич. (основанные на измерении скорости р-ции в присут. микрокол-в серебра), а также эмиссионно-спектральный и атомно-абсорбционный методы анализа.
Применение. Примерно 30-40% производимого серебра расходуют на изготовление кино- и фотоматериалов. Ок. 20% серебра в виде сплавов с Pd, Аu, Сu, Zn и др. металлами идет на изготовление контактов, припоев, проводящих слоев, элементов реле и др. устройств в электротехнике и электронике.
Сплавы серебра с Аu и Сu, а также с Hg, Sn, Zn и Си используют в стоматологии для пломбирования и протезирования. 20-25% серебра расходуют на изготовление элементов питания-серебряно-цинковых аккумуляторов, обладающих высокой энергоемкостью (космич. и оборонная техника), оксидно-серебряных элементов питания часов и т.п. Из серебра изготовляют монеты, ювелирные изделия, украшения, столовую посуду. Серебро используют для серебрения зеркал, аппаратов в пищ. пром-сти, как катализатор процессов дожигания СО, восстановления NO и р-ций окисления в орг. синтезе.
Объем произ-ва первичного серебрс в мире колеблется в зависимости от цен на рынке. В связи с тем, что серебро-второй валютный металл, сведения о масштабах его произ-ва и потребления являются оценочными. В сер. 80-х гг. произ-во первичного серебра в развитых и развивающихся странах оценивалось в 10-15 тыс. т/год.
ПДК серебра в воздухе 0,1-0,5 мг/м 3 . При попадании р-римых соединений серебра на кожу и слизистые оболочки происходит восстановление серебра до серо-черного коллоидного металла. Это окрашивание пов-сти тканей (аргирия) исчезает в результате растворения и истирания коллоидного серебра вместе с кожей.
С еребро известно человеку с древнейших времен, еще в 4-м тыс. до н.э. оно использовалось для изготовления украшений, служило торговым эквивалентом в странах Востока.
Лит.: Пятницкий И. В., Сухан В. В., Аналитическая химия серебра, М., 1975; Малышев В.М., Румянцев Д. В., Серебро, 2 изд., М., 1987; Silver. Economics, metallurgy and use, Princeton (N.Y.), 1967; Thompson N. R., в кн.: Masscy A. G., The chemistry of cooper, Oxf., 1975. П.М. Чукуров.
ИсточникСеребро
Достаточно очевидно, что серебро [1] , srebro , сребро , сьребро восходят к праславянскому *sьrebro, которое имеет соответствия в sidabras , silubr , Silber , silver ) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо сближение с sarpu «очищенное серебро», от sarapu «очищать, выплавлять».
История
Нахождение в природе
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра.
Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40-45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1 х 1 х 2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг.
Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде.
Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15-20, в том числе: — Физические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
Растворяется оно и в ртути, образуя кислородом даже при высоких температурах, однако в виде тонких пленок может быть окислено кислородной кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
Применение
- Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий, например, контакты реле, ламели, а также многослойных керамических медью, иногда с никелем и другими металлами).
- Используется при чеканке монеты (в особенности в прошлом).
- Галогениды серебра и алюминий).
- Часто используется как метанола.
- Используется как дезинфицирующее вещество, в основном для обеззараживания воды. Некоторое время назад для лечения серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов (очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление).
Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых хлор-серебряный элемент , бром-серебряный элемент , йод-серебряный элемент .
Серебро зарегистрировано в качестве В медицине
Одной из важных сфер использования серебра являлась Китае, химии, появление множества новых природных и синтетических лекарственных форм не уменьшили внимания современных медиков к этому металлу. В наши годы оно продолжает широко использоваться в индийской фармакологии (для изготовления традиционных в Индии аурведических препаратов). мозга. Таким образом, сделан вывод, что серебро является металлом необходимым для жизнедеятельности человеческого организма и что открытые пять тысячелетий назад лечебные свойства серебра не утратили своей актуальности и в настоящее время.
Мелкораздробленное серебро широко применяется для ионов активно взаимодействует с различными другими ионами и бактерии. Установлено также, что ионы серебра в малых концентрациях способствуют повышению общей сопротивляемости организма к инфекционным заболеваниям. Развивая это направление использования, в довершение к зубным пастам, защитным карандашам, [2]
Еще более эффективно действует слабый раствор комплексного соединения серебра с Физиологическое действие
- ↑Морфологический разбор слова "серебро"
- ↑ O. Akhavan and E. Ghaderi "Enhancement of antibacterial properties of Ag nanorods by electric field" Sci. Technol. Adv. Mater. 10 (2009) 015003 скачать бесплатно
Ссылки
См. также
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | Xe | |
| Cs | Ba | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| Uue | Ubn | ||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
az:Gümüş ca:Plata cs:Stříbro es:Plata eu:Zilar fi:Hopea gl:Prata hak:Ngiùn id:Perak jv:Perak ku:Zîv la:Argentum lb:Sëlwer li:Zèlver lt:Sidabras ms:Perak oc:Argent (metal) pt:Prata scn:Argentu sk:Striebro sq:Argjendi sw:Agenti (fedha) tl:Pilak tr:Gümüş vec:Arxento vi:Bạc
ИсточникВсё о серебре (Ag): физические и химические свойства + сферы применения и как добывают металл сегодня
Доброго времени суток, дорогие мои читатели и случайные гости. Трудно найти похожий на серебро металл по части удивительных свойств. Именно об этом и пойдет речь в нашем материале. Какими свойствами он обладает, как его находят, где используют, кто лидирует в мире по добыче этого элемента, вы узнаете в ближайшие несколько минут.
Что такое серебро

Этот хим элемент относится к металлам, которые называют благородными из-за их низкой окислительной способности. В периодической таблице и в химических формулах имеет обозначение Ag. Люди во все времена высоко ценили его и считали драгоценным. Из этого металла изготавливаются ювелирные украшения, денежные знаки, его охотно выбирают в качестве источника инвестиций.
Краткая история появления
Серебро, как и золото, часто встречается в природе в виде самородков, поэтому история знакомства человечества с серебром и его применения насчитывает не менее 6000 лет. Ассирийцы и вавилоняне считали этот металл священным, а в Древнем Египте оно ценилось дороже золота.
Как выглядит серебро в природе
В природе это вещество находят как в виде самородков, так и в соединении с другими элементами. Науке известно около 50 таких содержащих металлическое или неметаллическое серебро минералов, порядка 20 из них добывают с целью получения драгоценного металла в промышленных масштабах.

Процесс образования в природе
Большинство ученых считает, что в природе аргентум не образуется и запасы его конечны. Как и другие тяжелые металлы, этот элемент предположительно входил в состав субстанции, из которой зародилась наша планета. Но пока эта версия доказательств не имеет и остается всего лишь гипотезой.
Структура, химические и физические свойства
Серебро – металл, устойчивый к кислороду, щелочам и большинству известных кислот. Оно слабо вступает в реакции с другими веществами.
Серебро обладает максимальной теплопроводностью среди металлов, высокой электропроводностью и великолепной отражательной способностью – 97% видимого глазу света. Это ковкое и очень эластичное вещество – 1 грамм можно растянуть в проволоку длиной более 2 км, а расплавить при температуре 962 °C.
Как находят серебряные жилы
В природе чистое серебро в виде самородков встречается довольно редко, поэтому обнаружить серебряное месторождение – большая удача. В России первые залежи драгоценного металла находили, в основном, по берегам рек. Но гораздо чаще этот драгметалл является составляющей частью полиметаллических руд в комплексных месторождениях. Около 80% всего серебра добывается в комплексе с другими полезными ископаемыми.
Спутники серебра
В качестве попутного компонента лунный металл часто встречается в рудах цветных и благородных металлов. Оно – постоянный спутник золотоносных жил. Широко распространены месторождения, где серебро находится в комплексе с медью, железом, свинцом, никелем, оловом и прочими составляющими.
Где встречается серебро в природе
Доля присутствия этого элемента в земной коре – самая значительная из благородных металлов. Среди остальных веществ серебро занимает почетное 65 место. Оно содержится в морской и пресной воде, пищевых продуктах и даже в человеческом мозге.
Встречается оно в торфяных, нефтяных, угольных и битумных месторождениях.

Основные залежи благородного металла, пригодные для промышленной разработки, расположены в зонах вулканических поясов, преимущественно в составе глинистых сланцев.
Виды месторождений
Способы добычи
В зависимости от глубины залегания серебросодержащих руд разработку месторождений ведут двумя методами: карьерным (открытым) или шахтным (закрытым). Добытую породу измельчают и подвергают обогащению, используя амальгамацию (растворение ртутью) или цианирование (растворение синильной кислотой).
Топ стран по добыче
Самая свежая информация, которую мне удалось найти – за 2017 год. Список лидеров по добыче серебра выглядит следующим образом:
- Мексика – 6108 т;
- Перу – 4587 т;
- Китай – 3502 т;
- Россия – 1306 т;
- Чили – 1260 т;
- Боливия – 1244 т;
- Польша – 1228 т;
- Австралия – 1101 т;
- США – 1048 т;
- Аргентина – 823 т.
Известно, что объемы добычи этого металла по всему миру продолжают сокращаться третий год подряд. С нетерпением ждем свежих итогов.
Мировые запасы серебра
Общий объем мировых запасов благородного металла оценивают приблизительно в 0,5 млн тонн, из них подтверждено примерно 360 тысяч тонн. По предварительным оценкам экспертов, залежей серебра в месторождениях осталось всего на 22 года при сохранении текущей интенсивности ежегодной добычи.
Сферы применения
Около 80% добытого металла потребляет промышленный сектор экономики. Остальные 20% идут на изготовление ювелирных изделий, нужды медицины и инвестиции.
Сложно перечислить все отрасли, где используют этот металл, поскольку сфера его применения слишком обширна. Это электронная техника, оптические приборы, материал для медицинского оборудования, управление погодой, фармакология, стоматология и многое другое.

В Японии серебро используют в устройствах для кондиционирования воздуха, в Америке кусочки металла кладут в молоко, чтобы не скисало.
В последние годы значительный рост спроса на серебро демонстрирует энергетический сектор экономики. Этот металл применяют при производстве современных высокотехнологичных солнечных батарей.
Самые богатые месторождения
Залежи серебра практически равномерно распределены по всем материкам, но в мире сформировались бесспорные лидеры по его добыче. Я составила списки самых богатых и известных на сегодняшний день месторождений.
В мире
Наиболее перспективные месторождения с ежегодной добычей серебра в них таковы:
- Каннингтон (Австралия), 1430 т;
- Фреснильо (Мексика), 982 т;
- Дукат (Россия), 375 т;
- Учучакуа (Перу), 305 т;
- Гринс Крик (США), 302 т;
- Арката (Перу), 247 т;
- Рочестер (США), 176 т;
- Имитер (Марокко), 153 т;
- Хуарон (Перу), 126 т;
- Лунное (Россия), 115 т.
В России
Россия – один из мировых лидеров по добыче серебра на сегодняшний день. Самые богатые месторождения с лучшими характеристиками по количеству благородного металла на тонну руды:
- Дукатское (Магадан), 640 г/т;
- Лунное (Магадан), 404 г/т;
- Хаканджинское (Хабаровск), 344 г/т;
- Гольцовое (Магадан), 1213 г/т;
- Прогноз (Якутия), 876 г/т;
- Подольское (Башкортостан), 28 г/т;
- Горевское (Красноярск), 56 г/т;
- Озерное (Бурятия), 35 г/т;
- Узельгинское (Челябинск), 30 г/т;
- Гайское (Оренбург), 11 г/т.
Преимущества и недостатки
Благодаря своим исключительным характеристикам электропроводности и теплопроводности серебро широко применяется в изготовлении электроприборов. Однако это слишком дорогой металл, чтобы использовать его в соответствии с потребностями.
Высокая отражательная способность обеспечивает великолепный блеск украшениям, изготовленным из него, но чистое серебро слишком мягкое, и драгоценности быстро теряют свою красоту. Поэтому приходится добавлять в состав легирующие металлы.
Сплавы и пробы
Драгоценный металл чаще всего используется в виде сплавов. То, из чего состоит лигатура, во многом определяет его свойства. Так, медь придает металлу твердость. Олово, цинк и кадмий делают сплав пригодным для припоев, сильно снижая температуру плавления. Никель усиливает прочность, а свинец и алюминий, напротив, делают вещество хрупким.
Для обозначения содержания чистоты сплава используют пробы. На изделие наносится маркировка в соответствии с метрической системой, например, 800 – 80% серебра и 20% лигатуры.

В ювелирных сплавах в качестве легирующей добавки применяется медь. С понижением пробы растет твердость металла, но снижается устойчивость к окислению и появляется заметная желтизна. Наиболее распространены следующие сорта:
- 800 – самый низкопробный и прочный, имеет явный желтоватый оттенок, изумительно подходит для изготовления перьевых ручек, столовых приборов и прочих активно используемых предметов .
- 830 – редко применяется в ювелирной промышленности из-за быстрого окисления и желтоватого оттенка металла.
- 875 – также обладает высокой прочностью, применяется при изготовлении недорогих ювелирных изделий.
- 916 – в данный момент не используется для создания украшений. Во времена СССР из такого сплава делали кувшины, сахарницы, соусницы и прочую утварь.
- 925 – так называемое стерлинговое серебро, прочное и ковкое. Ранее служил материалом для чеканки денежных знаков. Наиболее распространенный сплав.
- 960 – применяют для дорогих ювелирных изделий с филигранными элементами дизайна. Этот сплав – великолепный материал для тонкой работы, но слишком мягкий и легко поддается деформации.
- 999 – химически чистый металл, идет на создание инвестиционных инструментов: банковских слитков, памятных, юбилейных и прочих монет.
Таблица соответствия проб
Для определения пробы сплава во многих странах применяется каратная система, в которой проба в 24 карата соответствует чистому металлу. Для переведения значения каратной пробы в метрическую используют таблицы соответствия.
| Каратная система | 24К | 23К | 22К | 21К | 20К | 19К |
| Метрическая система | 999 | 960 | 925 | 875 | 830 | 800 |
Где можно купить или продать
В ювелирных магазинах можно приобрести украшение различной пробы на любой вкус и кошелек. Торговцы предоставляют широчайший выбор предметов из серебра всевозможных проб и видов.
Продать такое изделие проще всего в скупку, ломбард, или воспользовавшись всевозможными торговыми интернет площадками.
Сколько стоит 1 грамм на сегодня
Цена за 1 грамм серебра непрерывно меняется в зависимости от спроса и предложения на мировом рынке по результатам ежедневных торгов. На нее же ориентируются все торговцы, будь то банк или ломбард. Следить за изменениями стоимости металла следует при помощи интерактивной таблицы.
Цена за лом
Стоимость серебряного лома напрямую зависит от пробы металла и степени востребованности сплава на данный момент. Оставлю здесь таблицу с ценами за лом для удобства расчетов.
Как отличить подделку
Есть парочка простых способов быстро проверить драгметалл на подлинность.
- Магнит – серебро и медь относятся к металлам-диамагнетикам, поэтому магнититься ни в коем случае не должны.
- Ляписный карандаш – не оставит следов на металле, поскольку это нитрат серебра, или, как он обозначается в химии, AgNO3.
- Уксус – поместите предмет в обычный столовый уксус. Подлинная вещь никак не отреагирует, а подделка побелеет.
- Тепло – серебро мгновенно нагреется, стоит на миг опустить его в кипяток.
Советы по выбору серебряных украшений
Выбирая вещь, опирайтесь на то, каким образом хотите ее использовать. Столовую утварь лучше выбрать из металла с пробой пониже, зато прочного. Повседневные украшения хороши из стерлингового сплава, из чего их и делают чаще всего. Предметы для особых случаев можно выбрать из высокопробного металла: использоваться они будут нечасто, зато и ухода особого не потребуют.
Рекомендации по уходу чистке и хранению
Держать серебро рекомендуется подальше от солнечных лучей, в отдельных мешочках или футлярах. Проводить чистку металла при первых признаках налета, поскольку со временем навести лоск будет все сложнее.
Такие предметы нуждаются в механической очистке, поскольку сульфид серебра – тот самый темный налет на изделии – мало чем растворяется. Для ухода за драгоценностями можно использовать зубную пасту и мягкую щетку или салфетку и осторожно, без нажима, провести соответствующие манипуляции.
Отзывы
Лидия:
Лет десять назад купила слиток серебра, очень выгодно продала недавно, рекомендую серебро в качестве денежных вложений.
Светлана:
Всегда любила серебряные украшения больше золота, да и для здоровья, говорят, полезно.
Григорий:
Купил для дома столовое серебро, пользуемся, продолжаем традиции предков, правда, жена ругается, что чистить устала.
Заключение
Надеюсь, эта статья была не просто занимательной, а позволила сделать определенные выводы насчет перспектив этого металла в качестве объекта денежных инвестиций и не только. Ваше желание поделиться статьей в социальных сетях горячо приветствуется. Оставайтесь нашими читателями, а я прощаюсь.
ИсточникСеребро
Серебро — элемент побочной подгруппы первой группы, пятого периода периодической системы химических элементов, с атомным номером 47. Обозначается символом Ag (лат. Argentum). Один из дефицитных элементов. Простое вещество серебро (CAS-номер: 7440-22-4) — ковкий, пластичный благородный металл серебристо-белого цвета.
Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 963°C, плотность — 10,5 г/см³.
Серебро известно с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны.
В средние векасеребро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки монет.
Происхождение названия
Достаточно очевидно, что русск. серебро , польск. srebro , болг. сребро , ст.-слав. сьребро восходят к праславянскому *sьrebro, которое имеет соответствия в балтийских (лит. sidabras , др.-прусск. sirablan) и германских (готск. silubr , нем.
Silber , англ. silver ) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо сближение с анатолийским subau-ro «блестящий», либо раннее заимствование из языков Ближнего Востока: ср. аккадск. sarpu «очищенное серебро», от аккадск. sarapu «очищать, выплавлять».
По-гречески серебро — «άργυρος», «árgyros», от индоевропейского корня «*H₂erǵó-, *H₂erǵí-», означающего «белый», «блистающий». Отсюда происходит и его латинское название — «argentum».
Нахождение в природе
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40-45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1 х 1 х 2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили.
В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде.
Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15-20, в том числе:
Как и другим благородным металлам, серебру свойственны два типа проявлений:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Физические свойства


Чистое серебро — довольно тяжёлый (легче свинца, но тяжелее меди), необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга в проходящем свете имеет фиолетовый цвет. C течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида. Обладает высокой теплопроводностью. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов.
Химические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
Растворяется оно и в хлорном железе, что применяется для травления:
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких пленок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налет малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
Свободные галогены легко окисляют серебро до галогенидов:
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются.
При нагревании с серой серебро дает сульфид.
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2] + . Серебро образует комплексы так же с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
Применение


- Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий, например, контакты реле, ламели, а также многослойных керамических конденсаторов.
- В составе припоев: медносеребряный припой ПСР-45 используется для пайки медных котлов, чем выше процент серебра, тем выше качество; иногда также, добавляя его к свинцу в количестве 5 %, им заменяют оловянный припой.
- В составе сплавов: для изготовления катодовгальванических элементов (батареек).
- Применяется как драгоценный металл в ювелирном деле (обычно в сплаве с медью, иногда с никелем и другими металлами).
- Используется при чеканке монет, наград — орденов и медалей.
- Галогениды серебра и нитрат серебра используются в фотографии, так как обладают высокой светочувствительностью.
- Из-за высочайшей электропроводности и стойкости к окислению применяется:
- в электротехнике и электронике как покрытие ответственных контактов
- в СВЧ технике как покрытие внутренней поверхности волноводов

Области применения серебра постоянно расширяются и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.
Серебро используется в качестве добавки (0,1—0,4 %) к свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов (очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление). Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых радарных поверхностей. Кроме того, хлорид серебра, прозрачный в инфракрасной области спектра, используется в инфракрасной оптике. Монокристаллы фторида серебра используются для генерации лазерного излучения с длиной волны 0,193 мкм (ультрафиолетовое излучение).
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Фосфат серебра используется для варки специального стекла, используемого для дозиметрии излучений. Примерный состав такого стекла: фосфат алюминия — 42 %, фосфат бария — 25 %, фосфат калия — 25 %, фосфат серебра — 8 %.
Перманганат серебра, кристаллический тёмно-фиолетовый порошок, растворимый в воде; используется в противогазах. В некоторых специальных случаях серебро так же используется в сухих гальванических элементах следующих систем: хлор-серебряный элемент, бром-серебряный элемент, йод-серебряный элемент.
Серебро зарегистрировано в качестве пищевой добавки Е174.
В медицине
Одной из важных сфер использования серебра являлась алхимия, тесно связанная с медициной. Уже за 3 тыс. лет до н. э. в Китае, Персии и Египте были известны лечебные свойства самородного серебра. Древние египтяне, например, прикладывали серебряную пластину к ранам, добиваясь их быстрого заживления.
О способности этого металла долгое время сохранять воду пригодной для питья также знали с древних времен. Например, персидский царь Кир в военных походах перевозил воду только в серебряных сосудах. Знаменитый средневековый врач Парацельс лечил некоторые болезни «лунным» камнем — азотнокислым серебром (ляпис). Этим средством в медицине пользуются и поныне.
Мелкораздробленное серебро широко применяется для обеззараживания воды. Вода, настоянная на порошке серебра (как правило, применяют посеребренный песок) или профильтрованная через такой песок, почти полностью обеззараживается. Серебро в виде ионов активно взаимодействует с различными другими ионами и молекулами.
Малые концентрации полезны, так как серебро уничтожает многие болезнетворные бактерии. Установлено также, что ионы серебра в малых концентрациях способствуют повышению общей сопротивляемости организма к инфекционным заболеваниям [источник не указан 203 дня] . Развивая это направление использования, в довершение к зубным пастам, защитным карандашам, керамическим плиткам, покрытым серебром, в Японии даже стали изготавливать ладан, который содержит ионизированное серебро и при сжигании высвобождает ионы, убивающие бактерии. На этом свойстве серебра основано действие таких лекарственных препаратов, как протаргол, колларгол и др., представляющих собой коллоидные формы серебра и способствующих излечению гнойных поражений глаз.
Давно известно что если к серебряным электродам приложить напряжение в несколько вольт, то их обеззараживающее действие заметно усиливается (данный эффект использовался в портативных бытовых приборах для обеззараживания воды). Значительное усиление эффекта наблюдается если на поверхности электродов выращивать серебряные наностолбики. При этом напряжение не обязательно прикладывать непосредственно к электродам, а можно создавать внешним полем.
Ещё более эффективно действует слабый раствор комплексного соединения серебра с аммиаком, применяющийся в медицине под названием аммарген (производное от слов «аммиак» и «аргентум»). Нитраты серебра в виде раствора аммаргена широко применяются для промывания ран или слизистой оболочки при различных воспалительных состояниях, а также используются в изготовлении различных антибактериальных средств.
Физиологическое действие
Обычно серебро поступает в организм с водой и пищей в ничтожно малых количествах — всего 7 микрограммов в сутки. И при этом такое явление, как дефицит серебра, пока нигде не описано. Ни один из серьёзных научных источников не относит серебро к жизненно важным биоэлементам. Серебро — это тяжёлый металл. Пить воду с ионами серебра не стоит.
Подобная позицией характеризуется медицинское сообщество всего мира (за исключением Индии).
Добыча серебра
Предполагается, что первые месторождения серебра находились в Сирии в (5000-3400 гг. до н. э.), откуда металл привозили в Египет.
В VI—V веках н. э. центр добычи серебра переместился в Лаврийские рудники в Греции.
C IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген.
Во II—XIII вв. действовало множество рудников по всей Европе, которые постепенно истощались.
В XV—XVI вв. на первый план выходят Рудные горы.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 гг. было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820513893 песо и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи).
В России первое серебро было добыто 1704 году на Нерчинских рудниках Забайкалья. Некоторое количество добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
В 2008 году всего добыто 20 900 т серебра. Лидером добычи является Перу (3 600 т), далее следуют Мексика (3 000 т), Китай (2 600 т), Чили (2 000 т), Австралия (1 800 т), Польша (1 300 т), США (1 120 т), Канада (800 т).
На 2008 год, лидером добычи серебра в России является компания Полиметалл, добывшая в 2008 году 535 т [5] .
Источник
