СЕРЕБРО
Свойства. Серебро-белый блестящий металл, в тонких пленках и проходящем свете-голубого цвета. Кристаллизуется в гранецентрир. кубич. решетке, а = 0,4086 нм, z = 4, пространств. группа Fm3m; т. пл. 961,93 °С, т. кип. 2167°С; плотн.
10,491 г/см 3 ; 25,36 Дж/(моль·К); D H пл 11,30 кДж/моль, D H исп 251,5 кДж/моль; 42,55 Дж/(моль·К); ур-ния температурной зависимости давления пара над жидким серебром lgp(aтм) = -1,368·10 4 /Т+ 5.615, плотн. жидкого серебра d = = 10,465 — 9,67·10 -4 Т г/см 3 ; t крит 4395°С, p крит 33,6 МПа и u крит 339 см 3 /моль. Серебро обладает наиб. теплопроводностью и электрич. проводимостью: r 1,59 (0°С) и 8,4 мкОм·см (960 °С), теплопроводность 419 (293 К) и 377 Вт/(м·К) при 773 К. Примеси в серебре уменьшают его · теплопроводность и электрич. проводимость. Серебро диамагнитно, его магн. восприимчивость (—0,181·10 -9 ) не зависит от т-ры; коэф. Холла —0,9·10 10 . Серебро обладает высокой отражат. способностью: в ИК диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95% и снижается до 10% при длине волны 320 нм. Серебро-мягкий и пластичный металл; предел текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу 148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
Что Будет, Если СПЛАВИТЬ ВСЕ МЕТАЛЛЫ Вместе?
Из благородных металлов серебро-наиб. реакционноспособно. Тем не менее серебро химически мало активно и легко вытесняется из своих соед. более активными металлами.
Углем, Н 2 и др. восстановителями ионы серебра восстанавливаются до Ag 0 . Стандартный электродный потенциал Ag + /Ag 0 0,799 В. При комнатной т-ре серебро не взаимод. с О 2 воздуха, но при нагр. до 170°С покрывается пленкой оксида Ag 2 O. Озон в присут. влаги окисляет серебро до высших оксидов-Ag 2 O 2 и Ag 2 O 3 . При взаимод. нагретого серебра с S или Н 2 S в присут. О 2 образуется серебра сульфид Ag 2 S. Халькогены, фосфор, мышьяк и углерод реагируют с нагретым серебром с образованием соответствующих бинарных соединений.
Серебро легко раств. в разб. и конц. HNO 3 с образованием серебра нитрата AgNO 3 . При нагр. Ag раств. и в конц. H 2 SO 4 , давая сульфат Ag 2 SO 4 . Галогены в присут. влаги, а также конц. галогеноводород-ные к-ты медленно реагируют с металлическим серебром, давая серебра галогениды AgX. В присут.
О 2 серебро легко раств. в р-рах цианидов щелочных металлов с образованием комплексных цианидов M 1 [Ag(CN) 2 ]. Расплавл. щелочи и орг. к-ты не действуют на металлическое серебро.
Известны многочисл. комплексные соединения серебра, в к-рых координац. число серебра равно 2, 3 и 4.
Большинство соед. Ag(I) плохо раств. в воде, за исключением AgF, AgNO 3 , AgClO 4 и AgClO 3 . Соли серебра-бесцв. или слегка желтоватые в-ва. На свету почти все соед. Ag(I) разлагаются до свободного серебра и при этом окрашиваются в серый или черный цвет, что используется в фотографии. Соединения серебра термодинамически мало устойчивы, причем углерод- и азотсодержащие соед.
Ag(I) способны к разложению со взрывом.
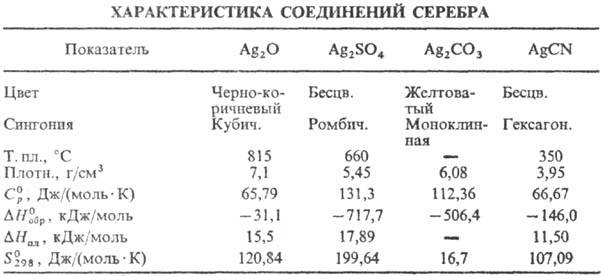
Оксид Ag(I) (гемиоксид) Ag 2 O при нагр. выше 100°С разлагается до Ag и О 2 ; р-римость в воде 1,3·10 3 г в 100 г воды (см. также табл.); водные р-ры Ag 2 O имеют щелочную р-цию вследствие частичного образования AgOH; в водной суспензии легко восстанавливается до металлического серебра водородом, СО, металлами и др. восстановителями; раств. в к-тах, водном NH 3 , цианидах и тиосульфатах щелочных металлов с образованием соответствующих простых и комплексных солей Ag(I); теряет на свету О 2 ; диамагнитен; получают при обработке р-ра AgNO 3 щелочами, применяют в гопкалитовых патронах противогазов, как окислитель в орг. синтезе; водные р-ры-антисептич. ср-во. Монооксид Ag 2 O 2 (или Ag I Ag III O 2 )-серые кристаллы моноклинной сингонии; разлагается выше 100 °С; —24,7 кДж/моль; получают окислением серебра или Ag 2 О озоном, анодным окислением серебра, используют для изготовления электродов в серебряно-цинковых элементах и аккумуляторах.
Гидроксид AgOH, по непроверенным сведениям, м.б. получен в виде неустойчивого белого осадка при обработке р-ра AgNO 3 в этаноле спиртовым р-ром КОН при — 45 °С; обладает амфотерными св-вами с преобладанием диссоциации по щелочному типу; для бесконечно разб. р-ров -124,36 кДж/моль, 61,70 Дж/(моль · К).
Сульфат Ag 2 SO 4 при 427°С переходит из ромбич. a -модификации в гексагон. b -модификацию, D H перехода 18,64 кДж/моль; выше 1100°С разлагается до Ag, SO 2 и О 2 ; р-римость в воде 0,8 г в 100 г при 20°С; в сернокислотных р-рах легко восстанавливается FeSO 4 , Zn и Mg до Ag 0 ; получают действием конц. H 2 SO 4 на Ag или Ag 2 O или обменной р-цией р-римых солей серебра с сульфатами металлов, в избытке H 2 SO 4 образуются гидросульфат AgHSO 4 и ад-дукты Ag 2 SO 4 c H 2 SO 4 .
Карбонат Ag 2 СО 3 выше 120 °С разлагается до Ag, CO 2 и О 2 ; р-римость в воде 3·10 -3 г в 100 г, раств. в водном NH 3 , цианидах и тиосульфатах щелочных металлов, с карбонатами др. металлов образует двойные карбонаты; получают действием р-ров карбонатов или гидрокарбонатов металлов на AgNO 3 .
Цианид AgCN практически не раств. в воде (2·10 -5 г в 100 г), в водном р-ре с избытком KCN образует комплексный цианоаргентат K[Ag(CN) 2 ], при действии к-т на цианоаргентаты выделяется синильная к-та HCN; получают действием р-ров KCN или NaCN на стехиометрич. кол-во AgNO 3 ; компонент электролитов при гальванич. серебрении, применяют также в произ-ве нитрилов и изо-нитрилов; ПДК 0,3 мг/м 3 (в пересчете на HCN).
Специфич. хим. св-во серебра-способность легко образовывать коллоидное серебро в р-ре при восстановлении соединений серебра или при диспергировании компактного металла. Золи серебра окрашены в разл. цвета-от фиолетового до оранжевого—в зависимости от размера частиц металла и способа получения золя. Серебро в коллоидном состоянии-энергичный восстановитель, катализатор окисления, бактерицидный препарат (колларгол, протаргол). Бактерицидные св-ва присущи и металлическому серебру: при концентрации серебра в р-ре 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
С еребро хорошо адсорбирует газы, такие, как Н 2 , О 2 , Аr и др. Так, при 500 °С Ag может поглощать до 5 объемов О 2 . При охлаждении жидкого серебра, содержащего растворенный в нем О 2 , выделение газа может происходить со взрывом.
Серебро образует множество интерметаллидов и сплавов с др. металлами. Так, с Pd и Аu серебро дает непрерывный ряд твердых р-ров, с Сu, Ni и Pb-эвтектич. сплавы, а с остальными металлами — интерметаллиды разл. состава. Введение металлов в серебро часто улучшает его мех. и хим. св-ва.
Получение. Первая стадия переработки всех серебросо-держащих руд-флотац. и гравитац. обогащение. Дальнейшие методы выделения серебра зависят от типа руды и содержания серебра и делятся на пирометаллургич. и гидрометаллургические.
Полиметаллич. сульфидные руды не поддаются прямой гидрометаллургич. переработке и их вначале подвергают обжигу-окислительному, восстановительному (или хлорирующему). При обжиге свинцовых руд Ag 2 S концентрируется в оксиде Рb и затем в металлич. Рb. Для выделения серебра из Рb применяют методы Паркеса и Паттинсо-на.
По методу Паркеса серебросодержащий Рb плавят вместе с Zn и серебро концентрируется в Zn в виде интерметаллидов. После отгонки Zn остаток купелируют (нагревают в печи в потоке воздуха) и отделяют сырое металлическое серебро от оксидов остальных металлов.
При переработке медных руд после окислит. и восстановит. плавок получают сплавы Сu с Ag, из к-рых серебро выделяют электролизом. Из сплава отливают аноды и при их растворении Си осаждается на катоде, а серебро концентрируется в шламе.
Собственно серебряные руды перерабатывают после обогащения методом цианирования, для чего руду обрабатывают в водном р-ре NaCN или KCN в присут. О 2 и затем серебро извлекают из комплексных цианидов восстановлением металлами или с использованием анионитов. В осн. история, интерес представляет сейчас амальгамный метод извлечения серебра, по к-рому руда смешивается в р-ре с Hg и хлоридами, при этом образуется амальгама серебра; из нее после отгонки Hg получают сырое серебро.
Для получения серебра высокой чистоты (99,999%) сырой металл подвергают электролитич. аффинажу в р-ре AgNO 3 с осаждением серебра на катоде (примеси переходят в шлам).
Все серебросодержащие отходы пром-сти (отработанные фотоматериалы, контакты, источники питания и т. п.) также подвергаются переработке с целью извлечения вторичного серебра, к-рое вновь расходуется в пром-сти в кол-ве 60-70% от общего потребления серебра.
Определение. Качественно серебро обнаруживают по цветным р-циям образования комплексов серебра с использованием орг. N- и S-содержащих реагентов (производные роданина, фе-нилтиомочевины, дитизона и т.п.). Применяют также восстановление серебра из р-ра до металла и микрокристаллич. р-ции образования AgCl, Ag 2 Cr 2 O 7 и комплекса серебра с уротропином.
Количественно серебро определяют гравиметрически (осаждение серебра в виде AgCl или комплекса серебра с бензотриазолом), титриметрически по Фольгарду с использованием р-ров KCNS или NH 4 CNS в присут. железо-аммониевых квасцов. Применяют колориметрич. методы с использованием производных роданина и дитизона, каталиметрич. (основанные на измерении скорости р-ции в присут. микрокол-в серебра), а также эмиссионно-спектральный и атомно-абсорбционный методы анализа.
Применение. Примерно 30-40% производимого серебра расходуют на изготовление кино- и фотоматериалов. Ок. 20% серебра в виде сплавов с Pd, Аu, Сu, Zn и др. металлами идет на изготовление контактов, припоев, проводящих слоев, элементов реле и др. устройств в электротехнике и электронике.
Сплавы серебра с Аu и Сu, а также с Hg, Sn, Zn и Си используют в стоматологии для пломбирования и протезирования. 20-25% серебра расходуют на изготовление элементов питания-серебряно-цинковых аккумуляторов, обладающих высокой энергоемкостью (космич. и оборонная техника), оксидно-серебряных элементов питания часов и т.п. Из серебра изготовляют монеты, ювелирные изделия, украшения, столовую посуду. Серебро используют для серебрения зеркал, аппаратов в пищ. пром-сти, как катализатор процессов дожигания СО, восстановления NO и р-ций окисления в орг. синтезе.
Объем произ-ва первичного серебрс в мире колеблется в зависимости от цен на рынке. В связи с тем, что серебро-второй валютный металл, сведения о масштабах его произ-ва и потребления являются оценочными. В сер. 80-х гг. произ-во первичного серебра в развитых и развивающихся странах оценивалось в 10-15 тыс. т/год.
ПДК серебра в воздухе 0,1-0,5 мг/м 3 . При попадании р-римых соединений серебра на кожу и слизистые оболочки происходит восстановление серебра до серо-черного коллоидного металла. Это окрашивание пов-сти тканей (аргирия) исчезает в результате растворения и истирания коллоидного серебра вместе с кожей.
С еребро известно человеку с древнейших времен, еще в 4-м тыс. до н.э. оно использовалось для изготовления украшений, служило торговым эквивалентом в странах Востока.
Лит.: Пятницкий И. В., Сухан В. В., Аналитическая химия серебра, М., 1975; Малышев В.М., Румянцев Д. В., Серебро, 2 изд., М., 1987; Silver. Economics, metallurgy and use, Princeton (N.Y.), 1967; Thompson N. R., в кн.: Masscy A. G., The chemistry of cooper, Oxf., 1975. П.М. Чукуров.
ИсточникОсновные сведения о серебре, как химическом элементе
Серебро в химии имеет обозначение Ag (от латинского слова Argentum, восходит к греческому «белый, блестящий»). Это элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы) пятого периода периодической системы химических элементов Д.И. Менделеева. Атомный номер 47. Относительная атомная масса 107,87 г/моль.
Рисунок 1. Структура серебра и его внешний вид.
Серебро имеет структуру в виде кристаллов неправильной формы. Часто в ней попадаются зерна разных размеров. Они связаны решетчатым каркасом в виде гранецентрированного куба (атомы расположены на каждой вершине куба и в центре граней).
В природе металл встречается в виде самородков (содержат 95 —99% серебра и примеси золота, платины, меди и других металлов) и в составе примерно 60 минералов. В таблице 1 приведены минералы, которые встречаются чаще остальных.
| Название минерала | Дополнительные компоненты | Содержание серебра, % |
| электрум | золото | 20-28 |
| аргентит | сера | 87 |
| гессит | теллур | 63 |
| науманит | селен | 73 |
| дискразит | сурьма | до 74 |
| кераргирит | хлор | 75 |
| прустит | сера и мышьяк | 65 |
Таблица 1. Содержание серебра в разных минералах.
Также в качестве примеси серебро обнаружено во всех медных и свинцовых рудах. Именно из них получают до 80% всего добываемого серебра. Содержание серебра в рудах цветных металлов составляет 10—100 грамм на тонну, в золото-серебряных рудах 200—1000 грамм на тонну.
Серебряные руды разбросаны по всему миру, но лидерами по его добыче являются Мексика и Перу, за которыми с небольшим отрывом следуют Китай, Чили и Австралия. В России этот металл добывают из серебряно-свинцовых руд Урала, Алтая, Северного Кавказа.
Физические и химические свойства
Физические свойства
Таблица 1. Основные физические свойства серебра.
Химические свойства серебра обусловлены положением в таблице Д.И. Менделеева. Особенность строения атома серебра заключается в наличии одного электрона на пятой орбитали. Электронная формула: 1s22s22p63s23p63d104s24p64d105s1.
Может проявлять степени окисления: -2, -1, +1, +2, +3, наиболее стабильная +1. Валентности: I, II, III. Входит в группу благородных металлов и в электрохимическом ряду напряжений находится после водорода, поэтому не взаимодействует с некоторыми веществами.
Серебро не взаимодействует:
- с растворами разбавленных соляной и серной кислот, щелочами;
- с водой: растворимость серебра в воде — 0,04 мкг/л;
- с кислородом, углеродом, хлором в обычных условиях, азотом и кремнием.
1. С неметаллами:
а) сера в обычных условиях:
2 A g + S → A g 2 S сульфид серебра I.
б) галогены при нагревании с образованием галогенидов серебра I:
2 A g + B r 2 → t ° 2 A g B r бромид серебра I.
в) кислород при повышении давления и температуры до 170 °С образует на поверхности серебра пленку:
4 A g + O 2 → t ° 2 A g 2 O .
г) селен, теллур, фосфор, мышьяк и углерод при нагревании с образованием бинарных соединений типа: A g 2 S e селенид серебра, A g 3 P фосфид серебра, A g 4 C карбид серебра и т.п.
P + 3 A g → t ° A g 3 P .
а) в газообразном виде:
- с сероводородом на воздухе с образованием на поверхности металла темного налета: 4 A g + O 2 + 2 H 2 S → A g 2 S + 2 H 2 O ;
- с хлороводородом при нагревании: 2 A g + 2 H C l → t ° A g C l + H 2 .
б) H N O 3 , горячая H 2 S O 4 конц, HCl в присутствии свободного кислорода:
- 3 A g + 4 H N O 3 р а з б → 3 A g N O 3 н и т р а т с е р е б р а I и л и л я п и с + N O + H 2 O ;
- A g + 2 H N O 3 к о н ц → A g N O 3 + N O 2 ↑ + H 2 O ;
- 2 A g + 2 H 2 S O 4 к о н ц → t ° A g 2 S O 4 + S O 2 ↑ + H 2 O ;
- 4 A g + 4 H C l + O 2 → 4 A g C l + 2 H 2 O .
в) концентрированные HCl и HBr, медленно:
- 2 A g + 4 Н С l → 2 H [ A g C l 2 ] + Н 2 ;
- 2 A g + 4 Н В r → 2 H [ A g B r 2 ] + Н 2 .
3. С цианидами в присутствии кислорода воздуха с образованием дицианоаргентатов (I):
4 A g + 8 N a C N + O 2 + 2 H 2 O → 4 N a [ A g ( C N ) 2 ] д и ц и а н о а р г е н т а т н а т р и я + 4 N a O H .
4. С хлоридом железа (травление):
A g + F e C l 3 → A g C l + F e C l 2 .
5. Со ртутью серебро образует жидкий сплав — амальгаму.
Способы получения
1. Пирометаллургический способ позволяет получать серебро как побочный продукт при переработке свинцово-цинковых руд. Проходит в несколько стадий:
- руду смешивают с жидким цинком → интерметаллиды цинка с серебром A g 2 Z n 3 , A g 2 Z n 5 всплывают серебристым слоем на поверхности жидкого свинца;
- серебристый слой снимают, цинк удаляют перегонкой;
- свинец из остатка удаляют реакцией с кислородом: он выводится в виде оксида свинца (IV);
- далее серебро очищается электролитически.
2. Цианидное выщелачивание позволяет выделять серебро из тех руд, где оно содержится в малых количествах. Метод включает следующие стадии:
- обработка серебросодержащей руды раствором цианида натрия → серебро переходит в анионный комплекс N a [ A g ( C N ) 2 ] ;
- фильтрование через цинковую пыль, в ходе которого цинк вытесняет серебро: 2 N a [ A g ( C N ) 2 ] + Z n → N a 2 [ Z n ( C N ) 4 ] + 2 A g ↓ ;
- обработка серебряного осадка серной кислотой для удаления примесей;
- далее полученный остаток промывают, фильтруют, выпаривают и сплавляют в слитки.
3. При переработке медных руд серебро извлекают из анодного шлама методом электролитического рафинирования меди.
4. Амальгамный метод извлечения серебра уже не используется, но интересен с точки зрения истории:
- руда смешивается со ртутью → амальгама серебра;
- ртуть удаляют отгонкой → сырое серебро;
- сырой металл подвергают электролитическому очищению (аффинажу) в р-ре A g N O 3 с осаждением серебра высокой степени чистоты (99,9%) на катоде.
Сферы применения
- Ювелирное дело: изготовление украшений и посуды, декоративных изделий.
- Чеканка монет, медалей и других наград.
С середины XX века примерно 70% добываемого серебра расходуется промышленностью:
ИсточникВсё о серебре (Ag): физические и химические свойства + сферы применения и как добывают металл сегодня
Доброго времени суток, дорогие мои читатели и случайные гости. Трудно найти похожий на серебро металл по части удивительных свойств. Именно об этом и пойдет речь в нашем материале. Какими свойствами он обладает, как его находят, где используют, кто лидирует в мире по добыче этого элемента, вы узнаете в ближайшие несколько минут.
Что такое серебро

Этот хим элемент относится к металлам, которые называют благородными из-за их низкой окислительной способности. В периодической таблице и в химических формулах имеет обозначение Ag. Люди во все времена высоко ценили его и считали драгоценным. Из этого металла изготавливаются ювелирные украшения, денежные знаки, его охотно выбирают в качестве источника инвестиций.
Краткая история появления
Серебро, как и золото, часто встречается в природе в виде самородков, поэтому история знакомства человечества с серебром и его применения насчитывает не менее 6000 лет. Ассирийцы и вавилоняне считали этот металл священным, а в Древнем Египте оно ценилось дороже золота.
Как выглядит серебро в природе
В природе это вещество находят как в виде самородков, так и в соединении с другими элементами. Науке известно около 50 таких содержащих металлическое или неметаллическое серебро минералов, порядка 20 из них добывают с целью получения драгоценного металла в промышленных масштабах.

Процесс образования в природе
Большинство ученых считает, что в природе аргентум не образуется и запасы его конечны. Как и другие тяжелые металлы, этот элемент предположительно входил в состав субстанции, из которой зародилась наша планета. Но пока эта версия доказательств не имеет и остается всего лишь гипотезой.
Структура, химические и физические свойства
Серебро – металл, устойчивый к кислороду, щелочам и большинству известных кислот. Оно слабо вступает в реакции с другими веществами.
Серебро обладает максимальной теплопроводностью среди металлов, высокой электропроводностью и великолепной отражательной способностью – 97% видимого глазу света. Это ковкое и очень эластичное вещество – 1 грамм можно растянуть в проволоку длиной более 2 км, а расплавить при температуре 962 °C.
Как находят серебряные жилы
В природе чистое серебро в виде самородков встречается довольно редко, поэтому обнаружить серебряное месторождение – большая удача. В России первые залежи драгоценного металла находили, в основном, по берегам рек. Но гораздо чаще этот драгметалл является составляющей частью полиметаллических руд в комплексных месторождениях. Около 80% всего серебра добывается в комплексе с другими полезными ископаемыми.
Спутники серебра
В качестве попутного компонента лунный металл часто встречается в рудах цветных и благородных металлов. Оно – постоянный спутник золотоносных жил. Широко распространены месторождения, где серебро находится в комплексе с медью, железом, свинцом, никелем, оловом и прочими составляющими.
Где встречается серебро в природе
Доля присутствия этого элемента в земной коре – самая значительная из благородных металлов. Среди остальных веществ серебро занимает почетное 65 место. Оно содержится в морской и пресной воде, пищевых продуктах и даже в человеческом мозге.
Встречается оно в торфяных, нефтяных, угольных и битумных месторождениях.

Основные залежи благородного металла, пригодные для промышленной разработки, расположены в зонах вулканических поясов, преимущественно в составе глинистых сланцев.
Виды месторождений
Способы добычи
В зависимости от глубины залегания серебросодержащих руд разработку месторождений ведут двумя методами: карьерным (открытым) или шахтным (закрытым). Добытую породу измельчают и подвергают обогащению, используя амальгамацию (растворение ртутью) или цианирование (растворение синильной кислотой).
Топ стран по добыче
Самая свежая информация, которую мне удалось найти – за 2017 год. Список лидеров по добыче серебра выглядит следующим образом:
- Мексика – 6108 т;
- Перу – 4587 т;
- Китай – 3502 т;
- Россия – 1306 т;
- Чили – 1260 т;
- Боливия – 1244 т;
- Польша – 1228 т;
- Австралия – 1101 т;
- США – 1048 т;
- Аргентина – 823 т.
Известно, что объемы добычи этого металла по всему миру продолжают сокращаться третий год подряд. С нетерпением ждем свежих итогов.
Мировые запасы серебра
Общий объем мировых запасов благородного металла оценивают приблизительно в 0,5 млн тонн, из них подтверждено примерно 360 тысяч тонн. По предварительным оценкам экспертов, залежей серебра в месторождениях осталось всего на 22 года при сохранении текущей интенсивности ежегодной добычи.
Сферы применения
Около 80% добытого металла потребляет промышленный сектор экономики. Остальные 20% идут на изготовление ювелирных изделий, нужды медицины и инвестиции.
Сложно перечислить все отрасли, где используют этот металл, поскольку сфера его применения слишком обширна. Это электронная техника, оптические приборы, материал для медицинского оборудования, управление погодой, фармакология, стоматология и многое другое.

В Японии серебро используют в устройствах для кондиционирования воздуха, в Америке кусочки металла кладут в молоко, чтобы не скисало.
В последние годы значительный рост спроса на серебро демонстрирует энергетический сектор экономики. Этот металл применяют при производстве современных высокотехнологичных солнечных батарей.
Самые богатые месторождения
Залежи серебра практически равномерно распределены по всем материкам, но в мире сформировались бесспорные лидеры по его добыче. Я составила списки самых богатых и известных на сегодняшний день месторождений.
В мире
Наиболее перспективные месторождения с ежегодной добычей серебра в них таковы:
- Каннингтон (Австралия), 1430 т;
- Фреснильо (Мексика), 982 т;
- Дукат (Россия), 375 т;
- Учучакуа (Перу), 305 т;
- Гринс Крик (США), 302 т;
- Арката (Перу), 247 т;
- Рочестер (США), 176 т;
- Имитер (Марокко), 153 т;
- Хуарон (Перу), 126 т;
- Лунное (Россия), 115 т.
В России
Россия – один из мировых лидеров по добыче серебра на сегодняшний день. Самые богатые месторождения с лучшими характеристиками по количеству благородного металла на тонну руды:
- Дукатское (Магадан), 640 г/т;
- Лунное (Магадан), 404 г/т;
- Хаканджинское (Хабаровск), 344 г/т;
- Гольцовое (Магадан), 1213 г/т;
- Прогноз (Якутия), 876 г/т;
- Подольское (Башкортостан), 28 г/т;
- Горевское (Красноярск), 56 г/т;
- Озерное (Бурятия), 35 г/т;
- Узельгинское (Челябинск), 30 г/т;
- Гайское (Оренбург), 11 г/т.
Преимущества и недостатки
Благодаря своим исключительным характеристикам электропроводности и теплопроводности серебро широко применяется в изготовлении электроприборов. Однако это слишком дорогой металл, чтобы использовать его в соответствии с потребностями.
Высокая отражательная способность обеспечивает великолепный блеск украшениям, изготовленным из него, но чистое серебро слишком мягкое, и драгоценности быстро теряют свою красоту. Поэтому приходится добавлять в состав легирующие металлы.
Сплавы и пробы
Драгоценный металл чаще всего используется в виде сплавов. То, из чего состоит лигатура, во многом определяет его свойства. Так, медь придает металлу твердость. Олово, цинк и кадмий делают сплав пригодным для припоев, сильно снижая температуру плавления. Никель усиливает прочность, а свинец и алюминий, напротив, делают вещество хрупким.
Для обозначения содержания чистоты сплава используют пробы. На изделие наносится маркировка в соответствии с метрической системой, например, 800 – 80% серебра и 20% лигатуры.

В ювелирных сплавах в качестве легирующей добавки применяется медь. С понижением пробы растет твердость металла, но снижается устойчивость к окислению и появляется заметная желтизна. Наиболее распространены следующие сорта:
- 800 – самый низкопробный и прочный, имеет явный желтоватый оттенок, изумительно подходит для изготовления перьевых ручек, столовых приборов и прочих активно используемых предметов .
- 830 – редко применяется в ювелирной промышленности из-за быстрого окисления и желтоватого оттенка металла.
- 875 – также обладает высокой прочностью, применяется при изготовлении недорогих ювелирных изделий.
- 916 – в данный момент не используется для создания украшений. Во времена СССР из такого сплава делали кувшины, сахарницы, соусницы и прочую утварь.
- 925 – так называемое стерлинговое серебро, прочное и ковкое. Ранее служил материалом для чеканки денежных знаков. Наиболее распространенный сплав.
- 960 – применяют для дорогих ювелирных изделий с филигранными элементами дизайна. Этот сплав – великолепный материал для тонкой работы, но слишком мягкий и легко поддается деформации.
- 999 – химически чистый металл, идет на создание инвестиционных инструментов: банковских слитков, памятных, юбилейных и прочих монет.
Таблица соответствия проб
Для определения пробы сплава во многих странах применяется каратная система, в которой проба в 24 карата соответствует чистому металлу. Для переведения значения каратной пробы в метрическую используют таблицы соответствия.
| Каратная система | 24К | 23К | 22К | 21К | 20К | 19К |
| Метрическая система | 999 | 960 | 925 | 875 | 830 | 800 |
Где можно купить или продать
В ювелирных магазинах можно приобрести украшение различной пробы на любой вкус и кошелек. Торговцы предоставляют широчайший выбор предметов из серебра всевозможных проб и видов.
Продать такое изделие проще всего в скупку, ломбард, или воспользовавшись всевозможными торговыми интернет площадками.
Сколько стоит 1 грамм на сегодня
Цена за 1 грамм серебра непрерывно меняется в зависимости от спроса и предложения на мировом рынке по результатам ежедневных торгов. На нее же ориентируются все торговцы, будь то банк или ломбард. Следить за изменениями стоимости металла следует при помощи интерактивной таблицы.
Цена за лом
Стоимость серебряного лома напрямую зависит от пробы металла и степени востребованности сплава на данный момент. Оставлю здесь таблицу с ценами за лом для удобства расчетов.
| Цена 999 пробы по ЦБ | Рыночная стоимость пробы на сегодня | Цена на лом | Цена в ювелирных |
|---|
Как отличить подделку
Есть парочка простых способов быстро проверить драгметалл на подлинность.
- Магнит – серебро и медь относятся к металлам-диамагнетикам, поэтому магнититься ни в коем случае не должны.
- Ляписный карандаш – не оставит следов на металле, поскольку это нитрат серебра, или, как он обозначается в химии, AgNO3.
- Уксус – поместите предмет в обычный столовый уксус. Подлинная вещь никак не отреагирует, а подделка побелеет.
- Тепло – серебро мгновенно нагреется, стоит на миг опустить его в кипяток.
Советы по выбору серебряных украшений
Выбирая вещь, опирайтесь на то, каким образом хотите ее использовать. Столовую утварь лучше выбрать из металла с пробой пониже, зато прочного. Повседневные украшения хороши из стерлингового сплава, из чего их и делают чаще всего. Предметы для особых случаев можно выбрать из высокопробного металла: использоваться они будут нечасто, зато и ухода особого не потребуют.
Рекомендации по уходу чистке и хранению
Держать серебро рекомендуется подальше от солнечных лучей, в отдельных мешочках или футлярах. Проводить чистку металла при первых признаках налета, поскольку со временем навести лоск будет все сложнее.
Такие предметы нуждаются в механической очистке, поскольку сульфид серебра – тот самый темный налет на изделии – мало чем растворяется. Для ухода за драгоценностями можно использовать зубную пасту и мягкую щетку или салфетку и осторожно, без нажима, провести соответствующие манипуляции.
Отзывы
Лидия:
Лет десять назад купила слиток серебра, очень выгодно продала недавно, рекомендую серебро в качестве денежных вложений.
Светлана:
Всегда любила серебряные украшения больше золота, да и для здоровья, говорят, полезно.
Григорий:
Купил для дома столовое серебро, пользуемся, продолжаем традиции предков, правда, жена ругается, что чистить устала.
Заключение
Надеюсь, эта статья была не просто занимательной, а позволила сделать определенные выводы насчет перспектив этого металла в качестве объекта денежных инвестиций и не только. Ваше желание поделиться статьей в социальных сетях горячо приветствуется. Оставайтесь нашими читателями, а я прощаюсь.
Источник
