СЕРЕБРО
Свойства. Серебро-белый блестящий металл, в тонких пленках и проходящем свете-голубого цвета. Кристаллизуется в гранецентрир. кубич. решетке, а = 0,4086 нм, z = 4, пространств. группа Fm3m; т. пл. 961,93 °С, т. кип. 2167°С; плотн. 10,491 г/см 3 ; 25,36 Дж/(моль·К); D H пл 11,30 кДж/моль, D H исп 251,5 кДж/моль; 42,55 Дж/(моль·К); ур-ния температурной зависимости давления пара над жидким серебром lgp(aтм) = -1,368·10 4 /Т+ 5.615, плотн. жидкого серебра d = = 10,465 — 9,67·10 -4 Т г/см 3 ; t крит 4395°С, p крит 33,6 МПа и u крит 339 см 3 /моль. Серебро обладает наиб. теплопроводностью и электрич. проводимостью: r 1,59 (0°С) и 8,4 мкОм·см (960 °С), теплопроводность 419 (293 К) и 377 Вт/(м·К) при 773 К. Примеси в серебре уменьшают его · теплопроводность и электрич. проводимость. Серебро диамагнитно, его магн. восприимчивость (—0,181·10 -9 ) не зависит от т-ры; коэф. Холла —0,9·10 10 . Серебро обладает высокой отражат. способностью: в ИК диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95% и снижается до 10% при длине волны 320 нм. Серебро-мягкий и пластичный металл; предел текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу 148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
Простое вещество и химический элемент. В чем разница
Из благородных металлов серебро-наиб. реакционноспособно. Тем не менее серебро химически мало активно и легко вытесняется из своих соед. более активными металлами. Углем, Н 2 и др. восстановителями ионы серебра восстанавливаются до Ag 0 . Стандартный электродный потенциал Ag + /Ag 0 0,799 В. При комнатной т-ре серебро не взаимод. с О 2 воздуха, но при нагр. до 170°С покрывается пленкой оксида Ag 2 O. Озон в присут. влаги окисляет серебро до высших оксидов-Ag 2 O 2 и Ag 2 O 3 . При взаимод. нагретого серебра с S или Н 2 S в присут. О 2 образуется серебра сульфид Ag 2 S. Халькогены, фосфор, мышьяк и углерод реагируют с нагретым серебром с образованием соответствующих бинарных соединений. Серебро легко раств. в разб. и конц. HNO 3 с образованием серебра нитрата AgNO 3 . При нагр. Ag раств. и в конц. H 2 SO 4 , давая сульфат Ag 2 SO 4 . Галогены в присут. влаги, а также конц. галогеноводород-ные к-ты медленно реагируют с металлическим серебром, давая серебра галогениды AgX. В присут. О 2 серебро легко раств. в р-рах цианидов щелочных металлов с образованием комплексных цианидов M 1 [Ag(CN) 2 ]. Расплавл. щелочи и орг. к-ты не действуют на металлическое серебро.
Известны многочисл. комплексные соединения серебра, в к-рых координац. число серебра равно 2, 3 и 4.
Большинство соед. Ag(I) плохо раств. в воде, за исключением AgF, AgNO 3 , AgClO 4 и AgClO 3 . Соли серебра-бесцв. или слегка желтоватые в-ва. На свету почти все соед. Ag(I) разлагаются до свободного серебра и при этом окрашиваются в серый или черный цвет, что используется в фотографии. Соединения серебра термодинамически мало устойчивы, причем углерод- и азотсодержащие соед. Ag(I) способны к разложению со взрывом.
Цепочки превращений по неорганической химии. Вариант №9. Свойства серебра (Ag).
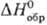
Оксид Ag(I) (гемиоксид) Ag 2 O при нагр. выше 100°С разлагается до Ag и О 2 ; р-римость в воде 1,3·10 3 г в 100 г воды (см. также табл.); водные р-ры Ag 2 O имеют щелочную р-цию вследствие частичного образования AgOH; в водной суспензии легко восстанавливается до металлического серебра водородом, СО, металлами и др. восстановителями; раств. в к-тах, водном NH 3 , цианидах и тиосульфатах щелочных металлов с образованием соответствующих простых и комплексных солей Ag(I); теряет на свету О 2 ; диамагнитен; получают при обработке р-ра AgNO 3 щелочами, применяют в гопкалитовых патронах противогазов, как окислитель в орг. синтезе; водные р-ры-антисептич. ср-во. Монооксид Ag 2 O 2 (или Ag I Ag III O 2 )-серые кристаллы моноклинной сингонии; разлагается выше 100 °С; —24,7 кДж/моль; получают окислением серебра или Ag 2 О озоном, анодным окислением серебра, используют для изготовления электродов в серебряно-цинковых элементах и аккумуляторах.
Гидроксид AgOH, по непроверенным сведениям, м.б. получен в виде неустойчивого белого осадка при обработке р-ра AgNO 3 в этаноле спиртовым р-ром КОН при — 45 °С; обладает амфотерными св-вами с преобладанием диссоциации по щелочному типу; для бесконечно разб. р-ров -124,36 кДж/моль, 61,70 Дж/(моль · К).
Сульфат Ag 2 SO 4 при 427°С переходит из ромбич. a -модификации в гексагон. b -модификацию, D H перехода 18,64 кДж/моль; выше 1100°С разлагается до Ag, SO 2 и О 2 ; р-римость в воде 0,8 г в 100 г при 20°С; в сернокислотных р-рах легко восстанавливается FeSO 4 , Zn и Mg до Ag 0 ; получают действием конц. H 2 SO 4 на Ag или Ag 2 O или обменной р-цией р-римых солей серебра с сульфатами металлов, в избытке H 2 SO 4 образуются гидросульфат AgHSO 4 и ад-дукты Ag 2 SO 4 c H 2 SO 4 .
Карбонат Ag 2 СО 3 выше 120 °С разлагается до Ag, CO 2 и О 2 ; р-римость в воде 3·10 -3 г в 100 г, раств. в водном NH 3 , цианидах и тиосульфатах щелочных металлов, с карбонатами др. металлов образует двойные карбонаты; получают действием р-ров карбонатов или гидрокарбонатов металлов на AgNO 3 .
Цианид AgCN практически не раств. в воде (2·10 -5 г в 100 г), в водном р-ре с избытком KCN образует комплексный цианоаргентат K[Ag(CN) 2 ], при действии к-т на цианоаргентаты выделяется синильная к-та HCN; получают действием р-ров KCN или NaCN на стехиометрич. кол-во AgNO 3 ; компонент электролитов при гальванич. серебрении, применяют также в произ-ве нитрилов и изо-нитрилов; ПДК 0,3 мг/м 3 (в пересчете на HCN).
Специфич. хим. св-во серебра-способность легко образовывать коллоидное серебро в р-ре при восстановлении соединений серебра или при диспергировании компактного металла. Золи серебра окрашены в разл. цвета-от фиолетового до оранжевого—в зависимости от размера частиц металла и способа получения золя. Серебро в коллоидном состоянии-энергичный восстановитель, катализатор окисления, бактерицидный препарат (колларгол, протаргол). Бактерицидные св-ва присущи и металлическому серебру: при концентрации серебра в р-ре 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
С еребро хорошо адсорбирует газы, такие, как Н 2 , О 2 , Аr и др. Так, при 500 °С Ag может поглощать до 5 объемов О 2 . При охлаждении жидкого серебра, содержащего растворенный в нем О 2 , выделение газа может происходить со взрывом.
Серебро образует множество интерметаллидов и сплавов с др. металлами. Так, с Pd и Аu серебро дает непрерывный ряд твердых р-ров, с Сu, Ni и Pb-эвтектич. сплавы, а с остальными металлами — интерметаллиды разл. состава. Введение металлов в серебро часто улучшает его мех. и хим. св-ва.
Получение. Первая стадия переработки всех серебросо-держащих руд-флотац. и гравитац. обогащение. Дальнейшие методы выделения серебра зависят от типа руды и содержания серебра и делятся на пирометаллургич. и гидрометаллургические. Полиметаллич. сульфидные руды не поддаются прямой гидрометаллургич. переработке и их вначале подвергают обжигу-окислительному, восстановительному (или хлорирующему). При обжиге свинцовых руд Ag 2 S концентрируется в оксиде Рb и затем в металлич. Рb. Для выделения серебра из Рb применяют методы Паркеса и Паттинсо-на. По методу Паркеса серебросодержащий Рb плавят вместе с Zn и серебро концентрируется в Zn в виде интерметаллидов. После отгонки Zn остаток купелируют (нагревают в печи в потоке воздуха) и отделяют сырое металлическое серебро от оксидов остальных металлов.
При переработке медных руд после окислит. и восстановит. плавок получают сплавы Сu с Ag, из к-рых серебро выделяют электролизом. Из сплава отливают аноды и при их растворении Си осаждается на катоде, а серебро концентрируется в шламе.
Собственно серебряные руды перерабатывают после обогащения методом цианирования, для чего руду обрабатывают в водном р-ре NaCN или KCN в присут. О 2 и затем серебро извлекают из комплексных цианидов восстановлением металлами или с использованием анионитов. В осн. история, интерес представляет сейчас амальгамный метод извлечения серебра, по к-рому руда смешивается в р-ре с Hg и хлоридами, при этом образуется амальгама серебра; из нее после отгонки Hg получают сырое серебро.
Для получения серебра высокой чистоты (99,999%) сырой металл подвергают электролитич. аффинажу в р-ре AgNO 3 с осаждением серебра на катоде (примеси переходят в шлам).
Все серебросодержащие отходы пром-сти (отработанные фотоматериалы, контакты, источники питания и т. п.) также подвергаются переработке с целью извлечения вторичного серебра, к-рое вновь расходуется в пром-сти в кол-ве 60-70% от общего потребления серебра.
Определение. Качественно серебро обнаруживают по цветным р-циям образования комплексов серебра с использованием орг. N- и S-содержащих реагентов (производные роданина, фе-нилтиомочевины, дитизона и т.п.). Применяют также восстановление серебра из р-ра до металла и микрокристаллич. р-ции образования AgCl, Ag 2 Cr 2 O 7 и комплекса серебра с уротропином.
Количественно серебро определяют гравиметрически (осаждение серебра в виде AgCl или комплекса серебра с бензотриазолом), титриметрически по Фольгарду с использованием р-ров KCNS или NH 4 CNS в присут. железо-аммониевых квасцов. Применяют колориметрич. методы с использованием производных роданина и дитизона, каталиметрич. (основанные на измерении скорости р-ции в присут. микрокол-в серебра), а также эмиссионно-спектральный и атомно-абсорбционный методы анализа.
Применение. Примерно 30-40% производимого серебра расходуют на изготовление кино- и фотоматериалов. Ок. 20% серебра в виде сплавов с Pd, Аu, Сu, Zn и др. металлами идет на изготовление контактов, припоев, проводящих слоев, элементов реле и др. устройств в электротехнике и электронике. Сплавы серебра с Аu и Сu, а также с Hg, Sn, Zn и Си используют в стоматологии для пломбирования и протезирования. 20-25% серебра расходуют на изготовление элементов питания-серебряно-цинковых аккумуляторов, обладающих высокой энергоемкостью (космич. и оборонная техника), оксидно-серебряных элементов питания часов и т.п. Из серебра изготовляют монеты, ювелирные изделия, украшения, столовую посуду. Серебро используют для серебрения зеркал, аппаратов в пищ. пром-сти, как катализатор процессов дожигания СО, восстановления NO и р-ций окисления в орг. синтезе.
Объем произ-ва первичного серебрс в мире колеблется в зависимости от цен на рынке. В связи с тем, что серебро-второй валютный металл, сведения о масштабах его произ-ва и потребления являются оценочными. В сер. 80-х гг. произ-во первичного серебра в развитых и развивающихся странах оценивалось в 10-15 тыс. т/год.
ПДК серебра в воздухе 0,1-0,5 мг/м 3 . При попадании р-римых соединений серебра на кожу и слизистые оболочки происходит восстановление серебра до серо-черного коллоидного металла. Это окрашивание пов-сти тканей (аргирия) исчезает в результате растворения и истирания коллоидного серебра вместе с кожей.
С еребро известно человеку с древнейших времен, еще в 4-м тыс. до н.э. оно использовалось для изготовления украшений, служило торговым эквивалентом в странах Востока.
Лит.: Пятницкий И. В., Сухан В. В., Аналитическая химия серебра, М., 1975; Малышев В.М., Румянцев Д. В., Серебро, 2 изд., М., 1987; Silver. Economics, metallurgy and use, Princeton (N.Y.), 1967; Thompson N. R., в кн.: Masscy A. G., The chemistry of cooper, Oxf., 1975. П.М. Чукуров.
ИсточникОсновные сведения о серебре, как химическом элементе
Серебро в химии имеет обозначение Ag (от латинского слова Argentum, восходит к греческому «белый, блестящий»). Это элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы) пятого периода периодической системы химических элементов Д.И. Менделеева. Атомный номер 47. Относительная атомная масса 107,87 г/моль.
Рисунок 1. Структура серебра и его внешний вид.
Серебро имеет структуру в виде кристаллов неправильной формы. Часто в ней попадаются зерна разных размеров. Они связаны решетчатым каркасом в виде гранецентрированного куба (атомы расположены на каждой вершине куба и в центре граней).
В природе металл встречается в виде самородков (содержат 95 —99% серебра и примеси золота, платины, меди и других металлов) и в составе примерно 60 минералов. В таблице 1 приведены минералы, которые встречаются чаще остальных.
| Название минерала | Дополнительные компоненты | Содержание серебра, % |
| электрум | золото | 20-28 |
| аргентит | сера | 87 |
| гессит | теллур | 63 |
| науманит | селен | 73 |
| дискразит | сурьма | до 74 |
| кераргирит | хлор | 75 |
| прустит | сера и мышьяк | 65 |
Таблица 1. Содержание серебра в разных минералах.
Также в качестве примеси серебро обнаружено во всех медных и свинцовых рудах. Именно из них получают до 80% всего добываемого серебра. Содержание серебра в рудах цветных металлов составляет 10—100 грамм на тонну, в золото-серебряных рудах 200—1000 грамм на тонну.
Серебряные руды разбросаны по всему миру, но лидерами по его добыче являются Мексика и Перу, за которыми с небольшим отрывом следуют Китай, Чили и Австралия. В России этот металл добывают из серебряно-свинцовых руд Урала, Алтая, Северного Кавказа.
Физические и химические свойства
Физические свойства
Таблица 1. Основные физические свойства серебра.
Химические свойства серебра обусловлены положением в таблице Д.И. Менделеева. Особенность строения атома серебра заключается в наличии одного электрона на пятой орбитали. Электронная формула: 1s22s22p63s23p63d104s24p64d105s1.
Может проявлять степени окисления: -2, -1, +1, +2, +3, наиболее стабильная +1. Валентности: I, II, III. Входит в группу благородных металлов и в электрохимическом ряду напряжений находится после водорода, поэтому не взаимодействует с некоторыми веществами.
Серебро не взаимодействует:
- с растворами разбавленных соляной и серной кислот, щелочами;
- с водой: растворимость серебра в воде — 0,04 мкг/л;
- с кислородом, углеродом, хлором в обычных условиях, азотом и кремнием.
1. С неметаллами:
а) сера в обычных условиях:
2 A g + S → A g 2 S сульфид серебра I.
б) галогены при нагревании с образованием галогенидов серебра I:
2 A g + B r 2 → t ° 2 A g B r бромид серебра I.
в) кислород при повышении давления и температуры до 170 °С образует на поверхности серебра пленку:
4 A g + O 2 → t ° 2 A g 2 O .
г) селен, теллур, фосфор, мышьяк и углерод при нагревании с образованием бинарных соединений типа: A g 2 S e селенид серебра, A g 3 P фосфид серебра, A g 4 C карбид серебра и т.п.
P + 3 A g → t ° A g 3 P .
а) в газообразном виде:
- с сероводородом на воздухе с образованием на поверхности металла темного налета: 4 A g + O 2 + 2 H 2 S → A g 2 S + 2 H 2 O ;
- с хлороводородом при нагревании: 2 A g + 2 H C l → t ° A g C l + H 2 .
б) H N O 3 , горячая H 2 S O 4 конц, HCl в присутствии свободного кислорода:
- 3 A g + 4 H N O 3 р а з б → 3 A g N O 3 н и т р а т с е р е б р а I и л и л я п и с + N O + H 2 O ;
- A g + 2 H N O 3 к о н ц → A g N O 3 + N O 2 ↑ + H 2 O ;
- 2 A g + 2 H 2 S O 4 к о н ц → t ° A g 2 S O 4 + S O 2 ↑ + H 2 O ;
- 4 A g + 4 H C l + O 2 → 4 A g C l + 2 H 2 O .
в) концентрированные HCl и HBr, медленно:
- 2 A g + 4 Н С l → 2 H [ A g C l 2 ] + Н 2 ;
- 2 A g + 4 Н В r → 2 H [ A g B r 2 ] + Н 2 .
3. С цианидами в присутствии кислорода воздуха с образованием дицианоаргентатов (I):
4 A g + 8 N a C N + O 2 + 2 H 2 O → 4 N a [ A g ( C N ) 2 ] д и ц и а н о а р г е н т а т н а т р и я + 4 N a O H .
4. С хлоридом железа (травление):
A g + F e C l 3 → A g C l + F e C l 2 .
5. Со ртутью серебро образует жидкий сплав — амальгаму.
Способы получения
1. Пирометаллургический способ позволяет получать серебро как побочный продукт при переработке свинцово-цинковых руд. Проходит в несколько стадий:
- руду смешивают с жидким цинком → интерметаллиды цинка с серебром A g 2 Z n 3 , A g 2 Z n 5 всплывают серебристым слоем на поверхности жидкого свинца;
- серебристый слой снимают, цинк удаляют перегонкой;
- свинец из остатка удаляют реакцией с кислородом: он выводится в виде оксида свинца (IV);
- далее серебро очищается электролитически.
2. Цианидное выщелачивание позволяет выделять серебро из тех руд, где оно содержится в малых количествах. Метод включает следующие стадии:
- обработка серебросодержащей руды раствором цианида натрия → серебро переходит в анионный комплекс N a [ A g ( C N ) 2 ] ;
- фильтрование через цинковую пыль, в ходе которого цинк вытесняет серебро: 2 N a [ A g ( C N ) 2 ] + Z n → N a 2 [ Z n ( C N ) 4 ] + 2 A g ↓ ;
- обработка серебряного осадка серной кислотой для удаления примесей;
- далее полученный остаток промывают, фильтруют, выпаривают и сплавляют в слитки.
3. При переработке медных руд серебро извлекают из анодного шлама методом электролитического рафинирования меди.
4. Амальгамный метод извлечения серебра уже не используется, но интересен с точки зрения истории:
- руда смешивается со ртутью → амальгама серебра;
- ртуть удаляют отгонкой → сырое серебро;
- сырой металл подвергают электролитическому очищению (аффинажу) в р-ре A g N O 3 с осаждением серебра высокой степени чистоты (99,9%) на катоде.
Сферы применения
- Ювелирное дело: изготовление украшений и посуды, декоративных изделий.
- Чеканка монет, медалей и других наград.
С середины XX века примерно 70% добываемого серебра расходуется промышленностью:
ИсточникСеребро

Серебро было известно человечеству еще 6 тысяч лет назад. Серебро — химический элемент 11 группы Таблицы Менделеева, обозначается Ag (от лат. Argrntum), благородный металл серебристо-белого цвета. Цвет серебра и дал ему название, латинское слово Argentum происходит от греческого argos — блестящий.
Серебро в природе
Исторические факты о серебре
Существует легенда, что первые серебряные рудники были открыты в 968 г. никем иным как основателем Священной Римской империи восточно-франкским королём Оттоном I Великим. Легенда гласит, что однажды король послал своего егеря в лес на охоту. Во время охоты тот привязал коня к дереву, который в ожидании хозяина разрыл копытами землю, где оказались необычные светлые камни. Император понял, что это серебро и повелел основать на этом месте рудник. Существуют данные, что этот богатейший рудник разрабатывался еще спустя шесть веков. Об этом свидетельствуют записи немецкого врача и металлурга Георга Агриколы (1494–1555).
Вообще Центральная Европа была очень богата залежами серебряных самородков. В Саксонии в 1477 году был найден один из самых больших самородков в истории массой до 20 тонн! Из серебра добытого в Чехии, близ города Иоахимсталя, были отчеканены миллионы европейских монет. Поэтому их так и называли — «иоахимсталер»; со временем слово укоротилось до «талера». В России это название переиначили на свой лад и у нас они назывались «ефи́мками». Серебряные талеры были самой распространенной европейской монетой в истории, от этого название пошло современное название «доллар».

Чешский богемский Иоахимсталер
Европейские серебряные рудники были настолько богаты, что расход серебра измерялся в тоннах! Но т.к. основная масса европейских серебряных рудников была открыта в XIV-XVI вв., то к настоящему времени они уже истощены.
После открытия Америки оказалось, что этот континент очень богат на серебро. Его залежи были обнаружены в Чили, Перу и Мексике. Аргентина даже получила название по латинскому имени серебра. Тут нужно указать на очень интересный факт. Географические названия химических элементов обычно давались элементу от названия какого-то места, например, гафний назван так от латинского наименования города Копенгаген, в котором он был открыт, географические названия имеют элементы полоний, рутений, галлий и другие. Тут же произошло все с точностью наоборот. Страна была названа по имени химического элемента! Это единственный подобный случай в истории. Самородки серебра находят в Америке и в настоящее время. Один из них был открыт уже в XX веке в Канаде. Этот самородок был длиной 30 метров и глубиной 18 метров! После освоения этого самородка оказалось, что он содержал 20 тонн чистого серебра!
Химические свойства серебра
Серебро — сравнительно мягкий и пластичный металл, из 1 г его можно вытянуть металлическую нить длиной 2 км! Серебро тяжёлый металл, имеет низкую теплопроводность и электропроводность. Температура плавления относительно невысок, всего 962° С. Серебро охотно образует сплавы с другими металлами, которые придают ему новые свойства, например, при добавлении меди получается более твердый сплав — биллон.
При нормальных условиях серебро не подвержено окислению, однако имеет способность поглощать кислород. Твердое серебро при нагреве способно растворить в пять раз больший объем кислорода! В жидком серебре растворяются еще больший объем газа, примерно 20:1.
Иод способен воздействовать на серебро. Особенно благородный металл «боится» иодную настойку и сероводород. В этом и заключается причина потемнения серебра со временем. Источником сероводорода в быту служат испорченные яйца, резина, некоторые полимеры. При реакции сероводорода и серебра, особенно при повышенной влажности, на поверхности металла образуется очень прочная сульфидная плёнка, которая не разрушается при нагреве и воздействии кислот и щелочей. Удалить её можно только механическим способом, например щеткой с нанесенной на неё зубной пастой.
Интересны биохимические свойства серебра. Несмотря на то, что серебро не является биоэлементом оно способно оказывать влияние на жизнедеятельность микробов подавляя работу их ферментов. Это происходит при соединении серебра с аминокислотой, входящей в состав фермента. Поэтому вода в серебряных сосудах не портится, т.к. в ней подавляется жизнедеятельность бактерий.
Применение серебра
Уже с давних времен серебро использовали при изготовлении зеркал, в настоящее время его заменяют алюминием для удешевления производства. Низкое электрическое сопротивление серебра находит применение в электротехнике и электронике, тут из него изготавливают разнообразные контакты и разъемы. В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности.
Интересно применение иодида серебра. С его помощью можно управлять погодой. Распыляя ничтожные количества иодида серебра с самолета, добиваются образования водяных капель, т.е. проще говоря вызывается дождь. При необходимости можно выполнить и противоположную задачу, когда дождь совершенно не нужен, например, при проведении какого-то очень важного мероприятия. Для этого иодид серебра распыляют за десятки километров до места события, тогда дождь прольется там, а в нужном месте будет сухая погода.
Серебро широко применяется в медицине. Его используют как зубные протезы, в производстве лекарств (колларгол, протаргол, ляпис и др.) и медицинских инструментов.

Серебряный столовый сервиз
Влияние серебра на человека
Как мы видели выше, использование небольших доз серебра имеет обеззараживающее и бактерицидное действие. Однако, что полезно в малых дозах, очень часто бывает губительно в больших. Серебро здесь не исключение. Повышение концентрации серебра в организме может вызвать снижение иммунитета, повреждения почек и печени, щитовидной железы и головного мозга. В медицине описаны случаи нарушения психики при отравлении серебром.
Многолетнее поступление серебра в организм малыми дозами приводит к развитию аргирии. Металл постепенно откладывается в тканях органов и придает им зеленоватый или голубоватый цвет, особенно виден этот эффект на коже. При тяжелых случаях аргирии кожа темнеет настолько, что становится похожа на кожу африканцев. Кроме косметического эффекта в остальном аргирия не оказывает какого то ухудшения самочувствия и расстройства работы организма. Но и тут имеется свой плюс, при том, что организм пропитан серебром, ему становятся нипочем любые инфекционные заболевания!

Американец Пол Карсон «Папа Смурф», страдавший аргирией
ИсточникСеребро и его характеристики
Серебро – сорок седьмой элемент Периодической таблицы. Обозначение – Ag от латинского «argentum». Расположен в пятом периоде, IB группе. Относится к металлам. Заряд ядра равен 47.
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих руд получают около 80% всего добываемого серебра.
Чистое серебро – очень мягкий, тягучий металл (рис. 1), оно лучше всех металлов проводит теплоту и электрический ток.
Серебро – малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов – результат образования на поверхности черного сульфида серебра Ag2S.

Рис. 1. Серебро. Внешний вид.
Атомная и молекулярная масса серебра
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии серебро существует в виде одноатомных молекул Ag, значения его атомной и молекулярной масс совпадают. Они равны 107,8682.
Изотопы серебра
Известно, что в природе серебро может находиться в виде двух стабильных изотопов 107 Ag и 109 Ag. Их массовые числа равны 107 и 109 соответственно. Ядро атома изотопа серебра 107 Ag содержит сорок семь протонов и шестьдесят нейтронов, а изотопа 109 Ag – такое число протонов и шестьдесят два нейтрона.
Существуют искусственные нестабильные изотопы серебра с массовыми числами от 93-х до 130-ти, а также тридцать шесть изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 104 Ag с периодом полураспада равным 69,2 минуты.
Ионы серебра
На внешнем энергетическом уровне атома серебра имеется один электрон, который является валентным:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 9 5s 2 .
В результате химического взаимодействия серебро отдает свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
Молекула и атом серебра
В свободном состоянии серебро существует в виде одноатомных молекул Ag. Приведем некоторые свойства, характеризующие атом и молекулу серебра:
Энергия ионизации атома, кДж/моль
Радиус атома, нм
Сплавы серебра
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18 г/моль): |
m (H2O)= 20 × 18 = 360 г.
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
ω (AgNO3)=40 / 400 × 100% = 10%.
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет х моль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
m (Cu) = n (Cu) × M (Cu);
m (Cu)= x × 64 = 64x.
m (Ag) = n (Ag) × M (Ag);
m (Ag)= x × 108 = 108y.
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
188 х + 170 у = 7,34.
Получили систему уравнений с двумя неизвестными:
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
Источник