Глава 6. Карбонильные соединения. Альдегиды и кетоны 3. Реакция с гидросульфитом натрия Альдегиды и кетоны способны взаимодействовать с гидросульфитом на- трия: Эта реакция позволяет не только обнаружить карбонильные соединения, но и очистить их от примесей и выделить из смеси с другими веществами.
Образующиеся сульфопроизводные выпадают в осадок и легко разлагаются кислотами с образованием исходного альдегида. 4. Взаимодействие со спиртами с образованием полуацеталей и ацеталей Имея в составе молекул полярную карбонильную группу, альдегиды и ке- тоны способны вступать в реакции присоединения с полярными и малополярными веществами.
Одной из таких реакций является взаимодействие альдегидов и кетонов со спиртами с образованием полуацеталей и полукеталей: Полуацеталь Равновесие в этой реакции смещено в сторону исходных соединений. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта образуется ацеталь: Ацетали — жидкости с приятным эфирным запахом.
Химия 10 класс (Урок№8 — Альдегиды и кетоны.)
При нагревании с разбавленными минеральными кислотами они подвергаются гидролизу с образованием спиртов и выделением альдегидов. Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол. Рассмотрим эту реакцию на примере формальдегида. Формальдегид в водном растворе при 20 °С существует преимущественно в виде гидрата, так как присоединяет воду:
§ 37. Химические свойства альдегидов и кетонов Для предотвращения полимеризации формальдегида в его водные растворы добавляется небольшое количество метанола. При этом образуются полуацетали и ацетали: 5. Присоединение реактива Гриньяра Реактив Гриньяра получают взаимодействием алкилгалогенидов с метал- лическим магнием в растворе сухого диэтилового эфира: R–Br + Mg → RMgBr (Алкилмагнийбромид). Альдегиды образуют с реактивом Гриньяра вторичные спирты. Например, из уксусного альдегида и этилмагнийбромида можно синтезировать вторичный бутиловый спирт бутанол-2, а из ацетона — третичный спирт 2-метилбу- танол-2:
§ 37. Химические свойства альдегидов и кетонов Они окисляются лишь в жестких условиях (нагревание с азотной или хромовой кислотами) с разрывом углерод-углеродных связей, ближайших к карбонильной группе: Интересной реакцией самоокисления — самовосстановления является реакция Канниццаро . Итальянский химик Станислао Канниццаро (Stanislao Cannizzaro) обнаружил, что при нагревании бензальдегида с карбонатом калия запах горького миндаля, характерный для этого альдегида, исчезает. При анализе получившихся продуктов было установлено, что образуются два органических соединения: продукт восстановления (бензиловый спирт) и продукт окисления бензальдегида (бензойная кислота): еакции конденсации Альдольная конденсация . Эта реакция, открытая русским химиком А.П. Бородиным, катализируется щелочами и характерна для альдегидов и кетонов, в молекулах которых атом углерода, непосредственно связанный с карбонильной группой (α-углеродный атом), имеет хотя бы один водородный атом. Акцепторная карбонильная группа влияет на подвижность α-водородных атомов, вызывая поляризацию связи С–Н.
Альдегиды и кетоны: свойства, про которые не пишут в учебниках… | Химия ЕГЭ | Умскул
§ 37. Химические свойства альдегидов и кетонов Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми ( инсектициды ), в том числе хлорофос, а также различные гербициды. Галоформная реакция.
На том же свойстве основана качественная реакция на метилкетоны и ацетальдегид — иодоформная реакция , или проба Люголя , — взаимодействие с иодом в растворе щелочи, в результате которого образуется желтый осадок иодоформа: ВОПРОСЫ И УПРАЖНЕНИЯ 1. Составьте уравнения реакций, в ходе которых из альдегидов образуются: а) 2-гид- роксибутаннитрил; б) бензойная кислота; в) изобутиловый спирт. 2. Составьте формулы возможных изомеров дихлорпропана. Какой из них при щелочном гидролизе образует соединение, вступающее в реакцию «серебряного зеркала » ? 3. Какие из приведенных ниже веществ будут реагировать с аммиачным раствором оксида серебра: этилформиат, пропин, пропанол-1, масляный альдегид, пента- нон-2? 4. Напишите уравнения реакций, позволяющих осуществить следующие превращения, и укажите условия их проведения:
| а) | СH 3 –CHO → CH 3 –CH 2 –OH → CH 2 =CH 2 → HC≡CH → CH 3 –CHO; |
| б) | СН 4 → CH 3 Cl → CH 3 OH → HCHO → фенолоформальдегидная смола. |
5. В трех пробирках без этикеток находятся растворы уксусного альдегида, этиленгликоля и ацетона. Как при помощи растворов сульфата меди(II) и гидроксида натрия узнать, в какой из пробирок какое вещество находится? 6. В трех склянках без этикеток находятся растворы пропаналя, пропанола-1 и пропанона. Предложите несколько способов распознавания этих веществ и запишите уравнения соответствующих химических реакций. 7. Напишите уравнения реакций, с помощью которых можно осуществить синтез:
| а) | 2-гидроксипропаналя из неорганических веществ; |
| б) | бутилового спирта из ацетилена. |
8. Органическое вещество, содержащее 62,0 % углерода, 27,6 % кислорода и 10,4 % водорода, легко восстанавливает аммиачный раствор оксида серебра. Определите структурную формулу этого вещества. 9. Какой объем формалина с массовой долей НСНО 40 % ( ρ = 1,1 г/мл) можно получить при окислении 200 мл 60%-ного раствора метилового спирта ( ρ = 0,8 г/мл)?
Глава 6. Карбонильные соединения. Альдегиды и кетоны 10. При окислении 4,3 г альдегида аммиачным раствором оксида серебра выделилось 10,8 г металла. Напишите формулы всех возможных изомеров и назовите их по международной номенклатуре. 11.
Какая масса нитрата серебра потребуется для приготовления реактива Толленса, чтобы полученным реагентом окислить формальдегид, содержащийся в 200 г формалина с массовой долей формальдегида, равной 40 %? § 38. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ АЛЬДЕГИДОВ И КЕТОНОВ Формальдегид Формальдегид — бесцветный газ с резким удушливым запахом, температурой кипения –21 °С; хорошо растворим в воде; токсичен, действует раздражающе на слизистые оболочки дыхательных путей.
Формальдегид легко полимеризуется, образуя тример циклической структуры (триоксан) или полиформальдегид (параформ) — полимер линейного строения (–О– СН 2 –) n . Выпускают формальдегид в виде водных растворов, стабилизированных метанолом, либо в виде твердых полимеров — параформа и триоксана. Раствор формалина, обычно 37–40%-ный (формальдегид хорошо растворяется в воде и спирте), — прекрасный консервант костного материала, необходимого для восстановления тканей, проведения пластических операций. Значительные количества формальдегида расходуются на производство фенолоформальдегидных смол. Из формальдегида получают лекарственные препараты, смолы, пластмассы, продукты органического синтеза.
§ 38. Важнейшие представители альдегидов и кетонов Реакция формальдегида с мочевиной может быть использована для синтеза карбамидных смол — аминопластов. При нагревании формальдегида с аммиаком получают уротропин (гексаметилентетрамин). Это вещество впервые было синтезировано А. М. Бутлеровым.
Уротропин применяют в производстве взрывчатых веществ (гексогена), используют в медицине в качестве мочегонного средства, при лечении почечных заболеваний и т. д. Формальдегид способен к реакции полимеризации с образованием циклического полимера, который не проявляет свойств альдегида, но при деполимеризации высвобождает формальдегид. Так называемое сухое горючее , или сухой спирт , который используют туристы, — это спрессованные таблетки триоксана и уротропина.
Уксусный альдегид (ацетальдегид, этаналь) Уксусный альдегид — бесцветная жидкость с температурой кипения 20 о С, имеющая резкий неприятный запах и хорошо растворимая в воде. Подобно муравьиному альдегиду, он легко тримеризуется с образованием паральдегида — жидкости с температурой кипения 124,5 °С. Из уксусного альдегида получают уксусную кислоту, сложные эфиры, этиловый спирт и т. д. Бензальдегид Из ароматических альдегидов наибольшее значение имеет бензальдегид — бесцветная маслянистая жидкость с запахом горького миндаля, плохо растворимая в воде, но хорошо — в этаноле. Бензальдегид легко окисляется на воздухе до бензойной кислоты.
Глава 6. Карбонильные соединения. Альдегиды и кетоны Альдегидная группа является мета -ориентантом, поэтому в реакциях электрофильного замещения новый заместитель займет мета- положение по отношению к группе –СНО.
Бензальдегид можно получить при реакции щелочного гидролиза дигалогенопроизводного толуола: Бензальдегид содержится в эфирных маслах, а в виде глюкозид а амигдалина — в семенах горького миндаля, косточках вишни, абрикоса, персика. Он нашел применение в качестве компонента парфюмерных композиций и пищевых эссенций, как сырье для синтеза душистых веществ — коричного альдегида, коричной кислоты, бензилбензоата, трифенилметановых красителей и т. д. Ацетон Ацетон (пропанон) — бесцветная легколетучая жидкость с характерным запахом и температурой кипения 56,1 °С; легче воды и смешивается ней в любых соотношениях; хорошо растворяется во многих органических растворителях и сам является прекрасным растворителем.
Ацетон получают при окислении вторичного спирта пропанола-2 или, наряду с фенолом, при окислении кумола (изопропилбензола). Акролеин Простейший непредельный альдегид акролеин — бесцветная жидкость с резким характерным запахом и температурой кипения 52,5 °С. Акролеину свойственны реакции алкенов и альдегидов.
В его молекуле имеется сопряженная диеновая система, что сказывается и на длинах связей: двойная связь С=С несколько длиннее двойной связи в алкенах (0,136 нм), а простая связь С–С короче, чем в алканах (0, 146 нм). Как и в случае диеновых углеводородов, сопряжение у акролеина проявляется в его способности к реакциям 1,4-присоединения. Например, при гидробромировании акролеина протон присоединяется к атому кислорода карбонильной группы: именно здесь сосредоточен частичный отрицательный заряд. Бромид-ион присоеди-
§ 38. Важнейшие представители альдегидов и кетонов няется к концевому углеродному атому сопряженной системы. В результате образуется непредельный спирт, содержащий гидроксильную группу при атоме углерода в sp 2 -гибридном состоянии. Он неустойчив и претерпевает перегруппировку Эльтекова — Эрленмейера, превращаясь в β-бромпропионовый альдегид: ВОПРОСЫ И УПРАЖНЕНИЯ 1. Рассмотрите возможность протекания реакции между такими веществами, как:
| а) | пропеналь и хлор; |
| б) | терефталевая кислота и этиленгликоль; |
| в) | акролеин и перманганат калия; |
| г) | пропеналь и водород; |
| д) | 2-гидроксипропановая кислота и натрий. |
2. Напишите уравнение реакции присоединения HCl к акролеину. Почему в этом случае реакция идет против правила Марковникова? 3. Обсудите различные пути синтеза бензальдегида с использованием в качестве исходного соединения бензола и любых неорганических реагентов. 4. Какие особенности строения формальдегида и фенола обеспечивают возможность их взаимодействия с образованием фенолоформальдегидных смол? 5. Экономически выгодным способом производства формальдегида является окисление метанола в избытке воздуха при 350–430 °С на окисном железо-молибдено- вом катализаторе состава MoO 3 ·Fe 2 (MoO 4 ) 3 . Вычислите выход формальдегида от теоретически возможного, если из 8 кг метанола удается получить 5,544 м 3 (н. у.) формальдегида.
Источник: studfile.net
Химические свойства кетонов, альдегидов: реакции нуклеофильного присоединения, восстановления, окисления. Уравнения реакций.
Химические свойства. Химические свойства альдегидов и кетонов обусловлены присутствиемв их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода(>С==О).
В результате на карбонильном атоме углерода (карбанион) возникает заметный положительный заряд. Поэтому для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О. Большинство из них протекает как нуклеофильное присоединение.
Кроме реакции присоединения по карбонильной группе, для альдегидов характерны также реакции с участием -атомов водорода, соседних с карбонильной группой. Их реакционная способность связана с электроноакцепторным влиянием карбонильной группы, которое проявляется в повышенной полярности связи С—Н. Это приводит к тому, что альдегиды, в отличие от кетонов, легко окисляются. Их взаимодействие с аммиачным раствором оксида серебра является качественной реакцией на альдегиды.
1. Реакция с циановодорооной (синильной) кислотой. Реакция имеет важное значение в органическойхимии. Во-первых, в результате реакции можно удлинить углеродную цепь; во-вторых, продукты реакции — гидроксинитрилы — служат исходными соединениями для синтеза гидроксикарбоновых кислот:
2. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
Реакцию получения ацеталей широко используют в органических синтезах для “защиты” активной альдегидной группы от нежелательных реакций:
Особенно важное значение подобные реакции имеют в химии углеводов.
3. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для полученияих в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
4. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
где R — алкильный или арильный радикал, Х — галоген.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
5. Восстановление оксосоединений (см. “Спирты”).
Кетоны к действию окислителей инертны, в частности они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать углерод-углеродные связи вих молекуле.
а) Однойиз качественных реакций для обнаружения альдегидной группы является реакция “серебряного зеркала” — окисление альдегидов оксидом серебра.
Оксид серебра всегда готовят непосредственно перед опытом, добавляя к раствору нитрата серебра раствор гидроксида аммония:
В растворе аммиака оксид серебра образует комплексное соединение, при действии которого на альдегид происходит окислительно-восстановительная реакция. Альдегид окисляется в соответствующую кислоту (точнее, в ее аммонийную соль), а комплексный катион восстанавливается до металлического серебра, которое дает блестящий налет на стенках пробирки — “серебряное зеркало”:
б) Другая качественная реакция на альдегиды заключается в окисленииих гидроксидом меди (II). При окислении альдегида светло-голубой гидроксид меди (II) превращается в желтый гидроксид меди (I) при комнатной температуре. Если подогреть раствор, то гидроксид меди (I) превращается в оксид меди (I) красного цвета, который плохо растворим в воде и выпадает в осадок:
Поликонденсация — это процесс образования высокомолекулярных соединений из низкомолекулярных, сопровождающийся выделением побочного вещества (воды, аммиака, хлороводорода и др.).
При полимеризации в отличие от поликонденсации выделения побочных веществ не происходит. Продукты поликонденсации (исключая побочные вещества) так же, как и продукты полимеризации, называются полимерами.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты —важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготовляются большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Классификация углеводов. Моносахариды, их классификация, номенклатура, важнейшие представители. Строение наиболее важных пентоз(рибоза, дезоксирибоза, ксилоза), гексоз(глюкоза, галактоза, манноза, фруктоза).
Классификация углеводов основана на их способности гидролизоваться. Углеводы разделяются на простые и сложные. Простые углеводы иначе называются моносахаридами, они не подвергаются гидролизу. Сложные подразделяют на олигосахариды и полисахариды. В состав олигосахаридов входят от двух до десяти моносахаридов.
В зависимости от числа моносахаридов, входящих в структуру, олигосахариды называют ди-, три-, тетрасахаридами и т.д. К полисахаридам относятся углеводы, в состав которых входят
более 10 моносахаридных остатков. Сложные углеводы при гидролизе распадаются с образованием простых.
Моносахариды иначе называют монозами. По химическому составу монозы являются либо полигидроксиальдегидами, либо полигидроксикетонами. Моносахариды, в состав которых входит альдегидная группа ( ), называют альдозами, а кетонная(
), называют альдозами, а кетонная( ) — кетозами.
) — кетозами.
Характерной особенностью класса углеводов является наличие не менее двух гидроксильных групп и одной карбонильной (альдегидной или кетонной) группы. Следовательно, простейший углевод должен содержать три атома углерода. По числу атомов углерода моносахариды называют триозами, тетрозами, пентозами, гексозами и т.д. В названии моноз учитывается как число атомов углерода, так и наличие альдегидной или кетонной группы. Например, моносахариды, в состав которых входят 6 атомов углерода и альдегидная группа, называются альдогексозами, если же они содержат кето-группу, то кетогексозами.
Структурные формулы. 3.Дезоксирибоза отличается от рибозы отсутствием в молекуле одной гидроксильной группы (оксигруппы), которая заменена атомом водорода. Отсюда и произошло название вещества (дезоксирибоза).
тправлено 26 Апрель 2011 — 01:17
Ксилоза
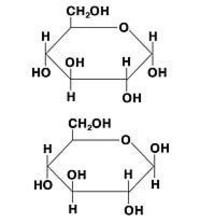
Глюкоза
Галактоза
Манноза
Фруктоза
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Химические свойства
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
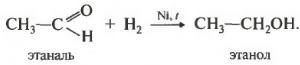
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
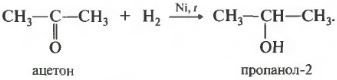
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
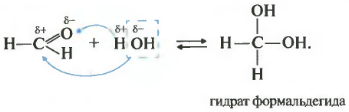
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.
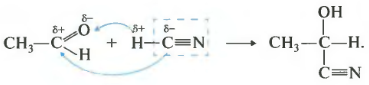
Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.
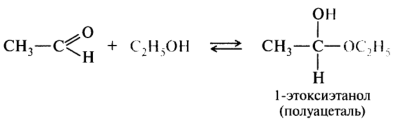
Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.
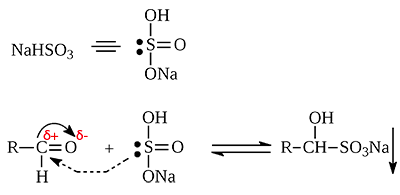
И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
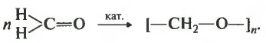
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
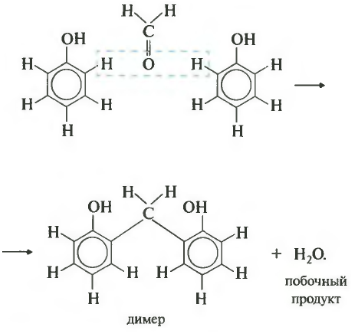
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.
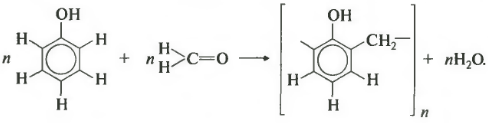
Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.
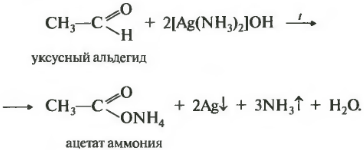
Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.
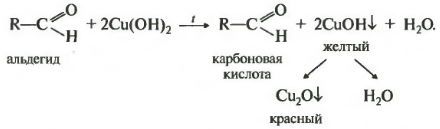
Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
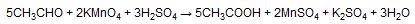
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO2, проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.

Запишем уравнение реакции в общем виде.

По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде.
Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
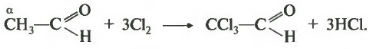
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Источник: stepenin.ru