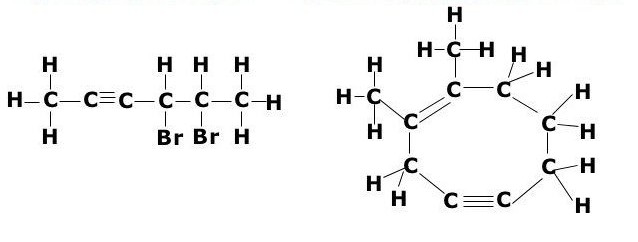
Ацетиленовые углеводороды – это ненасыщенные углеводороды, имеющие в своем составе одну тройную связь. Тройная связь – это сочетание одной s- и двух p-связей. Общая формула алкинов -СnH2n-2 . По систематической номенклатуре ацетиленовые углеводороды называют, заменяя в названиях суффикс -ан в предельных углеводородах на суффикс -ин. Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи. Пространственная изомерия не характерна.
Таблица 6. Гомологический ряд ацетиленовых углеводородов
| Предельные углеводороды | Ацетиленовые углеводороды |
| Метан СН4 | — |
| Этан С2Н6 | Этин (ацетилен) С2Н2 |
| Пропан С3Н8 | Пропин С3Н4 |
| Бутан С4Н10 | Бутин С4Н6 |
| Пентан С5Н12 | Пентин С5Н8 |
| Гексан С6Н14 | Гексин С6Н10 |
| и.т.д. | и.т.д. |
Алкины. Органическая химия
Физические свойства алкинов
В нормальных условиях: С2-С4 – газы; С5 –С16 – жидкости; С17 и более – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алканов. Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая.
На основе алкинов производят много различных соединений, имеющих широкое применение в промышленности. Например, получают изопрен – исходное соединения для производства изопренового каучука. Ацетилен используют для сварки металлов, т.к. процесс его горения весьма экзотермичный.
Получение алкинов
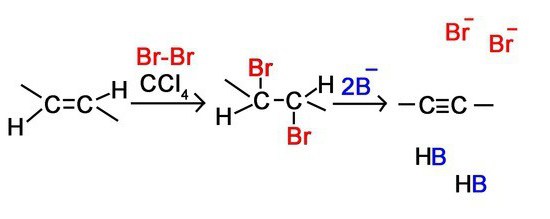
1. Отщепление 2-х молекул галогенводорода от дигалогенааконов, которые находятся либо у соседних атомов углерода или у одного. Отщепление происходит под воздействием спиртового раствора щелочи:
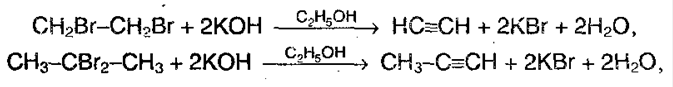
2. Действие галогеналканов на соли ацетиленовых углевородородов:

3. Крекинг метана и его гомологов:
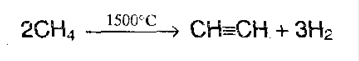


5. Ацетилен получают в лаборатории:

Химические свойства ацетиленовых углеводородов
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и Получение
1. Галогенирование. Алкины также, как алкены, обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов. Галогены присоединяются к алкинам в 2 стадии:

2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько труднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях можно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:

Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:
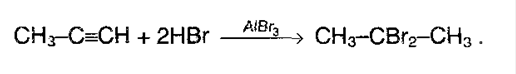
3. Гидратация. Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
Только ацетилен превращается в альдегид, его гомологи — в кетоны. Реакция протекает по правилу В.В. Марковникова:

Эта реакция носит названия – реакции М.Г. Кучерова.
4. Гидрирование. Протекает в две стадии под действием катализаторов (Ni, Pt, Pd):

5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:
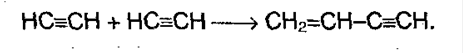
Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:

6. Получение бензола. Если ацетилен пропускать через уголь при 600ºС, получают ароматическое соединение – бензол.

.
Из гомологов ацетилена, получают гомологи бензола:

7. Присоединение циановодородной кислоты:
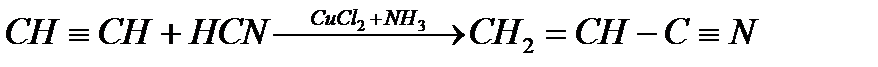
Ацетилен Акрилонитрил
Акрилонитрил – мономер для получения синтетического волокна – полиакрилонитрила.
8. Присоединение спирта (реакция А.Е.Фаворского):

Ацетилен Этиловый спирт Этилвиниловый эфир

9. Реакция окисления.и восстановления. Алкины легко окисляются пер-манганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:
10. Реакция восстановления.В присутствие металлических катализаторов происходит восстановление водородом:
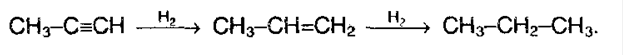
11. Присоединение ацетона. Это реакции, имеющие большое практическое значение. Например, из ацетилена и ацетона можно получить изопрен (реакция Фаворского):

Ацетон Ацетилен

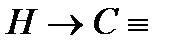
11. Замещение атома водорода при тройной связи. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Это обусловлено сильной поляризацией связи , причиной этого является высокая электроотрицательность атома углерода в состоянии sp- гибридизации. Поэтому алкины образуют ацетилениды:

Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественнымина концевую тройную связь:

Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин, поэтому алкины легко выделить из смеси других углеводородоров:

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дата добавления: 2018-05-13 ; просмотров: 4099 ; Мы поможем в написании вашей работы!
Источник: studopedia.net
Алкины

Общая формула: CnH2n-2, n≥2
Изомерия и номенклатура
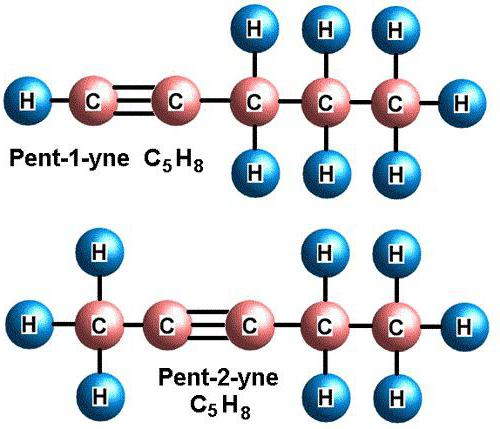
Существует 2 типа изомерии алкинов: изомерия положения тройной связи и изомерия цепи. Первые два члена гомологического ряда – этин и пропин – изомеров не имеют.

В случае бутинов возможен только один вид изомерии – изомерия положения тройной связи.


Алкины изомерны другому классу соединений – алкадиенам:
Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов.
Химические свойства
Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять 2 молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.
1.Присоединение водорода (гидрирование)

На I ступени образуются алкены, на II ступени – алканы:

2.Присоединение галогенов (галогенирование)

На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы:
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается.
3.Присоединение галогенводородов (гидрогалогенирование)

На I ступени образуются моногалогеналкены, на II – дигалогеналканы:

4.Присоединение воды (гидратация)

Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г.Кучерова):
1.Горение (полное окисление)
2.Неполное окисление (под действием окислителей типа KMnO4, K2Cr2O7)
При действии сильных окислителей алкины окисляются с разрывом молекулы тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты:


При неполном окислении ацетилена образуется двухосновная щавелевая кислота:
Реакция с KMnO4 является качественной реакцией на алкины. Раствор KMnO4 обесцвечивается.
Алкины могут образовывать линейные димеры, триммеры и полимеры, циклические триммеры.

Линейная полимеризация ацетилена происходит в присутствии солей Cu + :

Циклотримеризация алкинов приводит к бензолу и другим ароматическим УВ (Н.Д.Зелинский, Б.А.Казанский):

Атомы водорода, связанные с sp-гибридизованными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией связи ≡С – Н. В связи с этим данные атомы водорода могут замещаться атомами металлов, в результате чего образуются ацетилениды. Способность к таким реакциям отличает алкины от других непредельных углеводородов.
Получение алкинов
Ацетилен
- В промышленности
Термическое разложение природного газа или УВ нефти:
Гидролиз карбида кальция (реакция впервые осуществляется немецким химиком Ф.Велером):
Гомологи ацетилена

Дегидрогалогенирование дигалогеналканов (- 2ННаl) действием спиртового раствора щелочи или твердой щелочи при нагревании:
Скачать:
Скачать бесплатно реферат на тему: «Получение алканов, алкенов, алкинов»[download >
а также: «Процесс получения ацетилена термоокислительным пиролизом»[download >
Скачать рефераты по другим темам можно здесь
Вам также может быть интересно

Фосфор в химии: подготовка к ЕГЭ (формула, химические свойства, описание, получение и применение)

Периодическая таблица Менделеева: как ей пользоваться правильно (просто и понятно в одной статье)

Алюминий в химии: подготовка к ЕГЭ (формула, химические свойства, подробное описание и происхождение)

Аммиак: формула и способы получения (основные свойства, характеристики, строение и химические реакции)

Азот в химии: подготовка к ЕГЭ (формула, химические свойства, классификация, подробное описание, получение и происхождение)

Бензол в химии: получение и свойства (формула, подробное описание и применение)

Учебные материалы

Парацельс (1493—1541)

Плиний Старший (23 или 24—79 г.)

Электролиз

Гидролиз солей
Оставить комментарий Отменить ответ
Популярное

Лантаноиды
- 07 Май 2018, 23:55
Медь в химии: подготовка к ЕГЭ (формула, химические свойства, подробное описание и происхождение)
- 13 Апр 2022, 10:37
Сера в химии: подготовка к ЕГЭ (формула, химические свойства, подробное описание и происхождение)
- 13 Апр 2022, 10:39
Кислоты
- 27 Фев 2018, 00:18
Метан: формула и способы получения (основные свойства, характеристики, строение и химические реакции)
- 13 Апр 2022, 10:37
Оксиды
- 27 Фев 2018, 00:17
Реклама
- ремонт сколов на лобовом
- garage-service.ru
- Купить виллы на Бали здесь
- domnabali.com
- Искрозащитный Барьер риф-а1
- Срочная доставка. Гарантия. Полевые барьеры. Датчики
- техключи.рф
Использование любых материалов, размещённых на сайте, разрешается при условии активной ссылки на наш сайт.
При копировании материалов для интернет-изданий – обязательна прямая открытая для поисковых систем гиперссылка. Ссылка должна быть размещена в независимости от полного либо частичного использования материалов. Гиперссылка (для интернет- изданий) – должна быть размещена в подзаголовке или в первом абзаце материала.
Все материалы, содержащиеся на веб-сайте al-himik.ru, защищены законом об авторском праве. Фотографии и прочие материалы являются собственностью их авторов и представлены исключительно для некоммерческого использования и ознакомления , если не указано иное. Несанкционированное использование таких материалов может нарушать закон об авторском праве, торговой марке и другие законы.
Учредитель: ООО «Издательская группа «Объединенная Европа».
Источник: al-himik.ru
Химические свойства алкинов. Строение, получение, применение

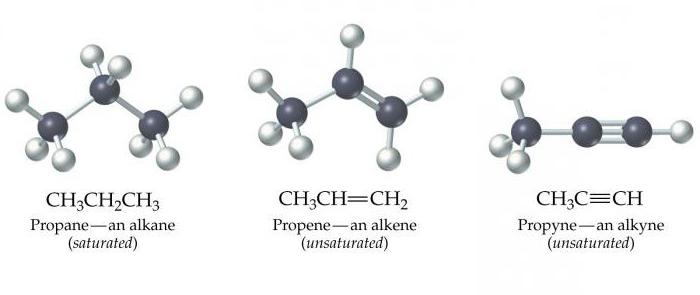
Алканы, алкены, алкины — это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины — это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин — этин (ацетилен). Он обладает вот такой химической формулой — С2Н2.
Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.
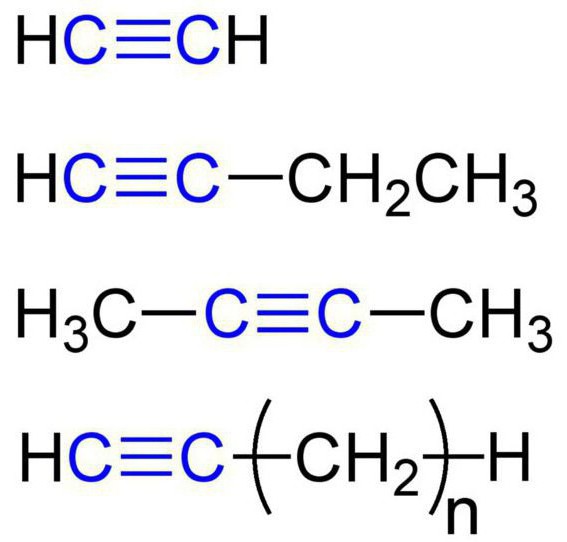
Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, — твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Наиболее широко используемый алкин — ацетилен — обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения — минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй — столько же.
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
Еще один интересный процесс с участием алкинов — реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
Также возможна полимеризация алкинов — процесс объединения нескольких молекул вещества в одну полимерную.
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый — это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
Следующий метод получения алкинов — дегидрирование. Вот пример такой реакции:
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин — этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
Источник: fb.ru