Из двухатомных молекул состоят водород H 2 , кислород O 2 , азот N 2 , галогены F 2 , Cl 2 , Br 2 , I 2 .
Три атома — в молекулах озона O 3 , четыре — в молекулах белого фосфора P 4 , восемь — в молекулах серы S 8 .

Рис. (1). Модели молекул водорода и азота

Рис. (2). Модель молекулы озона
Другая группа простых веществ имеет немолекулярное строение. К таким веществам относятся все металлы, а также фосфор красный, алмаз, графит, кремний и другие.
Их химические формулы записывают химическим символом элемента без индекса: Fe , P , C , Si и т. д.
Аллотропия
Химических элементов известно (118), а простых веществ — более (400). Один химический элемент может образовать несколько простых веществ.
9.1 Аллотропия веществ
Явление существования нескольких простых веществ, образованных атомами одного химического элемента, называется аллотропией.
Простые вещества, состоящие из атомов одного химического элемента — аллотропные модификации (аллотропные видоизменения).
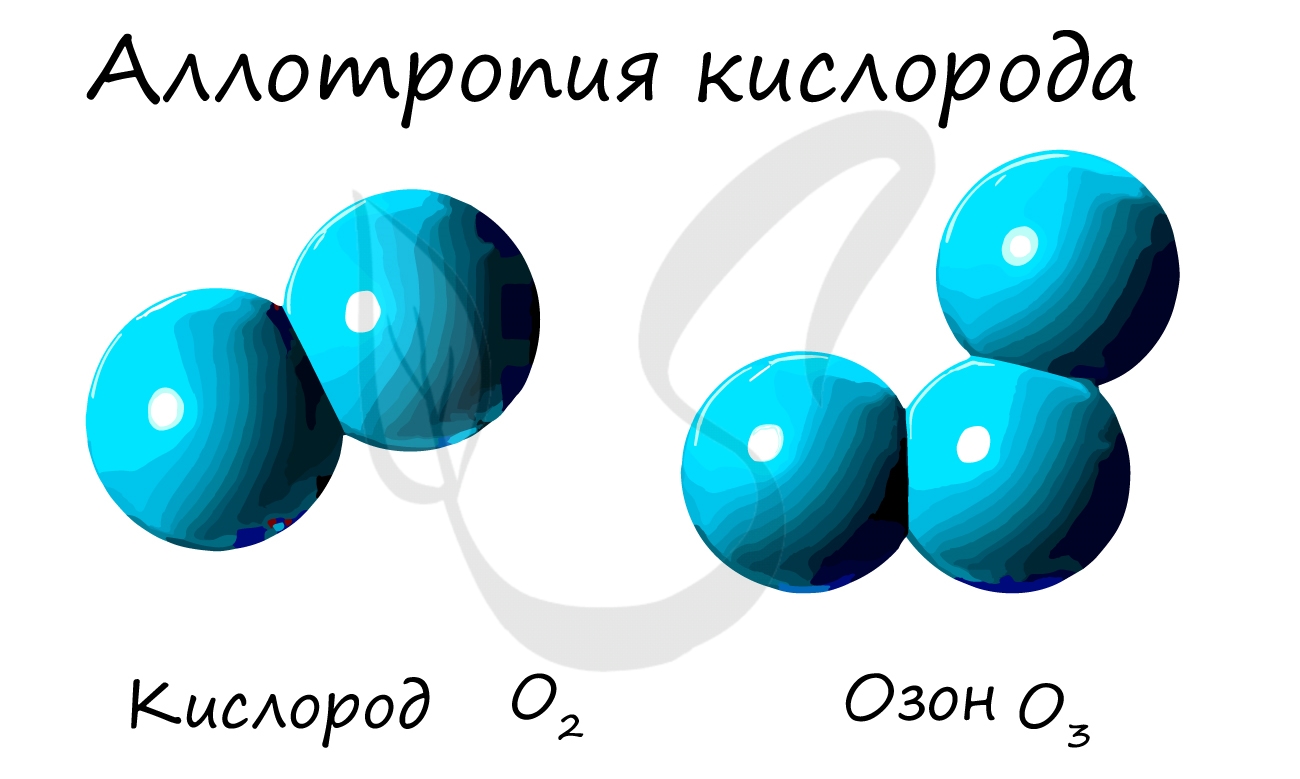
химический элемент кислород образует простые вещества, отличающиеся составом молекул: кислород O 2 и озон O 3 . Кислород — газ без запаха, необходим живым организмам для дыхания. Озон имеет запах, ядовит.
Химический элемент фосфор образует молекулярное вещество фосфор белый P 4 и немолекулярное — фосфор красный P . Эти вещества отличаются не только строением, но и свойствами. Белый фосфор имеет запах, самовоспламеняется на воздухе. Красный фосфор без запаха, горит только при нагревании.
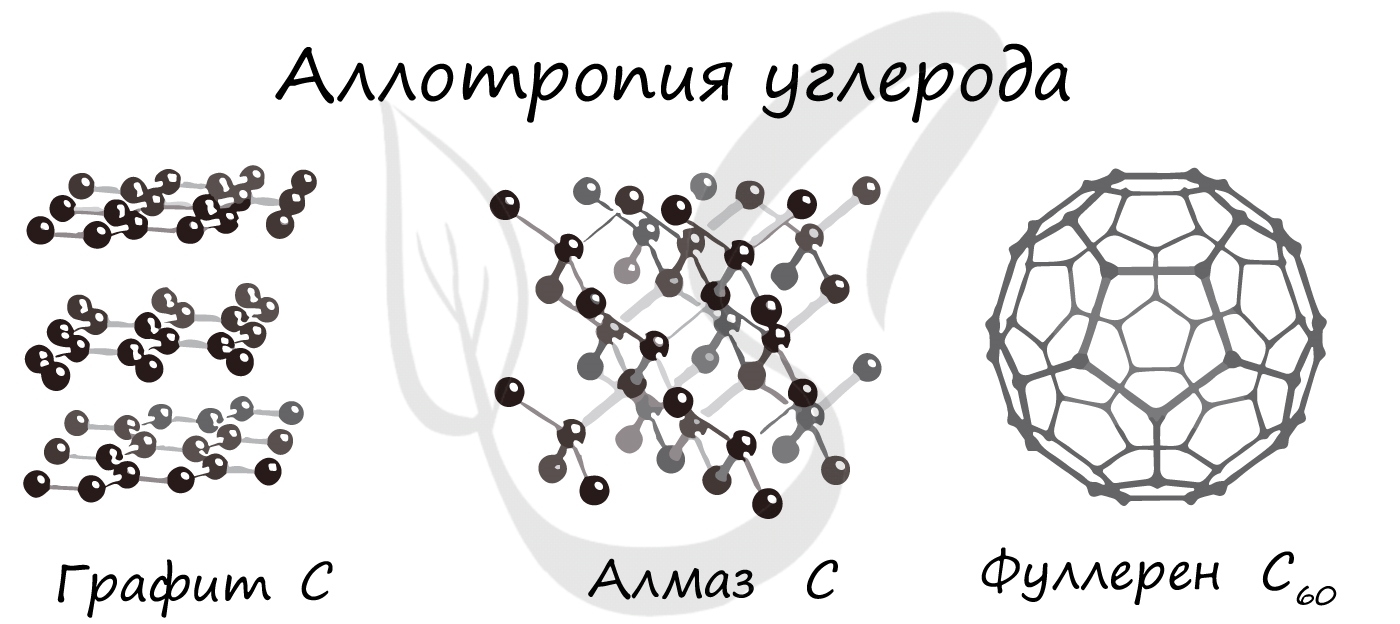
Химический элемент углерод образует немолекулярные вещества алмаз и графит. Они обозначаются одинаковой формулой — C , но имеют разное строение и отличаются свойствами. Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.

Рис. (3). Алмаз и графит
Химический элемент и простое вещество
Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия.
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение).
Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Простые и сложные вещества
Источник: www.yaklass.ru
Классификация веществ
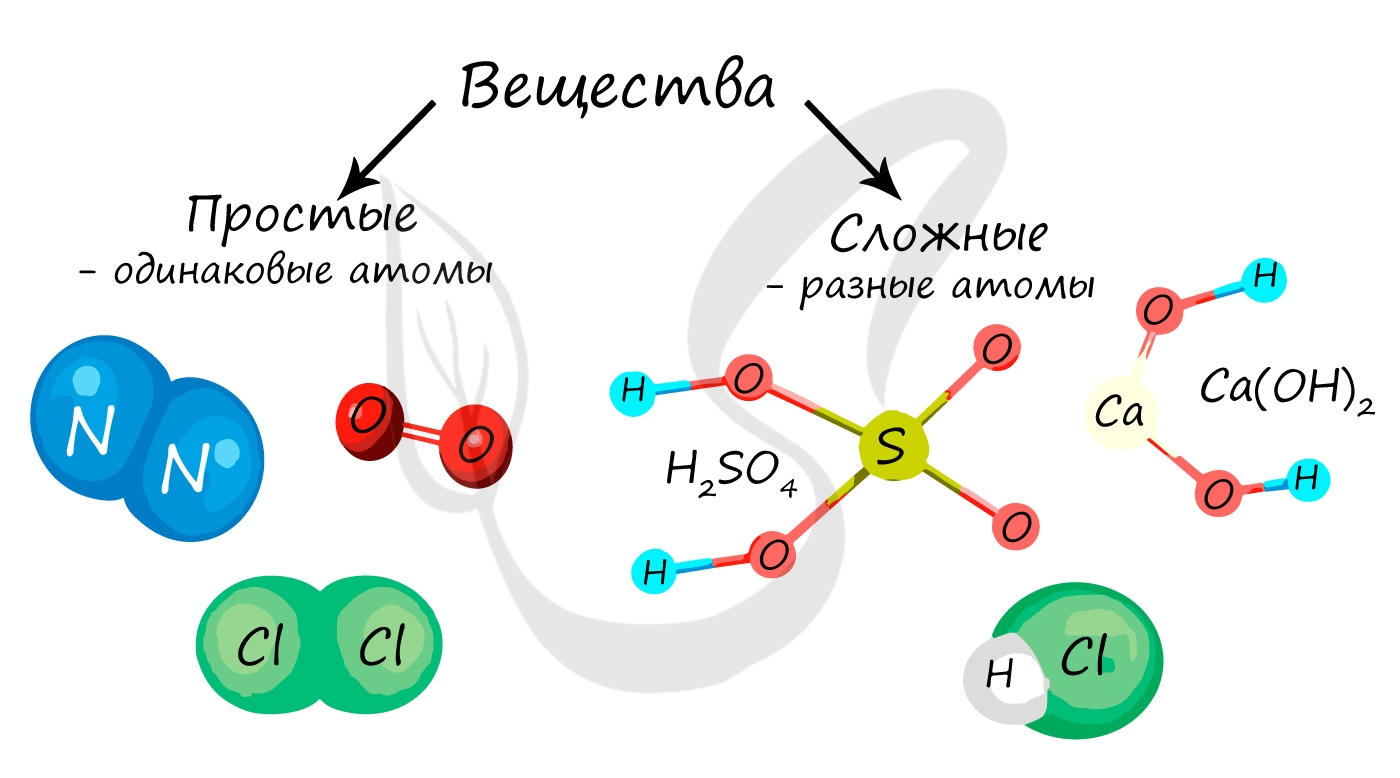
Вещество в химии — любая совокупность атомов и молекул. Вещества в химии подразделяются на простые и сложные.
Простые и сложные вещества
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома: H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Предмет химии (греч. chymos — сок)
У любой науки есть предмет изучения и методами, с помощью которых изучается предмет. Химия — наука о веществах, их превращениях и явлениях, которые сопровождают эти превращения.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.

- Выделение газа
- Появление запаха
- Изменение окраски раствора или реагирующих веществ
- Выпадение осадка
- Образование воды
- Выделение тепла
- Поглощение тепла

Аллотропия
Аллотропия (греч. allos — иной + tropos образ) — свойство некоторых химических элементов принимать различные физические формы, существовать в виде двух и более простых веществ.
Такие уникальные способности имеются у углерода. Его известнейшие аллотропные модификации: алмаз, графит и фуллерен. В разделе химических связей мы вернемся к ним, однако будет хорошо, если вы уже сейчас запомните: алмаз и графит имеют атомное строение, фуллерен — молекулярное.
Обратите внимание: вы можете догадаться о строении веществ по их формуле. У фуллерена молекулу составляют 60 атомов углерода. Мы изучали, что молекула — это как минимум два атома, соединенных вместе. Таким образом, уже по формуле, очевидно, что строение фуллерена молекулярное.
Среди аллотропных модификаций фосфора выделяют: белый, красный и черный фосфор. Белый (P4) фосфор имеет молекулярное строение, а красный и черный (P∞) — атомное.

Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов, тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.

Из аллотропных модификаций кислорода наиболее известен озон (греч. ozo — иметь сильный запах). Озон — неустойчивая модификация кислорода, образуется в озоновом слое под действием ультрафиолетового излучения. Имеет молекулярное строение и формулу — O3.
Озон — ядовитый газ. Применяется как окислитель при отбеливании, при очистке воды и кондиционировании воздуха. В медицине существует целое направление, посвященное лечению с применение озона — озонотерапия.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Классификация веществ
Источник: studarium.ru
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
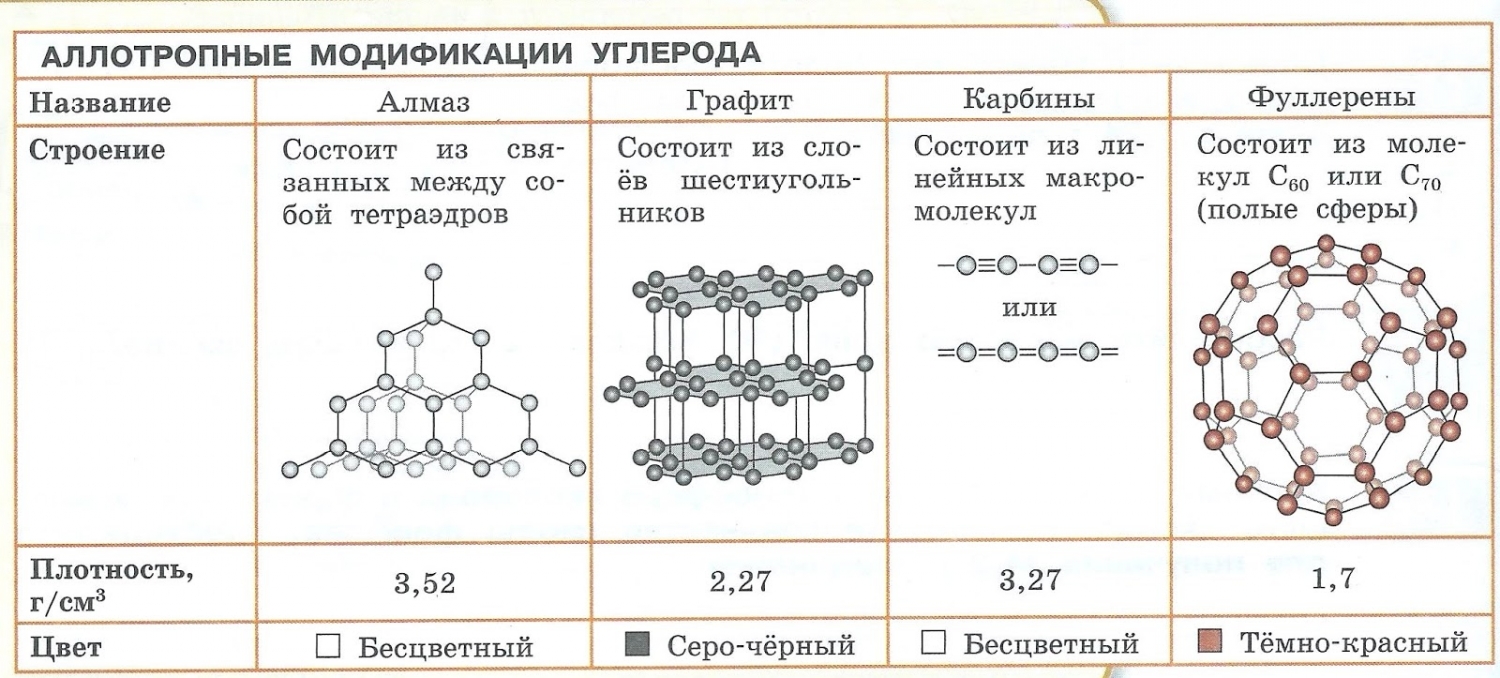
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
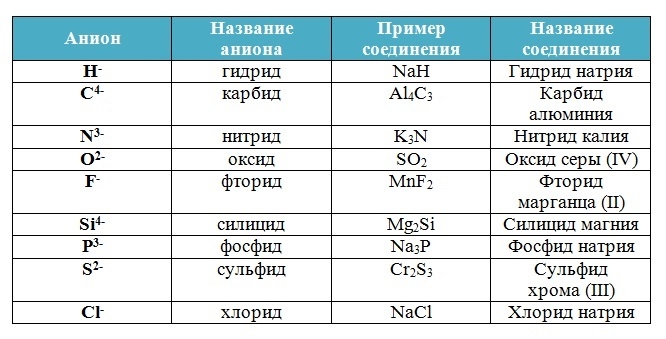
Запомни!
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
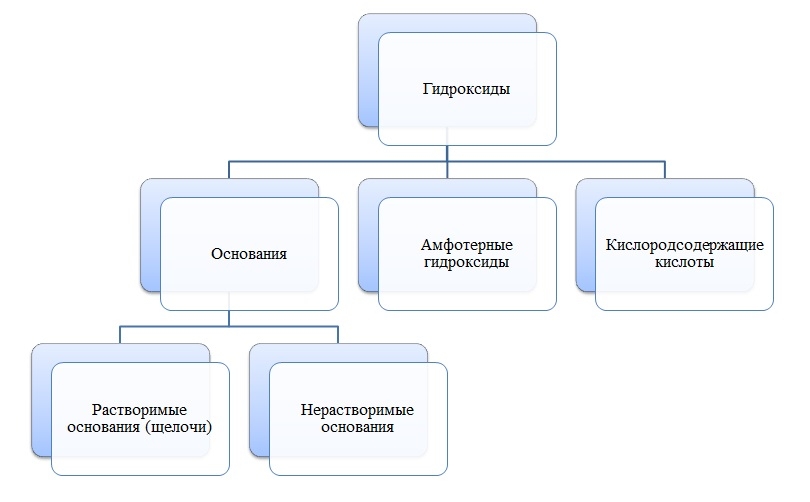
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) |
HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) |
HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид |
S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит |
SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат |
SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат |
СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Источник: school332.ru