Mr (FeCl3) = Ar (Fe) + 3*Ar (Cl) = 56 + 3*35,5 = 162,5 а. е. м.
Mr (Al2O3) = 2*Ar (Al) + 3*Ar (O) = 2*27 + 3*16 = 102 а. е. м.
Mr (CaCO3) = Ar (Ca) + Ar (C) + 3*Ar (O) = 40 + 12 + 3*16 = 100 а. е. м.
Рейтинг статьи
Подписаться
Войти через
Я разрешаю создать мне учетную запись
Когда вы первый раз заходите с помощью соцсетей, мы получаем публичную информацию из вашей учетной записи, предоставляемой провайдером услуги соцсети в рамках ваших настроек конфиденциальности. Мы также автоматически получаем ваш e-mail адрес для создания вашей учетной записи на нашем веб сайте. Когда она будет создана, вы будете авторизованы под этой учетной записью.
Не согласен Согласен
Войти через
Я разрешаю создать мне учетную запись
Когда вы первый раз заходите с помощью соцсетей, мы получаем публичную информацию из вашей учетной записи, предоставляемой провайдером услуги соцсети в рамках ваших настроек конфиденциальности. Мы также автоматически получаем ваш e-mail адрес для создания вашей учетной записи на нашем веб сайте. Когда она будет создана, вы будете авторизованы под этой учетной записью.
Элементы 13 (IIIA) группы и их соединения. Алюминий. 1 часть. 9 класс.
Не согласен Согласен
0 комментариев
Межтекстовые Отзывы
Посмотреть все комментарии
На развитие сайта
Цитата:
Каждый день, в который вы не пополнили своего образования хотя бы маленьким, но новым для вас куском знания считайте бесплодно и невозвратно для себя погибшим. Константин Сергеевич Станиславский
русский театральный режиссёр, актёр и педагог.
Источник: himgdz.ru
Урок 10. Алюминий
Алюминий — химический элемент третьей группы, третьего периода, следовательно, строение его атома можно изобразить схемой:

Имея на внешнем уровне атома три валентных электрона, алюминий проявляет постоянную валентность III.
Алюминий — мягкий, лёгкий металл. Очень пластичный: вытягивается в тончайшую проволоку, прокатывается в фольгу толщиной всего 0,005 мм. В такую фольгу упаковывают шоколад. Сплавы алюминия с другими металлами имеют высокую прочность, сравнимую со сталью (например, дуралюмин), в то же время они существенно легче. Из таких сплавов делают самолёты, поэтому алюминий называют «крылатым металлом».
Алюминий — очень активный металл, он мгновенно окисляется на воздухе:
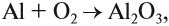
причем оксидная плёнка покрывает его поверхность тончайшим слоем. Прочная оксидная плёнка предохраняет алюминий от коррозии, например, алюминиевые предметы не взаимодействуют с водой. Но, если разрушить оксидную плёнку, алюминий активно реагирует с водой, даже при нормальных условиях:
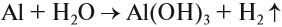
Алюминий активно реагирует с неметаллами:
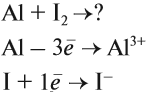
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 класс
Вопрос. Почему атом йода принял только один электрон?
Задание 10.1. Составьте уравнения реакций алюминия с серой, азотом (N2).
Алюминий может вытеснять некоторые металлы из их оксидов:

Этот процесс называется «алюминотермия» и применяется для получения некоторых металлов из их оксидов. В результате этого процесса выделяется значительное количество теплоты, так что металл получается в расплавленном состоянии. Поэтому алюминотермия используется для сварки некоторых металлов.
Особенность алюминия заключается в том, что он может реагировать и с кислотами, и со щелочами, т. е. проявляет амфотерные свойства:
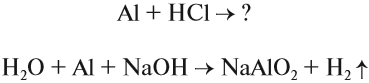
В последней реакции получилась соль метаалюминиевой кислоты, которая в свободном состоянии не выделена.
Задание 10.2. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Такие же амфотерные свойства проявляют и оксид алюминия, и гидроксид алюминия. Другими словами, оксид алюминия реагирует и с кислотами, и со щелочами. Поскольку в химических реакциях особенно легко реагируют вещества с противоположными свойствами, при взаимодействии с кислотами оксид алюминия ведет себя как обычный основный оксид.
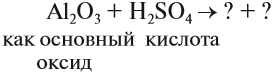
Задание 10.3. Составьте уравнение реакции оксида алюминия с серной кислотой.
При взаимодействии со щелочами оксид алюминия ведет себя как кислотный оксид. А в этом случае, необходимо выяснить, какая кислота соответствует данному оксиду.
Вспомните или см. урок 2.1:
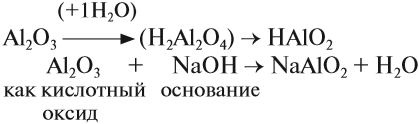
Вопрос. Можно ли в алюминиевой посуде длительное время хранить кислые щи? Щелочные растворы?
Такие же амфотерные свойства проявляет и гидроксид алюминия, т. е. он растворяется и в кислотах, и в щелочах:

Обратите внимание: поскольку здесь гидроксид алюминия реагирует со щёлочью (основанием), он проявляет свойства кислоты и мы формально записываем его состав в «кислотном» виде, т. е. атомы водорода записываются впереди.
Задание 10.4. Составьте уравнения реакций гидроксида алюминия с серной кислотой и гидроксидом кальция. Запишите оба уравнения в ионном виде.
Очень важно понимать, что осадок гидроксида алюминия растворяется в избытке щелочи. Поэтому при получении осадка гидроксида алюминия нужно к щёлочи прибавлять избыток растворимой соли алюминия. Если действовать наоборот, то лишняя щёлочь тут же растворит гидроксид алюминия и осадок не получится. Растворение осадка гидроксида алюминия в избытке щёлочи является качественным признаком присутствия солей алюминия в данном растворе.
Необходимо отметить, что все вышеприведенные реакции взаимодействия алюминия и его соединений со щелочами происходят при сплавлении (без воды). В растворах щелочей происходит растворение этих веществ, что приводит к образованию комплексных соединений:
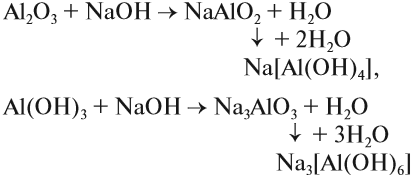
При этом атом алюминия входит в состав прочного комплексного иона, который практически не диссоциирует.
Поэтому растворение алюминия* в растворе щёлочи можно выразить уравнением:
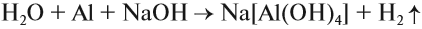
* Аналогичными амфотерными свойствами обладают цинк и его соединения.
Задание 10.5. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Аналогичными свойствами обладает цинк, его оксид и гидроксид.
Алюминий занимает третье место (после кислорода и кремния) по распространённости на нашей планете и первое место среди металлов. Он входит в состав гранита, глины, драгоценных камней (основу сапфира, аметиста, рубина составляет оксид алюминия). Практическое применение находит как сам алюминий, так и его сплавы, а также некоторые его соли. Так, сульфат алюминия применяется для очистки питьевой воды.
Вопрос. Какие сплавы алюминия вам известны? Где они применяются? (См. урок 8.2.)

Выводы
Алюминий — амфотерный металл, причем некоторые его соединения (оксид, гидроксид) также амфотерны. Поскольку посуда из алюминия встречается на каждой кухне, эти свойства алюминия должен знать каждый и помнить: в алюминиевой посуде кислые и солёные продукты, щелочные растворы хранить нельзя!
Источник: himi4ka.ru
Сульфат алюминия как пишется в химии формула
Найдите правильный ответ на вопрос ✅ «Как пишется сульфат алюминия …» по предмету Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Правильный ответ на вопрос «Как пишется сульфат алюминия …» по предмету Химия. Развернутая система поиска нашего сайта обязательно приведёт вас к нужной информации. Как вариант — оцените ответы на похожие вопросы. Но если вдруг и это не помогло — задавайте свой вопрос знающим оппонентам, которые быстро дадут на него ответ!
Искать готовые ответы
При сжигании этана образовался углекислый газ объемом 32 л. Какие объемы исходных газов было использовано? (н. у.)
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg (OH) 2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
Осуществите превращения Cu—CuO—CuSo4—Cu (OH) 2—CuCl2
Ксилол 100% консентрация, чем разбавить чтоб получить 40%
Запишите схемы образования химических связей для веществ состав которых отображают формулами kcl и cl2
Определите степень полимеризации полибутадиена, молекулярная масса которого 13500 г/моль.
Дано: BaCl2, NaOH, Na2SO4, AlCl3, HCl, K2CO3, CuSO3, Ba (NO3) 2 Нужно составить возможные реакции ионного обмена.
Опишите физические свойства присущие для веществ с молекулярными кристаллическими решетками Приведите примеры
Степень окисления J2
Определите массовую 10% раствора H2SO4 (плотность раствора H2SO4=1,069 г/мл)
Определение и формула сульфата алюминия

Формула –
Молярная масса равна г/моль.
Физические свойства – белое вещество (может иметь разные оттенки), плавящееся с разложением.
![]()
В обычных условиях образует кристаллогидрат с формулой .
Химические свойства сульфата алюминия
- Сульфат алюминия хорошо растворяется в воде (происходит гидролиз по катиону):
![[ Al_2left ( SO_4 right )_3 + 12H_2O=2left [ Alleft ( H_2O right )_6right ]^<3+>+3SO_4^ ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-19dd3209dcc0975de2077f6e31a247ca_l3.png)
![[ left [ Alleft ( H_2O right )_6right ]^<3+>+H_2O=left [ Alleft ( H_2O right )_5left ( OH right ) right ]^<>+H_3O^ ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-da4fba9dd8549d6f9aa7f6272694f3da_l3.png)
- При нагревании до температуры
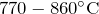 протекает окислительно-восстановительная реакция диспропорционирования (сульфат алюминия разлагается на оксид алюминия, оксид серы и кислород):
протекает окислительно-восстановительная реакция диспропорционирования (сульфат алюминия разлагается на оксид алюминия, оксид серы и кислород): ![[ 2Al_2left ( SO_4 right )_3=2Al_2O_3+6SO_2+3O_2 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4daca76e7b4460008ff43f32a3fca1ee_l3.png)
- Реагирует с кипящей водой:
![[ Al_2left ( SO_4 right )_3+6H_2O=2Alleft ( OH right )_3 downarrow 3H_2SO_4 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5119487d7851df510ef83c66a9ba8299_l3.png)
- Взаимодействует с растворами разбавленных щелочей:
![[ Al_2left ( SO_4 right )_3+6NaOH=2Alleft ( OH right )_3 downarrow +3Na_2SO_4 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-aa772d2d84de5bcf903bc12730da7928_l3.png)
- Вступает в реакцию с растворами концентрированных щелочей:
![[ Al_2left ( SO_4 right )_3+8NaOH=2Naleft [ Alleft ( OH right )_4 right ]+3Na_2SO_4 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-eb8199b71e15bcbeba8440720746b48e_l3.png)
Получение
![]() ):
):
![]()
Применение
Сульфат алюминия находит применение в качестве коагулянта для очистки воды хозяйственно-питьевого и промышленного назначения. Он также применяется во многих отраслях промышленности, например, в бумажной. Кроме того, используется как пищевая добавка .
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июня 2020 года; проверки требуют 6 правок.
2,710 г/см 3 (безв.)
1,690 г/см 3 ( 18-водн. )
Источник: kak-pishetsya24.ru