Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили. Фильтрат упарили, полученный твёрдый остаток прокалили с хлоридом аммония. Образующийся газ окислил литий.
Решение:
Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:
2N +5 + 10e = N2 0
Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой). Образуется осадок гидроксида алюминия и выделяется углекислый газ:
Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
Химическая реакция между нитратом серебра и сплава алюминия с магнием.
t°
В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония): NaNO3 + NH4Cl = N2O + 2H2O + NaCl.
Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот: 3N2O + 2NH3 = 4N2 + 3H2O.
2) Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
1. Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития: 6Li + N2 = 2Li3N
2. При взаимодействии нитридов с водой образуется аммиак:
Li3N + 3H2O = 3LiOH + NH3
3. Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония: 2NH3 + H2SO4 = (NH4)2SO4
4. Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария: (NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
5. После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах: NH4Cl + NaNO2 →t° N2 + 2H2O + NaCl
3) Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Медная проволока реагирует с раствором нитрата серебра #Shorts
1. Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:
Al 0 − 3e = Al 3+ │10
2N +5 + 10e = N2 0 │ 3
2. Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой). Образуется осадок гидроксида алюминия и выделяется углекислый газ:
3. Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
4. В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония): NaNO3 + NH4Cl = N2O + 2H2O + NaCl. Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот: 3N2O + 2NH3 = 4N2 + 3H2O
4) Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
Алюминат натрия при растворении в воде образует гидроксокомплекс:
Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
4.Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата: NaHSO3 + Br2 + H2 O = NaHSO4 + 2HBr
5.Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
HBr + NaOH = NaBr + H2O
5) Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
1.Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород: ZnS +2HCl = ZnCl2 + H2S
2.Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия: H2S + 2NaOH = Na2S + H2O
3.Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II): Na2S + FeCl2 = FeS + 2NaCl
4.Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
5.Сернистый газ реагирует с кислородом в присутствии катализатора: 2 SO2 + O2 = 2 SO3
6) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
1. При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния: SiO2 + Mg = MgO + Si
Можно записать при большом избытке магния суммарное уравнение реакции:
2. При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (оксид магния реагирует с водой только при кипячении):
3. Силан при сгорании образует оксид кремния: SiH4 + 2 O2 = SiO2 + 2H2O
4. Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
5. При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка: Cs2SiO3 + 2 HCl = 2 CsCl + H2SiO3
7) Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
8) Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
9) Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
10) На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
NaCl → HCl →BaCl2 → BaSO4 → BaS → H2S
2NaCl + H2SO4 = 2HCl + Na2SO4
BaSO4 + 4C = BaS + 4CO
11) Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
12) Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
KAlO2 + 4HCl = KCl + AlCl3 + 2 H2O
Дата добавления: 2015-08-28 ; просмотров: 1110 | Нарушение авторских прав
| | | следующая лекция ==> | |
| Ниже приведены типовые задачи (общее количество – 8) и примеры решения некоторых из них. Курсивом выделено правильное оформление решения. | | | Типология и планировочное решение гостиницы |
mybiblioteka.su — 2015-2023 год. (0.03 сек.)
Источник: mybiblioteka.su
Раствор хлорида алюминия не реагирует с раствором 1) гидроксида натрия 2) нитрата серебра 3) сульфата железа(III)
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Алюминий не реагирует с раствором нитрата серебра
Ответы: 1-4, 2-2, 3-4, 4-1, 5-1, 6-2, 7-3, 8-2, 9-1, 10-4, 11-4, 12-3, 13-2, 14-1, 15-3, 16-4, 17-1, 18-3, 19-2, 20-3, 21-4, 22-3, 23-1, 24-3, 25-4, 26-1, 27-2, 28-4, 29-2. 30-2.
Алюминий не реагирует с раствором нитрата серебра
Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере
соединений алюминия и цинка).
1. Нитрат алюминия в растворе взаимодействует с
2. С водными растворами хлороводорода, гидроксида бария и хлорида меди (II) реагирует
3. И с железом, и с гидроксидом калия и с нитратом серебра реагирует в растворе
4. И с гидроксидом натрия, и с соляной кислотой, и с хлоридом бария реагирует в растворе
5. Раствор йодида калия реагирует с каждым из веществ
1) Br2 и AgNO3 2) AgNO3 и HCl 3) Cl2 и NaOH 4) HCl и Cl2
6. Гидрокарбонат натрия реагирует с каждым из веществ
1) CaCl2 и NaOH 2) NaOH и HCl 3) HCl и О2 4) О2 и СО2
7. И с хлором, и с гидроксидом калия, и с нитратом серебра реагирует
8. Карбонат кальция при обычных условиях реагирует с
2) углекислым газом в водном растворе
4) раствором хлорида бария
9. Очистить воду от ионов кальция, содержащихся в растворенном в ней гидрокарбонате кальция можно при
2) добавлении хлорида бария
3) добавлении соляной кислоты
4) добавлении хлорида натрия
10. Сульфид натрия в растворе не реагирует с
11. И с медью, и с раствором сульфида натрия реагирует
2) раствор нитрата серебра
4) раствор хлорида железа (III)
12. Реагируют друг с другом
1) ртуть и раствор нитрата свинца (II)
2) бром и раствор хлорида натрия
3) серная кислота и сульфит натрия
4) раствор гидроксида натрия и сульфид железа (II)
13. Карбонат калия в растворе реагирует с
14. Возможна реакция между
1) хлоридом аммония и гидроксидом кальция
2) сульфатом натрия и соляной кислотой
3) хлоридом меди (II) и ртутью
4) нитратом натрия и водой
15. И с гидроксидом натрия и с разбавленной серной кислотой реагирует соль
16. Азот выделяется при разложении
17. Возможна реакция в растворе между
1) нитратом ртути (II) и медью
2) хлоридом натрия и нитратом калия
3) сульфатом бария и соляной кислотой
4) сульфидом железа (II) и гидроксидом калия
18. И с гидроксидом натрия, и нитратом серебра, и с хлором реагирует в водном растворе
19. При действии раствора серной кислоты на раствор карбоната аммония выделяется газ
20. Гидроксид натрия образуется при взаимодействии в растворе
21. Раствор хлорида железа (II) реагирует с каждым из двух веществ
1) NaOH и Сu 2) HNO3 и Ag 3) Cu и HNO3 4) AgNO3 и Ba(OH)2
1) термическом разложении исходного вещества
2) действии на исходное вещество раствора щелочи
3) пропускании углекислого газа через раствор исходного вещества
4) действии на исходное вещество избытком раствора сильной кислоты
23. Хлорид аммония в растворе реагирует с
24. Продуктами разложения нитрата натрия являются
25. Раствор карбоната натрия не реагирует с
26. Оцените правильность суждений о карбонатах
А. С соляной кислотой реагируют как растворимые, так и нерастворимые карбонаты
27. Оцените верность суждений о нитратах
А. Соляная кислота вытесняет из любого нитрата азотную кислоту
28. Нитрат серебра не способен
1) образовывать осадок при взаимодействии с раствором хлоридом натрия
2) разлагаться при нагревании
3) реагировать в растворе с медью
4) реагировать с уксусной кислотой
29. Осадок сначала выпадает, а затем исчезает при
1) добавлении раствора хлорида цинка к раствору гидроксида натрия
2) пропускании углекислого газа через известковую воду
3) сливании растворов сульфата натрия и хлорида бария
4) сливании растворов карбоната натрия и азотной кислоты
30. Карбонат натрия в растворе не реагирует с
Ответы: 1-4, 2-2, 3-4, 4-1, 5-1, 6-2, 7-3, 8-2, 9-1, 10-4, 11-4, 12-3, 13-2, 14-1, 15-3, 16-4, 17-1, 18-3, 19-2, 20-3, 21-4, 22-3, 23-1, 24-3, 25-4, 26-1, 27-2, 28-4, 29-2. 30-2.
AlCl3 + AgNO3 = ? уравнение реакции
Составьте химическое уравнение по схеме AlCl3 + AgNO3 = ? Расставьте стехиометрические коэффициенты. Запишите, если это возможно, молекулярное уравнение реакции. Охарактеризуйте полученное нерастворимое в воде и кислотах соединение: укажите физические и химические свойства, а также основные способы его получения.
В результате взаимодействия растворов нитрата серебра и хлорида алюминия (AlCl3 + AgNO3 = ?) происходит образование средних солей – нерастворимого в воде хлорида серебра (I) и нитрата алюминия (обмен). Молекулярное уравнение реакции имеет вид:
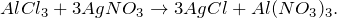
Запишем ионные уравнения, учитывая, что хлорид серебра (I) на ионы не распадается, т.е. не диссоциирует.
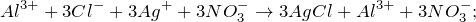
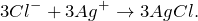
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Хлорид серебра (I) представляет собой пластичные кристаллы белого цвета, которые плавятся (расплав — желто-коричневый) и кипят без разложения. Не растворяется в воде. Кристаллогидратов не образует. Не разлагается сильными кислотами. Реагирует с концентрированными щелочами, гидратом аммиака.
Переводится в раствор за счет комплексообразования.
Алюминий не реагирует с раствором нитрата серебра
Виртуальная химическая школа
Тестовый практикум по ЕГЭ
Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере
соединений алюминия и цинка).
1 . Нитрат алюминия в растворе взаимодействует с
2 . С водными растворами хлороводорода, гидроксида бария и хлорида меди ( II ) реагирует
3. И с железом, и с гидроксидом калия и с нитратом серебра реагирует в растворе
4. И с гидроксидом натрия, и с соляной кислотой, и с хлоридом бария реагирует в растворе
5. Раствор йодида калия реагирует с каждым из веществ
1) Br 2 и AgNO 3 2) AgNO 3 и HCl 3) Cl 2 и NaOH 4) HCl и Cl 2
6. Гидрокарбонат натрия реагирует с каждым из веществ
1) CaCl 2 и NaOH 2) NaOH и HCl 3) HCl и О 2 4) О 2 и СО 2
7. И с хлором, и с гидроксидом калия, и с нитратом серебра реагирует
8. Карбонат кальция при обычных условиях реагирует с
2) углекислым газом в водном растворе
4) раствором хлорида бария
9. Очистить воду от ионов кальция, содержащихся в растворенном в ней гидрокарбонате кальция можно при
2) добавлении хлорида бария
3) добавлении соляной кислоты
4) добавлении хлорида натрия
10. Сульфид натрия в растворе не реагирует с
11. И с медью, и с раствором сульфида натрия реагирует
2) раствор нитрата серебра
4) раствор хлорида железа (III)
12. Реагируют друг с другом
1) ртуть и раствор нитрата свинца ( II)
2) бром и раствор хлорида натрия
3) серная кислота и сульфит натрия
4) раствор гидроксида натрия и сульфид железа (II)
13. Карбонат калия в растворе реагирует с
14. Возможна реакция между
1) хлоридом аммония и гидроксидом кальция
2) сульфатом натрия и соляной кислотой
3) хлоридом меди (II) и ртутью
4) нитратом натрия и водой
15. И с гидроксидом натрия и с разбавленной серной кислотой реагирует соль
16. Азот выделяется при разложении
17. Возможна реакция в растворе между
1) нитратом ртути ( II) и медью
2) хлоридом натрия и нитратом калия
3) сульфатом бария и соляной кислотой
4) сульфидом железа ( II) и гидроксидом калия
18. И с гидроксидом натрия, и нитратом серебра, и с хлором реагирует в водном растворе
19. При действии раствора серной кислоты на раствор карбоната аммония выделяется газ
20. Гидроксид натрия образуется при взаимодействии в растворе
21. Раствор хлорида железа ( II) реагирует с каждым из двух веществ
1) NaOH и С u 2) HNO 3 и Ag 3) Cu и HNO 3 4) AgNO 3 и Ba(OH) 2
22. Превращение Na[Al(OH) 4 ] —> Al(OH) 3
1) термическом разложении исходного вещества
2) действии на исходное вещество раствора щелочи
3) пропускании углекислого газа через раствор исходного вещества
4) действии на исходное вещество избытком раствора сильной кислоты
23. Хлорид аммония в растворе реагирует с
24. Продуктами разложения нитрата натрия являются
25. Раствор карбоната натрия не реагирует с
26. Оцените правильность суждений о карбонатах
А. С соляной кислотой реагируют как растворимые, так и нерастворимые карбонаты
27. Оцените верность суждений о нитратах
А. Соляная кислота вытесняет из любого нитрата азотную кислоту
28. Нитрат серебра не способен
1) образовывать осадок при взаимодействии с раствором хлоридом натрия
2) разлагаться при нагревании
3) реагировать в растворе с медью
4) реагировать с уксусной кислотой
29. Осадок сначала выпадает, а затем исчезает при
1) добавлении раствора хлорида цинка к раствору гидроксида натрия
2) пропускании углекислого газа через известковую воду
3) сливании растворов сульфата натрия и хлорида бария
4) сливании растворов карбоната натрия и азотной кислоты
30. Карбонат натрия в растворе не реагирует с
31. С карбонатом натрия реагирует каждое из двух веществ
Ответы: 1-4, 2-2, 3-4, 4-1, 5-1, 6-2, 7-3, 8-2, 9-1, 10-4, 11-4, 12-3, 13-2, 14-1, 15-3, 16-4, 17-1, 18-3, 19-2, 20-3, 21-4, 22-3, 23-1, 24-3, 25-4, 26-1, 27-2, 28-4, 29-2. 30-2, 31-2.
Источник: ollimpia.ru