Химическое поведение аминокислот определяется двумя функциональными группами -NН2 и –СООН. Аминокислотам характерны реакции по аминогруппе, карбоксильной группе и по радикальной части, при этом в зависимости от реагента взаимодействие веществ может идти по одному или нескольким реакционным центрам.
Амфотерный характер аминокислот. Имея в молекуле одновременно кислотную и основную группу, аминокислоты в водных растворах ведут себя как типичные амфотерные соединения. В кислых растворах они проявляют основные свойства, реагируя как основания, в щелочных – как кислоты, образуя соответственно две группы солей:
Благодаря своей амфотерности в живом организме, аминокислоты играют роль буферных веществ, поддерживающих определенную концентрацию водородных ионов. Буферные растворы, полученные при взаимодействии аминокислот с сильными основаниями, широко применяются в биоорганической и химической практике. Соли аминокислот с минеральными кислотами лучше растворимы в воде, чем свободные аминокислоты. Соли с органическими кислотами труднорастворимые в воде и используются для идентификации и разделения аминокислот.
Всё, что вам необходимо знать про аминокислоты! Аминокислоты в растениеводстве.
Алкилирование проводится при участии R-На1 или Аr-Наl:
В процессе реакции ацилирования используются хлорангидриды или ангидриды кислот (ацетилхлорид, уксусный ангидрид, бензилоксикарбонилхлорид):
Если при a-углеродном атоме в углеводородном радикале имеется электроноакцепторный заместитель (-NO2, -СС13, -СООН, -COR и т.д.), поляризующий связь С®СООН, то у карбоновых кислот легко протекают реакции декарбоксилирования. Декарбоксилирование a-аминокислот, содержащих в качестве заместителя + NH3-группу, приводит к образованию биогенных аминов. В живом организме данный процесс протекает под действием фермента декарбоксилазы и витамина пиридоксальфосфата.
В лабораторных условиях реакцию осуществляется при нагревании a-аминокислоты в присутствии поглотителей СО2, например, Ва(ОН)2.
При декарбоксилировании b-фенил-a-аланина, лизина, серина и гистидина образуются, соответственно, фенамин, 1,5-диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и триптамин.
Окислительно-восстановительные переходы имеют место в системе цистеин – цистин:
В некоторых реакциях аминокислоты реагируют по обеим функциональным группам одновременно.
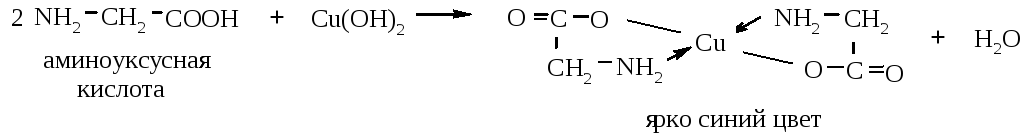
Образование комплексов с металлами. Почти все a-аминокислоты образуют комплексы с ионами двухвалентных металлов. Наиболее устойчивыми являются комплексные внутренние соли меди (хелатные соединения), образующиеся в результате взаимодействия с гидроксидом меди (II) и окрашенные в синий цвет:
Действие азотистой кислоты на алифатические аминокислоты приводит к образованию гидроксикислот, на ароматические — диазосоединений.
Образование гидроксикислот:
Реакция диазотирования:
Диазосоединение далее может реагировать по двум направлениям:
1. с выделением молекулярного азота N2:
2. без выделения молекулярного азота N2:
Хромофорная группа азобензола -N=N в азосоединениях обуславливает желтую, желтую, оранжевую или другого цвета окраску веществ при поглощении в видимой области света (400-800 нм). Ауксохромная группа
Протеин или аминокислоты?! Что выбрать новичку? Какие плюсы и минусы
-СООН изменяет и усиливает окраску за счет π, π — сопряжения с π — электронной системой основной группы хромофора.
Отношение аминокислот к нагреванию. При нагревании аминокислоты разлагаются с образованием различных продуктов в зависимости от их типа. При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды — дикетопиперазины:
валин (Val) диизопропильное производное
При нагревании b-аминокислот от них отщепляется аммиак с образованием α, β-непредельных кислот с сопряженной системой двойных связей:
β-аминовалериановая кислота пентен-2-овая кислота
Нагревание g- и d-аминокислот сопровождается внутримолекулярной дегидратацией и образованием внутренних циклических амидов – лактамов:
γ-аминоизовалериановая кислота лактам γ-аминоизовалериановой
(4-амино-3-метилбутановая кислота) кислоты
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ .
Аминокислоты — органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)

Все природные аминокислоты можно разделить на следующие основные группы:
| 1) алифатические предельные аминокислоты (глицин, аланин) | NH2-CH(CH3)-COOH аланин |
| 2) серосодержащие аминокислоты (цистеин) | NH2-CH(CH2SH)-COOH цистеин |
| 3) аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2ОH)-COOH серин |
| 4) ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2С6Н5)-COOH фенилаланин |
| 5) аминокислоты с двумя карбоксильными группами (глутаминовая кислота, аспарагиновая кислота) | NH2-CH(CH2СН2COOH)-COOH глутаминовая кислота |
| 6) аминокислоты с двумя аминогруппами (лизин) | NH2(CH2)4-CH(NH2)-COOH лизин |
Некоторые важнейшие α-аминокислоты
| Название | —R |
| Глицин | —Н |
| Аланин | —СН3 |
| Цистеин | —CH2—SH |
| Серин | —CH2—ОН |
| Фенилаланин | —CH2—C6H5 |
| Тирозин | |
| Глутаминовая кислота | —CH2 —CH2 —СООН |
| Лизин | —(CH2)4—NH2 |
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино — и указанием места расположения аминогруппы по отношению к карбоксильной группе:

Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино — с указанием положения аминогруппы буквой греческого алфавита. Пример:

Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино -, три группы NH2 – триамино — и т.д.

Наличие двух или трех карбоксильных групп отражается в названии суффиксом -диовая или -триовая кислота:

ПОЛУЧЕНИЕ АМИНОКИСЛОТ.
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
2. Присоединение аммиака к α,β-непредельным кислотам с образованием β-аминокислот (против правила Марковникова):
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O2N–C6H4–COOH + 3H2 à H2N–C6H4–COOH + 2H2O
СВОЙСТВА АМИНОКИСЛОТ .
Физические свойства
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ .
| 1. Кислотно-основные свойства: Аминокислоты — это амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями: H2N-CH2-COOH + HCl à Cl[H3N-CH2-COOH] H2N-CH2-COOH + NaOH à H2N-CH2-COONa + H2O Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой: Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2). |
| 2. Как кислоты, аминокислоты могут реагировать с металлами, оксидами металлов, солями летучих кислот: 2H2N-CH2-COOH +2 Na à 2H2N-CH2-COONa + H2 2H2N-CH2-COOH + Na2O à 2H2N-CH2-COONa + H2O H2N-CH2-COOH + NaHCO3 à H2N-CH2-COONa + CO2 ↑+ H2O |
| 3. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир: H2N-CH2-COOH + C2H5OH –(HCl)à H2N-CH2-COOC2H5 + H2O |
| 4. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид. Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью. Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид : H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH глицилаланилглицин |
| 6. При нагревании разлагаются ( декарбоксилирование): NH2-CH2-COOH –(t)à NH2-CH3 + CO 2 амин |
| 7. Декарбоксилирование с помощью щелочи: NH2-CH2-COOH +Ва(ОН)2 –(t)à NH2-CH3 + ВаCO3 + Н2О амин |
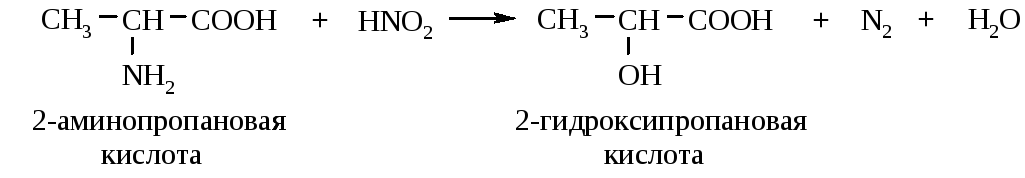
| 8. С азотистой кислотой: NH2-CH2-COOH + HNО2 à HO-CH2-COOH + N2 + Н2О |
Источник: studopedia.net
Химические свойства
1. Образование солей. При взаимодействии с минеральными кислотами и щелочами аминокислоты дают соли:

2. Образование комплексов с металлами. Почти все аминокислоты образуют окрашенные комплексы с ионами двухвалентных металлов:
3.1. Ацилирование. Проводится хлорангидридами или ангидридами карбоновых кислот при комнатной температуре:
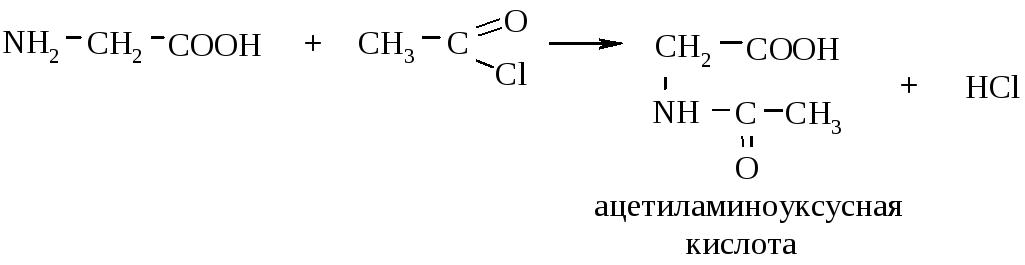
3.2. Алкилирование. Происходит под действием галогенопроизводных с образованием моно-, ди- и триалкилпроизводных (четвертичных аммониевых оснований):

3.3 Действие азотистой кислоты. Аминокислоты реагируют с HNO2 как первичные алифатические амины. Образуются гидроксикислоты, по количеству выделившегося N2 определяют количество аминокислоты (метод определения по Ван-Слайку):
4.1. Этерификация. При действии спиртов в присутствии минеральных кислот образуются сложные эфиры:

4.2. Образование галогенангидридов. При действии PCl5 на аминокислоты в кислой среде образуются соли хлорангидридов аминокислот:

4.3. Декарбоксилирование. При нагревании аминокислот в твердом состоянии с высококипящими растворителями отщепляется карбоксильная группа с образованием аминов:

Аналогичный процесс расщепления белков происходит во время пищеварения под действием ферментов.
5.1. При нагревании α-аминокислот образуются циклические амиды – дикетопиперазины:

5.2. При нагревании β-аминокислот отщепляется NH3 и образуются непредельные кислоты:

5.3. При нагревании γ- и δ- аминокислот образуются внутренние циклические амиды – лактамы:

Значение аминокислот
Исключительная роль аминокислот, прежде всего связана с тем, что они входят в состав белков. При попадании в желудочно-кишечный тракт белки пищи под действием ферментов распадаются на аминокислоты, которые затем используются для построения организмом своих собственных белков – тканей, крови, кожи и т. д.
Практически все аминокислоты используются организмом для построения органических соединений, необходимых для правильного обмена веществ. Часть аминокислот выполняет роль медиаторов – веществ, принимающих участие в передаче нервных импульсов, а также обеспечивает соответствующие физиологические функции: регуляцию сна, бодрствования, сердечно-сосудистой деятельности, терморегуляцию тела.
10 аминокислот организм синтезировать не может (незаменимые аминокислоты), поэтому они должны добавляться в пищу для повышения ее полноценности (в виде отдельных препаратов, либо в комплексе с витаминными препаратами). При нехватке одной из аминокислот белок становится недостаточно полноценным и не полностью усваивается организмом.
Отдельные аминокислоты используются в химической промышленности для проведения разнообразных синтезов, в аналитической химии, в пищевой промышленности как вкусовые добавки (мононатриевая соль глутаминовой кислоты придает вкус и запах куриного бульона).
Источник: studfile.net