4.5. Контрольные вопросы
1. Какие из приведенных формул органических веществ относятся к аминокислотам?
2. Укажите изомеры аминомасляной кислоты.
3. Аминокислоты не могут
Ответ 1 : с основаниями и кислотами
Ответ 2 : с кислотами и спиртами
Ответ 3 : с предельными углеводородами
Ответ 4 : между собой
4. Укажите вещества X, Y и Z в схеме превращений: Ответ 1 :
Ответ 2 :
Ответ 3 :
Ответ 4 :
5. Сложный эфир образуется при взаимодействии аминоуксусной
Ответ 1 : с гидроксидом натрия
Ответ 2 : с раствором серной кислоты
Ответ 3 : с аминоуксусной кислотой
Ответ 4 : с этанолом
6. Сколько потребуется уксусной кислоты (по массе) для получения 139,05 г этилового эфира аминоуксусной кислоты при 90% выходе? Калькулятор
Источник: orgchem.ru
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ 511 Аминокислоты обладают специфическими свойствами , обусловленными взаим- ным влиянием карбоксильной и аминогрупп. Отношение аминокислот к нагреванию. При нагревании — — — и -аминокис- лот образуются разные продукты. — Аминокислоты при нагревании претерпевают межмолекулярную дегидратацию, образуя при этом циклический диамид — дикетопиперазин : — Аминокислоты при нагревании отщепляют молекулу аммиака, образуя — ненасыщенные кислоты : — и — Аминокислоты при нагревании претерпевают внутримолекулярную дегидратацию, образуя циклические амиды — лактамы : Взаимодействие α -аминокислот с нингидрином. При действии нингидрина на — аминокислоты образуется краситель сине-фиолетового цвета. реакция протекает в две стадии. на первой стадии под действием нингидрина происходит окислительное дезаминирование аминокислоты и ее декарбоксилирование. на второй стадии реакции образовавшийся аммиак реагирует с эквимолекулярными количествами обычного и восстановленного нингидрина, образуя краситель сине-фиолетового цвета (синий руэмана):
Лучшая добавка для восстановления мышц и ЦНС (ГАМК, GABA, гамма аминомасляная кислота)
Глава 27 512 нингидриновая реакция используется для качественного определения — амино- кислот . 27.4.4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе аминоуксусная кислота (аминоэтановая кислота, гликокол, H 2 NCH 2 COOH глицин). белое кристаллическое вещество (т. пл.
232—236 °с с разложением), хорошо растворяется в воде, не растворяется в большинстве органических растворителей. в составе белков встречается чаще, чем другие — ами- нокислоты. аминоуксусная кислота ( глицин, глицисед ) применяется в медицине как метаболическое средство при ухудшении памяти, умственной отсталости у детей, старческом слабоумии, алкоголизме и т. д.). γ -аминомасляная кислота (4-аминобутановая кисло- H 2 NCH 2 CH 2 CH 2 COOH та, ГаМк). белое кристаллическое вещество (т. пл. 202 °с), хорошо растворяется в воде. ГаМк образуется в живых организмах при декарбоксилировании глутаминовой кислоты. является нейромедиатором, принимающим участие в обменных процессах головного мозга. — аминомасляная кислота ( аминалон ) применяется в медицине для лечения нервно-психических заболеваний, при ослаблении памяти, нарушениях мозгового кровообращения и др. ГаМк широко используют в синтезе лекарственных препаратов (пирацетам, фенибут и др.).
Гамма-аминомасляная кислота – Вячеслав Дубынин
| H 2 NCH 2 CH 2 CH 2 CH 2 CH 2 COOH | ε -аминокапроновая кислота (6-аминогекса- |
| новая кислота). белое кристаллическое вещест- |
во (т. пл. 372 °с), легко растворяется в воде. Применяется в медицине в качестве кровоостанавливающего средства (ингибитор фибринолиза). антраниловая кислота ( о -аминобензойная кислота). белое кристаллическое вещество (т. пл. 145 °с), практически не растворяется в воде. антраниловую кислоту используют в производстве красителей и лекарственных средств. на основе антраниловой кислоты создан один из эффективнейших нестероидных противовоспалительных препара- тов — мефенамовая кислота .
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ 513 п — аминобензойная кислота (Пабк). белое кристалли- ческое вещество (т. пл. 186 °с), малорастворимо в воде. входит в состав фолиевой кислоты, выполняющей роль ростового фактора для некоторых микроорганизмов. сложные эфиры п -аминобензойной кислоты широко применяются в медицине в качестве местноанестезирующих средств: анестезин (этиловый эфир п -аминобензойной кислоты), новокаин -диэтиламиноэтилового эфира п -амино- бензойной кислоты гидрохлорид) и др.: 27.5. иденТиФиКациЯ геТерОФунКциОналЬныХ КарБОнОвыХ КислОТ химические методы. химические методы идентификации замещенных карбоновых кислот сводятся к доказательству наличия соответствующих функциональных групп. так, присутствие карбоксильной группы может быть доказано по образованию солей, сложных эфиров, амидов. атом галогена в галогенокарбоновых кислотах определяют реакцией с серебра нитратом AgNO 3 после сплавления вещества с натрием. для определения спиртовой группы в гидроксикислотах используется реакция этерификации или дегидратации при нагревании. -Гидроксикислоты при нагревании образуют труднорастворимые в воде лактиды. -Гидроксикислоты при кипячении с 10 %-ным раствором натрия гидроксида образуют непредельные кислоты, в которых наличие двойной связи определяют известными методами.-Гидроксикислоты легко образуют лактоны, которые восстанавливают лития алюмогидридом LiAlH 4 до двухатомных спиртов, легко поддающихся идентификации. Подобно фенолам, фенолокислоты дают с железа (III) хлоридом фиолетовое окрашивание. карбонильную группу в оксокислотах определяют по ее способности образовывать нерастворимые кристаллические осадки с гидроксиламином, гидразинами, семикарбазидом и тиосемикарбазидом. с целью идентификации -аминокислот используют нингидриновую реакцию. Физические методы. введение галогена в -положение карбоновой кислоты смещает полосу валентных колебаний карбонильной группы в ик-спектре в сто- рону более высоких частот на 10—20 см –1 . из-за образования внутримолекулярной водородной связи поглощение карбонильной группы в -гидроксикислотах смещено в сторону низких частот. Поскольку -аминокислоты существуют в виде внутренних солей, для них в ик-спектрах характерна широкая сильная полоса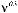
 в области 3100—2600 см –1 , а также слабая полоса
в области 3100—2600 см –1 , а также слабая полоса 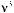
 при 1550—1485 см –1 . карбоксилат-анион имеет сильную полосу поглощения в области 1590 см –1 и слабую — при 1400 см –1 . Эти полосы связаны с асимметричными и симметричными валентными колебаниями связи C – O.
при 1550—1485 см –1 . карбоксилат-анион имеет сильную полосу поглощения в области 1590 см –1 и слабую — при 1400 см –1 . Эти полосы связаны с асимметричными и симметричными валентными колебаниями связи C – O.
глава 28 ПрОиЗвОдные угОлЬнОЙ КислОТы Угольная кислота является неустойчивым соединением, которое легко разлагается на углерода (IV) оксид и воду. формально угольную кислоту можно рассматривать как двухосновную карбоновую кислоту. угольная кислота как двухосновная образует два ряда функциональных про- изводных — неполные и полные галогенангидриды, сложные эфиры, амиды , а также смешанные функциональные производные — эфиры хлоругольной кислоты, эфиры карбаминовой кислоты (уретаны) и др. 28.1. ХлОрангидриды угОлЬнОЙ КислОТы теоретически для угольной, как двухосновной дикарбоновой кислоты, можно предположить существование двух типов хлорангидридов — неполного (монохлорангидрида) и полного (дихлорангидрида). Монохлорангидрид получил название « хлоругольная (хлормуравьиная) кислота », а дихлорангидрид — « фосген »:
ПрОИЗВОДнЫе УГОлЬнОЙ КИСлОТЫ 515 хлоругольная кислота в свободном состоянии не существует. в момент образования она распадается на углерода (IV) оксид и хлороводород. однако эфиры хлоругольной кислоты являются довольно устойчивыми соединениями. дихлорангидрид угольной кислоты (фосген) в обычных условиях представляет собой газообразное вещество с запахом прелого сена, тяжелее воздуха в 3—4 раза, малорастворим в воде. фосген очень ядовит. При вдыхании вызывает отек легких. в Первую мировую войну применялся как боевое отравляющее вещество. Получают фосген взаимодействием углерода (II) оксида с хлором на свету: в химическом отношении фосген проявляет свойства галогенангидридов карбоновых кислот. так, в присутствии воды фосген медленно гидролизуется с образованием углерода (IV) оксида и хлороводорода: с эквимолярными количествами спиртов фосген образует эфиры хлоругольной кислоты: Эфиры хлоругольной кислоты представляют собой жидкости с удушливым запахом, вызывают слезотечение. они содержат в своей структуре подвижный атом хлора, что позволяет широко использовать их в органическом синтезе. в химическом отношении они проявляют свойства галогенангидридов и сложных эфиров. в присутствии избытка спирта или алкоголята фосген образует полный эфир угольной кислоты: При действии на фосген аммиака атомы хлора замещаются на аминогруппы, и образуется диамид угольной кислоты — карбамид ( мочевина ): в промышленности фосген используется в синтезе лекарственных средств, а также для получения красителей, пластмасс и др.
Глава 28 51 28.2. аМиды угОлЬнОЙ КислОТы угольной кислоте соответствует два амида — неполный (моноамид) и полный (диамид). неполный амид называется карбаминовая кислота , а полный — моче- вина , или карбамид . карбаминовая кислота в свободном состоянии не известна, однако ее соли и эфиры являются довольно устойчивыми соединениями. Эфиры карбаминовой кислоты называют уретанами. уретаны получают действием аммиака на эфиры хлоругольной кислоты или диэфиры угольной кислоты: Уретаны — бесцветные кристаллические вещества, проявляющие свойства амидов и сложных эфиров. в поисках центральных миорелаксантов был синтезирован мепротан (мепробамат), который принято считать «родоначальником малых транквилизаторов». обладает снотворным и транквилизирующим действием. особый интерес представляет диамид угольной кислоты — мочевина. Мочевина является конечным продуктом распада белков, содержится в моче человека (около 2 %), откуда и была впервые выделена. синтетически получена в 1828 году немецким химиком фридрихом вёлером при упаривании водного раствора аммония цианата, который в этих условиях подвергается изомеризации:
ПрОИЗВОДнЫе УГОлЬнОЙ КИСлОТЫ 517 в промышленности мочевину получают в больших количествах взаимодействием аммиака с углерода (IV) оксидом: Мочевина — белое кристаллическое вещество (т. пл. 133 °с), хорошо растворяется в воде. в химическом отношении мочевина проявляет свойства амидов. однако в от- личие от амидов алифатических и ароматических карбоновых кислот у мочевины более выражены нуклеофильные и основные свойства. Это связано с тем, что в ее молекуле при карбонильной группе расположены две аминогруппы: в результате сопряжения неподеленных пар электронов атомов азота аминогрупп с -электронами кратной связи (+ М -эффект) основным центром в молекуле мочевины является атом кислорода. с сильными кислотами мочевина образует соли. так, при действии на мочевину азотной кислоты образуется малорастворимый в воде мочевины нитрат: в водных растворах кислот или щелочей при нагревании мочевина легко гидролизуется с образованием углерода (IV) оксида и аммиака: Проявляя нуклеофильные свойства, мочевина вступает в реакции с электрофильными реагентами — галогеналканами и галогенангидридами карбоновых кислот, образуя соответственно алкилмочевины и ацилмочевины: N — ацильные производные мочевины называют уреидами. уреиды некоторых карбоновых кислот используются в медицине. так, уреид — бромизовалериановой кислоты ( бромизовал ) применяется в качестве снотворного средства:
Глава 28 518 дикарбоновые кислоты могут образовывать с мочевиной циклические уреиды . важное значение имеет циклический уреид малоновой кислоты — барбитуровая кислота, структура которой лежит в основе ряда лекарственных препара- тов — барбитуратов (см. с. 623): Под действием азотистой кислоты мочевина разлагается с выделением азота, углерода (IV) оксида и воды. Эта реакция была открыта в 1875 году русским композитором и химиком-органиком александром Порфирьевичем бородиным и может быть использована для количественного определения мочевины путем измерения объема выделившегося азота: аналогично протекает реакция мочевины с водными растворами гипобромитов: Эта реакция, как и предыдущая, может быть также использована для количественного определения мочевины. При медленном нагревании кристаллической мочевины до 150—160 °с образуется биурет :
в качестве побочного продукта реакции образуется изоциановая кислота, которая подвергается полимеризации, образуя циануровую кислоту:
ПРОИЗВОДНЫЕ УГОЛЬНОй КИСЛОТЫ 519 Биурет образует с ионами меди (II) в щелочной среде комплекс красно-фио- летового цвета ( биуретовая реакция ): Реакция используется для качественного обнаружения мочевины и белков , кото- рые, как и биурет, содержат в своем составе группу – СO – NH – . Структура N — гидроксимочевины 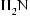

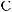

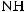

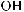 лежит в основе ряда пре- паратов противоопухолевого действия ( гидроксикарбамид, гидреа, гидроксиуреа и др.). Важным азотистым производным мочевины является иминомочевина, полу- чившая название « гуанидин » : Гуанидин — белое, расплывающееся на воздухе кристаллическое вещество (т. пл. 50 °С). Гуанидин являетса сильным однокислотным основанием, сравнимым по силе (р К ВН + = 13,5) с натрия гидроксидом. Центром основности молекулы является атом азота иминогруппы. Высокая основность гуанидина связана с образованием при протонировании устойчивого катиона гуанидиния, в котором положительный заряд делокализован между тремя атомами азота:
лежит в основе ряда пре- паратов противоопухолевого действия ( гидроксикарбамид, гидреа, гидроксиуреа и др.). Важным азотистым производным мочевины является иминомочевина, полу- чившая название « гуанидин » : Гуанидин — белое, расплывающееся на воздухе кристаллическое вещество (т. пл. 50 °С). Гуанидин являетса сильным однокислотным основанием, сравнимым по силе (р К ВН + = 13,5) с натрия гидроксидом. Центром основности молекулы является атом азота иминогруппы. Высокая основность гуанидина связана с образованием при протонировании устойчивого катиона гуанидиния, в котором положительный заряд делокализован между тремя атомами азота:
С кислотами гуанидин образует соли, устойчивые к гидролизу.
Глава 28 520 как и мочевина, гуанидин легко вступает в реакции алкилирования с галогеналканами и ацилирования со сложными эфирами карбоновых кислот. При конденсации с бифункциональными соединениями (диэфирами, дикетонами) гуанидин образует гетероциклические соединения: остаток гуанидина является структурным фрагментом нуклеинового основания гуанина , содержится в структуре аминокислоты аргинина , антибиотика стреп- томицина и др . :
Источник: studfile.net
Амины
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Амины
Источник: studarium.ru