Технологическая карта урока по теме «Альдегиды», включает полное изучение темы. Рассматривается на 2 уроках с проведением лабораторных работ и качественных реакций.
Скачать:
Предварительный просмотр:
Урок по теме «Альдегиды»
Конспект урока по химии в 10 классе «Альдегиды и их свойства»
- Расширение знаний о кислородсодержащих органических соединениях;
- продолжить формирование понятий гомология, номенклатура, изомерия на примере альдегидов;
- стимулировать обучающихся к целеполаганию, планированию деятельности, анализу индивидуальных достижений;
- обеспечить формирование познавательных, коммуникативных, регулятивных универсальных учебных действий обучающихся;
- использовать возможности ИКТ и Интернет-ресурсов для исследовательских работ и представления результатов;
- Знать общую формулу, функциональную группу класса альдегидов, их номенклатуру и виды изомерии;
- Уметь использовать возможности ИКТ и Интернет-ресурсы для исследовательских работ и представления результатов;
- Уметь формулировать цель урока, индивидуальные образовательные и развивающие задачи, составлять индивидуальный плана действий, подводить итог урока, анализировать индивидуальные достижения;
- Уметь выполнять задания части А, В ЕГЭ по химии.
- Карбонильная группа;
- Гомологи;
- Систематическая (IUPAC) и историческая номенклатура альдегидов;
- Структурная формула;
- Виды изомерии.
- Свойства
- Способы получения
- Применение
Биология, физика, математика, история, латинский язык.
Все химические свойства альдегидов | Химия ЕГЭ для 10 класса | Умскул
Химия. 10 класс. Углубленный уровень: учебник для общеобразоват. учреждений/ О.С.Габриелян, Ф.Н.Маскаев, С.Ю.Пономарев, В.И.Теренин; под ред. В.И.Теренина. – 12-е изд., стереотипное – М.: Дрофа,2018. – 318,(2)с.;ил.
Батаев В.А. Справочник по органической химии: Учебное пособие для школьников и абитуриентов/В.А.Батаев, Е.В.Батаева. — М.:ООО «Издательство АСТ»: ООО «Издательство Астрель», 2004. – 255, (1)с.; ил.
Контрольно-измерительные материалы. Химия: 10 класс/Сост. Н.П.Трегубова. – М.: ВАКО, 2011. – 96с.
Сайт РХТУ им. Менделеева
Мобильная электронная школа
Урок 1 Альдегиды.
Работа фронтальная, индивидуальная (работа с тестами, исследовательская работа) на компьютере, парная.
уроки общеметодологической направленности
Приемы и средства обучения:
Опора на знания обучающихся, использование алгоритмов, сравнение и анализ, информационные средства (мультимедийная презентация), задания с платформы «Мобильная электронная школа».
Виды учебной деятельности обучающихся
1. Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
2. Делать выбор наиболее эффективных способов решения задач в зависимости от конкретных условий.
Аффинаж Серебра.Восстановление из Аммиачного Раствора.
3. Уметь различать объективную трудность задачи и субъективную сложность.
4. Уметь ставить и формулировать проблемы, самостоятельно создавать алгоритмы деятельности при решении проблем творческого и поискового характера.
1. Владеть поиском нужной информации по заданной теме в источниках различного типа.
2. Обобщать понятия – осуществлять логическую операцию перехода от понятия с меньшим объёмом к понятию с большим объёмом.
3. Проводить рефлексию способов и условий действия, контроль и оценку процесса и результатов деятельности.
1. Уметь разрешать конфликты, выявлять, идентифицировать проблемы, вести поиск и давать оценку альтернативным способам разрешения конфликта.
2. Учиться критично относиться к своему мнению, с достоинством признавать ошибочность своего мнения (если оно таково) и корректировать его.
1. Формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды.
2. Планировать свою индивидуальную образовательную траекторию.
Основные этапы организации учебной деятельности
(в зависимости от типа урока)
Приветствие, проверка подготовленности к учебному занятию, организация внимания детей.
Мотивация учебной деятельности учащихся.
Назовите вещества, определите классы соединений:
СН 3 ОН – метанол (спирты)
С 6 Н 6 – бензол (арены)
С 4 Н 10 – бутан (алканы)
Называют вещества, определяют класс веществ
Умение вести диалог.
Организуют свою работу на уроке.
Постановка цели урока.
Какой класс кислородсодержащих соединений еще не изучен? Проблема: Что значит изучить альдегиды?
Формулируют тему и цель урока.
Умение вести диалог.
Определяют цели своего обучения, ставят и формулируют для себя новые задачи в учёбе и познавательной деятельности.
Актуализация опорных знаний.
Какую функциональную группу содержат альдегиды? Ее строение? Какими связями образована? Вид гибридизации?
Насекомые общаются между собой, выделяя ничтожные количества органических соединений, имеющих сравнительно небольшие молекулы. Такие вещества называются феромонами. Чувствительность насекомых к феромонам просто поразительна: самец ночной бабочки большой павлиний глаз чувствует половой феромон самки на расстоянии до 10 км!
Муравьи для подачи сигнала тревоги выделяют два феромона. Формулы этих феромонов вы сейчас видите на экране. Дайте названия этим веществам. Составьте структурную формулу одного из этих альдегидов, и приведите 2-3 формулы его изомеров, назовите их.
Вспоминают изученный ранее материал, необходимый для усвоения новой темы.
Отвечают на вопросы, дополняют друг друга.
Корректируют ответы одноклассников.
Открытие новых знаний
Далее мы пройдем в кабинет информатики, где продолжим занятие на платформе «Мобильная электронная школа».
Вы должны будете изучить материал по теме «Альдегиды»
Альдегиды — это органические кислородсодержащие вещества, содержащие альдегидную группу -CH=O. Общая формула насыщенных альдегидов с одной альдегидной группой в молекуле — CnH2nO.
Названия номенклатуры ИЮПАК для альдегидов образуются по общим правилам для веществ, содержащих функциональные группы. Наличие альдегидной группы в молекуле обозначается суффиксом -аль.Так, номенклатурное название первого члена ряда CH2=O — метаналь, а вещества с формулой CH3CH2CH2CH=O — бутаналь. Неправильное название — бутаналь-1, т. к. нумерация начинается с функциональной группы и альдегидная группа всегда расположена у первого атома углерода. Поэтому не нужно указывать её положение цифрой.
Для альдегидов часто используют названия, образованные от названий карбоновых кислот с тем же числом атомов углерода в молекуле. Например, метаналь называют муравьиным альдегидом или формальдегидом (от латинского названия муравьиной кислоты), этаналь — уксусным альдегидом, или ацетальдегидом, и т. д.
Для обозначения кетогруппы используют суффикс -он-. Например, кетон со структурной формулой:
По номенклатуре называется бутанон. В данном случае положение карбонильной группы указывать не нужно, ведь возможно существование только одного бутанона. А вот в случае кетонов с пятью атомами углерода это уже необходимо. Напишите самостоятельно структурные формулы пентанона-2 и пентанона-3.
Кетоны иногда называют согласно старой номенклатуре, перечисляя углеводородные заместители у карбонильной группы. Например, старое название бутанона — метилэтилкетон.
Первый член ряда кетонов — пропанон, или диметилкетон, — чаще называют ацетоном.
Поиск и выделение необходимой информации.
Умение отвечать на вопросы при изучении новой темы.
Рефлексия своих действий.
Находят признак, по которому классифицированы альдегиды
Устанавливают причинно-следственные связи.
Постороение логического доказательства.
Закрепление новых знаний
После изучения темы выполнить задания:
1.В фокусе токсикология. Спирты и организм
Прочитайте, что происходит с этанолом в организме, выпишите формулы и названия веществ, которые образуются в процессе окисления этанола. К каким классам относятся эти вещества? Как, по вашему мнению, должна работать система ферментов, обезвреживающих этанол, чтобы употребление алкоголя приводило к минимальным последствиям? А в каком случае спиртные напитки наиболее опасны? Обоснуйте свой ответ. Запишите свой ответ
2. Ключевой вопрос?
Историческая справка: Слово «альдегид» появилось в XIX в. Немецкий учёный Ю. Либих придумал это слово как сокращение от лат. alcohol dehydrogenatum, т. е. алкоголь дегидрированный. Каким способом, по вашему мнению, был получен первый альдегид? Объясните происхождение названия этого класса соединений с помощью уравнения реакции.
3. Вы уже познакомились с одним из членов ряда альдегидов — этаналем CH3CH=O. Запишите структурную формулу первого члена ряда альдегидов и выскажите предположение о том, как он называется по номенклатуре ИЮПАК. Сформулируйте определение, что такое альдегиды, и выведите общую формулу членов ряда предельных альдегидов.
Проверьте своё определение альдегидов, формулу и название первого члена ряда. При необходимости дополните свой ответ. Научитесь давать названия альдегидам с помощью заданий-тренажёров.
4. Напишите структурные формулы всех изомерных альдегидов состава C5H10O и дайте названия этим веществам по номенклатуре ИЮПАК.
5. Определяем вещество по свойствам
• Ароматическое вещество состава С7Н6О легко восстанавливает водно-аммиачный раствор оксида серебра и образуется при окислении спирта. Напишите структурную формулу этого вещества и уравнения реакций, описанных в задании.
Знакомятся с лексическим значением новых слов, применяют правило при выборе написания.
Умение работать на компьютере
Источник: nsportal.ru
Тема 4. Ацетиленовые углеводороды
Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnН2n-2.
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
4.2. Физические свойства ацетиленовых углеводородов
Физические свойства. По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2-C4 представляют собой газы, С5-C16 – жидкости, высшие алкины – твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
4.3. Способы получения
1. Общим способом получения алкинов является реакция дегидрогалогенирования – отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например, 1,2-дибромпропан), либо у одного атома углерода (2,2-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:

2. Важнейший из алкинов – ацетилен – получают в промышленности путем высокотемпературного крекинга метана:


В лаборатории ацетилен можно получить гидролизом карбида кальция:

4.4. Химические свойства
Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две s -связи расположены под углом 180°, а две p -связи расположены во взаимно перпендикулярных областях. Наличие p -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:

2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 – сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера – поливинилхлорида:

3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (П) (реакция Кучерова):

На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p -связь между атомами углерода разрывается и образуется p -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, пропин превращается в ацетон:

4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s -связи º С–Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.

Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:

Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:

Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:

Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:

При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:


В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:

Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2–CHCl2 – продукт присоединения хлора к этилену – служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов.
Источник: studfile.net
Альдегиды: примеры, описание, получение, свойства

Альдегиды – органические вещества, которые содержат карбонильную группу >С=О, связанную хотя бы с одним атомом водорода. Альдегиды, а также схожие с ними по строению и свойствам кетоны, называют карбонильными, или оксосоединениями. Примеры альдегидов – муравьиный, уксусный, пропионовый альдегид.
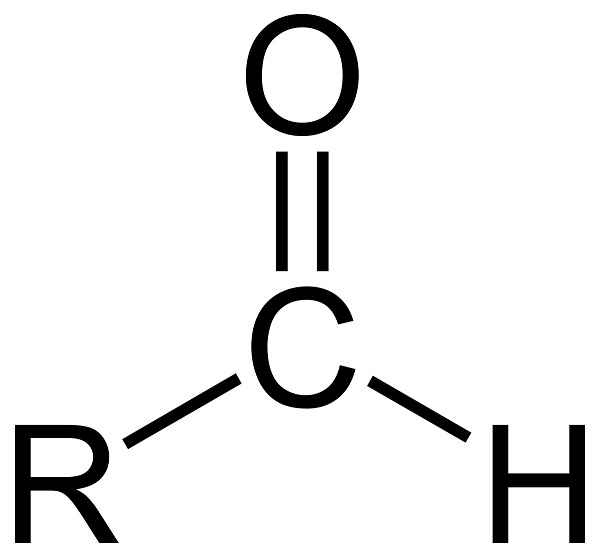
Номенклатура
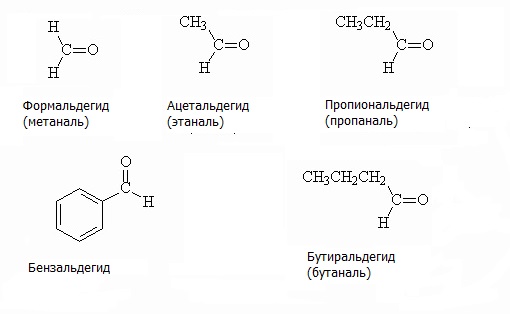
Тривиальные названия альдегидов образуют из тривиальных названий родственных карбоновых кислот. Примеры альдегидов с названиями представлены на рисунке. Первым представителем гомологического ряда альдегидов является муравьиный альдегид, или формальдегид, при окислении которого образуется муравьиная кислота. Второй представитель – уксусный альдегид, ацетальдегид, при окислении которого образуется уксусная кислота.
По номенклатуре ИЮПАК альдегидную группу обозначают суффиксом -аль, который добавляют к названию соответствующего углеводорода. Примеры альдегидов по номенклатуре ИЮПАК предложены на изображении ниже.
Если в соединении есть старшие группы, например, карбоксильные, то наличие альдегидной группы обозначают префиксом формил. Пример альдегида, который правильнее назвать дикарбоновой кислотой:
- НООС – СН (СНО) – СН2 – СООН
Это 2-формилбутандиовая кислота.
Описание веществ
Альдегиды в отличие от спиртов не обладают подвижным атомом водорода, поэтому их молекулы не ассоциируются, что объясняет значительно более низкие температуры кипения. К примеру, альдегид формальдегид кипит уже при температуре -21 °С, а спирт метанол – при +65 °С.
Однако такой низкой температурой кипения обладает только формальдегид, следующий представитель – ацетальдегид закипает при +21°С. Поэтому при комнатной температуре из всех альдегидов только формальдегид – газ, ацетальдегид уже легколетучая жидкость. Увеличение количества атомов углерода закономерно повышает температуру кипения. Так, бензальдегид С6Н5СНО закипает только при +180 °С. Разветвление цепи вызывает понижение температуры кипения.
Низшие альдегиды, к примеру, формальдегид, хорошо растворимы в воде. 40%-ный раствор формальдегида называют формалином, его часто используют для консервации биологических препаратов. Высшие альдегиды хорошо растворимы в органических растворителях – спирте, эфире.
Характерные запахи альдегидов
Альдегиды обладают характерными запахами, причем низшие – резкими, неприятными. Всем известен неприятный запах формалина – водного раствора формальдегида. У высших альдегидов цветочные запахи, их применяют в парфюмерии.
Примером альдегидов – веществ с приятным запахом — является ванилин, обладающий ароматом ванили, и бензальдегид, придающий характерный аромат миндальным орехам. Оба вещества получают синтетически и широко используют в качестве ароматизаторов в кондитерской промышленности и парфюмерии.
Получение
Рассмотрим способы получения альдегидов.
- Окисление спиртов.
Альдегиды получают при окислении первичных спиртов. Например, формальдегид, который используют в производстве полимерных материалов, лекарств, красителей, взрывчатых веществ. В промышленности формальдегид получают окислением кислородом метанола: 2СН3ОН + О2 = 2СН2О + 2Н2О.
Реакцию проводят на раскаленной серебряной сетке, серебро является катализатором. Через сетку пропускают пары метанола, смешанные с воздухом. Реакция идет с выделением большого количества тепла, которого хватает для поддержания сетки в раскаленном состоянии.
- Дегидрирование спиртов.
Альдегиды можно получать из спиртов и в отсутствии кислорода. В этом случае используют медный катализатор и высокие температуры (250 °С): R-CH2-OH = R-CHO + H2.
- Восстановление хлорангидридов кислот.
Альдегиды можно получать восстановлением водородом хлорангидридов кислот. В качестве катализатора используют «отравленный» палладий – с пониженной активностью: RCClO + H2 = RCHO + HCl.
- Получение ацетальдегида.
Ацетальдегид в промышленности получают окислением этилена кислородом или воздухом в жидкой фазе. В качестве катализатора необходим хлорид палладия (PdCl2 ): 2 СН2=СН2 + О2 = 2 СН3 СНО.
Химические свойства
Для альдегидов характерны следующие типы реакций:
- присоединения по карбонильной группе;
- полимеризации;
- конденсации;
- восстановления и окисления.
Большинство реакций идет по механизму нуклеофильного присоединения по связи С=О.
Обычно рассматривают химические свойства альдегидов на примере уксусного альдегида.
В карбонильной группе С=О электронная плотность смещена к атому кислорода, поэтому на карбонильном атоме углерода формируется частичный положительный заряд, который обусловливает химическую активность альдегидов. Положительный заряд на атоме углерода группы С=О обеспечивает его активность в реакциях с нуклеофильными реагентами – водой, спиртом, магний органическими соединениями. Атом кислорода воды может атаковать карбонильный атом углерода, присоединяться к нему и вызывать разрыв связи С=О.
Альдегиды вступают в реакции альдольной и кротоновой конденсации.
Ацетальдегид при действии слабого раствора щелочи на холоду превращается в альдоль. Продуктом реакции является жидкость, смешивающаяся с водой при пониженном давлении. Это вещество содержит как альдегидную, так и спиртовую группу (отсюда и название).
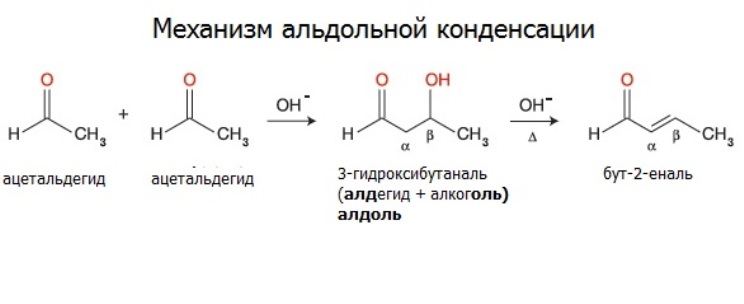
Качественные реакции
Для выявления альдегидов можно использовать две качественные реакции:
- Реакция «серебряного зеркала». Реакция идет с реактивом Толленса – аммиачным раствором оксида серебра. При смешивании раствора аммиака и раствора нитрата серебра образуется сначала раствор гидроксида серебра, а при добавлении избытка аммиака — раствор гидроксида диамминсеребра (I), который и является окислителем. При взаимодействии с альдегидом выделяется элементное серебро в виде черного осадка. Если реакцию проводить при медленном нагревании, не тряся пробирку, серебро покроет стенки пробирки, создавая эффект «зеркала».

- Реакция «медного зеркала». Другим реактивом, открывающим альдегидную группу, является гидроксид меди (II). При взаимодействии с альдегидом он восстанавливается до оксида меди (I). Цвет меняется с синего сначала на оранжевый, затем на желтый. Если реакцию проводить при медленном нагревании, оксид будет образовывать тонкий оранжево-красный налет на стенках пробирки – «медное зеркало»: СН3СНО + 2 Cu(OH)2 + NaOH = CH3COONa + Cu2O↓ + 3H2O.
Источник: fb.ru