Вычислить фактор пересчета, если определяемым веществом является Н3РО4, а весовой формой – Mg2P2O7.
Решение
Рассчитываем молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
Так как из одного моля Mg2P2O7 образуется 2 моля Н3РО4, то из 222 г Mg2P2O7 будет образовываться 146 г∙2 = 292 г Н3РО4.
Рассчитываем фактор пересчета:
Ответ: фактор пересчета для определяемого вещества Н3РО4 при весовой форме Mg2P2O7 равняется 0,76.
ЗАДАЧА № 320
Условие
Сульфат алюминия содержит около 88 % Al2(SO4)3×18H2O. Рассчитать навеску, необходимую для определения алюминия в виде Al2O3, если масса Al2O3 0,1 г.
Решение
Рассчитываем молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
Для образования одного моля Al2O3 необходим 1 моль Al2(SO4)3×18H2O. Следовательно, для образования 102 г Al2O3 требуется 666 г Al2(SO4)3×18H2O, а
По условию задачи 0,653 г Al2(SO4)3×18H2O составляют 88 % навески,
3 — БОМБИЧЕСКИЕ ФАКТУРЫ Своими руками. Из простых материалов мастер-класс. Декоративная шпатлевка
тогда х г — 100 %.
Ответ: для получения 0,1 г Al2O3 необходимо взять навеску, массой 0,742 г.
ЗАДАЧА № 343
Условие
Сколько процентов составят потери при промывании 300 мл воды осадка Al(OH)3, полученного из 0,1000 г Al2O3?
Решение
Рассчитываем молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
М(Al(OН)3) = Мr(Al(OН)3) = Ar(Al) + Ar(О)∙3 + Ar(Н)∙3 = 27 + 16∙3 + 1×3 = 78 г/моль.
1 моль Al2O3 расходуется на образование двух молей Al(OH)3. Следовательно, из 102 г Al2O3 образуется 78 г×2 = 156 г Al(OH)3, а
Растворимость Al(OH)3 в воде составляет 5,2×10 -9 моль/л (справочные данные). Тогда в 300 мл (0,3 л) воды растворится 5,2×10 -9 моль/л×0,3 л = 1,56×10 -9 моль Al(OH)3.
Если 1 моль Al(OH)3 весит 78 г, то
1,56×10 -9 моль Al(OH)3 — х г.
Масса осадка Al(OH)3 0,1529 г составляет 100 %, а
масса растворившегося в воде Al(OH)3 0,12168×10 -6 г – х %.
Ответ: потери Al(OH)3 составят 7,958×10 -5 %.
ЗАДАЧА № 477
Условие
Какую навеску х.ч. NaNO3 взяли для анализа по методу восстановления NO3 — до NH3, если выделившийся аммиак был поглощен 40,00 мл 0,1245 н. HCl и избыток кислоты оттитрован 22,40 мл 0,1002 н. NaOH?
Решение
Определяем массу HCl, взятой для поглощения NH3. Запись 0,1245 н. HCl означает, что в 1 л раствора содержится 0,1245 эквивалентов HCl. Рассчитываем эквивалентную массу HCl.
Мэкв.(HCl)= Mr(HCl) = Ar(Н) + Ar(Cl) = 1 + 35,5 = 36,5 г-экв.
Если 1 эквивалент HCl весит 36,5 г, то
0,1245 эквивалентов — х г.
Следовательно, в 1000 мл раствора содержится 4,54425 г HCl, тогда
в 40,00 мл раствора — х г HCl.
Количество HCl, оставшейся в избытке и оттитрованной 22,40 мл 0,1002 н. NaOH будет равно 22,40 мл 0,1002 н. HCl. Рассчитываем массу этой кислоты.
Если 1 эквивалент HCl весит 36,5 г, то
0,1002 эквивалента — х г.
Если в 1000 мл раствора содержится 3,6573 г HCl, то
Онлайн-тренинг «Дифференциальная сканирующая калориметрия (ДСК)»
в 22,40 мл раствора — х г HCl.
Рассчитываем массу HCl, израсходованной на поглощение NH3.
0,18177 г – 0,0819 г = 0,09987 г
Из записанного выше видим, что 1 моль HCl расходуется на поглощение 1 моля NH3, для образования которого необходим 1 моль NaNO3.
Рассчитываем молярную массу NaNO3.
М(NaNO3) = Mr(NaNO3) = Ar(Na) + Ar(N)+ Ar(О)∙3 = 23 + 14 + 16∙3 = 85 г/моль.
Если 36,5 г HCl соответствует 85 г NaNO3, то
0,09987 г HCl — х г NaNO3.
Ответ: для анализа взяли навеску NaNO3, массой 0,2326 г.
ЗАДАЧА № 617
Условие
Сколько граммов Н2О2 содержится в пробе, если при титровании израсходовано 14,50 мл раствора КMnO4, 1,00 мл которого эквивалентен 0,08376 г Fe?
Решение
1 мл КMnO4 эквивалентен 0,08376 г Fe. Это означает, что в 1 мл раствора КMnO4 масса эквивалентов равна 0,08376 г. Тогда, в 1000 мл раствора КMnO4 масса эквивалентов будет в 1000 раз больше: 0,08376 г×1000 = 83,76 г.
Рассчитываем массу 1 эквивалента КMnO4.
Определяем, сколько эквивалентов содержится в 83,76 г КMnO4: 83,76 г / 158 г-экв. = 0,53013.
Следовательно, на титрование раствора Н2О2 пошло 14,5 мл 0,53013 н. КMnO4. Значит и количество оттитрованного раствора Н2О2 тоже можно определить как 14,5 мл 0,53013 н. Н2О2. Определяем массу данного раствора, для чего находим эквивалентную массу Н2О2.
Если 1 эквивалент Н2О2 составляет 17 г, то 0,53013 эквивалентов Н2О2 будут весить 0,53013×17 г = 9,01215 г.
9,01215 г Н2О2 содержится в 1000 мл раствора, тогда
Ответ: в пробе содержится 0,13068 г Н2О2.
ЧАСТЬ II
В качестве одной нерешенной задачи выбрана задача № 741.
ЗАДАЧА № 667
Условие
Эталон I II III
Анализируемый образец имеет DS х = 0,30.
Решение
Основываясь на полученных данных по фотометрированию эталонных образцов, строим калибровочный график (рис. 1).
По калибровочному графику определяем, что DS х = 0,30 соответствует концентрация марганца 0,77 %.
ЗАДАЧА № 719 (вариант 3)
Условие
Решение
Рассчитываем молекулярную массу CuSО4×5H2O.
Мr(CuSО4×5H2O) = Ar(Cu) + Ar(S) + Ar(О)∙4 + (Ar(Н)×2 + Ar(О))×5 = 64 + 32 + 16∙4 + (1×2 + 16) 5 = 250
Согласно формуле 64 г Cu содержится в 250 г CuSО4×5H2O, тогда
0,1586 г Cu — в х г CuSО4×5H2O.
0,6274 г навески составляют 100 %, а
0,6195 г содержащегося в ней CuSО4×5H2O – х %.
Тогда масса примесей будет составлять 100 % — 98,75 % = 1,25 %.
ЗАДАЧА № 753 (вариант 4)
Условие
После соответствующей обработки соответствующих образцов стали, содержащих хром, сняли их полярограммы и получили следующие результаты:
Образцы 1 2 3 4
СCr, % 0,30 0,42 0,96 1,40
h, мм 8,0 10,0 20,0 28,0
Решение
Строим калибровочный график (рис. 3).
Полярограмме, высотой 18,0 мм, соответствует концентрация Cr 0,63 %.
ЗАДАЧА № 757 (вариант 5)
Условие
Решение
0,043 н. CdSO4 означает, что
в 1 л раствора содержится 0,043 эквивалента CdSO4, тогда
в 0,005 л раствора — х.
Рассчитываем массу 1 эквивалента CdSO4:
Если масса 1 эквивалента CdSO4 равна 104 г,
то масса 21,5×10 -5 эквивалента — х г.
Mr(CdSO4)×= Ar(Cd) + Ar(S) + Ar(О)×4 = 112 + 32 + 16×4= 208
Если в 208 г CdSO4 содержится 112 г Cd, то
в 2,236×10 -2 г — х.
Рассчитываем высоту волны, приходящуюся на 0,01204 г Cd:
28 мм – 19,5 мм = 8,5 мм.
Волна, высотой 8,5 мм соответствует 0,01204 г Cd, тогда
волна, высотой 19,5 мм — х.
Следовательно, в 18 мл раствора содержится 0,02762 г Cd, тогда
в 250 мл — х.
Масса 2,2940 г составляет 100 %, а
масса 0,38363 г — х.
ЗАДАЧА № 773 (вариант 5)
Условие
Для хроматографического определения никеля на бумаге, пропитанной раствором диметилглиоксима, приготовили три стандартных раствора. Для этого навеску NiCl2×6Н2О, массой 0,2480 г, растворили в мерной колбе на 50 мл. Затем из этой колбы взяли 5,0; 10,0 и 20,0 мл и разбавили в колбах на 50 мл. Исследуемый раствор также разбавили в мерной колбе на 50 мл.
Решение
Определяем молекулярную массу NiCl2×6Н2О:
Мr(NiCl2×6Н2О) = Ar(Ni) + Ar(Cl)×2 + ((Ar(Н)×2 + Ar(О))×6) = 59 + 35,5×2 + ((1×2 + + 16)×6) = 238
Исходя из формулы в 238 мг NiCl2×6Н2О содержится 59 мг Ni, а
в 248 мг — х.
На основе этих данных определяем массу никеля в каждом из стандартных растворов (табл. 3).
Источник: www.yurii.ru
4. Гравиметрический анализ
4.1. Расчет минимальной навески
Величина навески не может быть выбрана произвольно. При расчете минимальной навески необходимо учитывать ошибку взвешивания. Погрешность обычных аналитических весов составляет ±1×10 -4 г. Эта величина не должна превышать 0.1% от минимального количества весовой формы (х), поскольку допустимая относительная ошибка гравиметрического метода составляет 0.1%. Следовательно,
Пусть весовой форме определяемого элемента М соответствует формула МnАm. Обозначим молекулярную массу МnАm через Мв, а атомную массу М через Ам. Минимальное количество М может быть вычислено по следующей формуле:
Минимальная навеска будет равна
Пример 1. Рассчитать минимальную навеску технического хлорида бария, содержащего около 20% Ва, при определении Ва гравиметрическим методом в виде BaSO4.
Решение. По условию количество весовой формы (BaSO4) должно быть не менее 0.1 г; Мв = 233.40; Ам = 137.33.
По уравнению (4.1) находим минимальное количество Ва (Cmin)
Минимальная навеска а будет равна
Пример 2. Найти минимальную навеску руды, содержащей около 10% железа, при определении его гравиметрическим методом — осаждением в виде гидроксида.
Решение. Весовой формой в указанном методе определения Fe является оксид Fe2O3; Мв = 159.7; Ам = 55.85.
Вычисляем минимальную навеску по формуле (4.2)
Пример 3. Какую минимальную навеску A12(SO4)3-×18Н2О следует взять для определения алюминия осаждением в виде гидроксида?
Решение. В данном случае известен состав анализируемого образца; M(A12(SO4)3-×18Н2О) равен 666.5, а МВ(А12О3) = 102. Учитывая, что количество весовой формы не должно превышать 0.1 г, находим Минимальную навеску (а) из следующего соотношения:
З а д а ч и
Источник: studfile.net
Порядок выполнения практической работы
Тема:Решение задач по теме «Гравиметрический метод анализа».
Цель: формирование умения решать расчетные задачи по гравиметрическому методу анализа.
Теоретические основы
Гравиметрические методы анализа основаны на точном измерении массы чистого соединения известного состава, содержащего определяемый компонент. Чаще всего гравиметрический анализ выполняется по методу осаждения. В этом случае определяемый компонент выделяется из раствора в виде малорастворимого соединения (осаждаемая форма), которое отделяется от раствора фильтрованием, промывается, а затем высушивается или прокаливается для получения гравиметрической формы – чистого соединения известного состава, по массе которого вычисляются результаты анализа.
Любое гравиметрическое определение предполагает выполнение ряда предварительных приближенных расчетов (массы или объема аналитической пробы, объема осадителя, объема промывной жидкости), а также точный расчет массы или массовой доли определяемого компонента в анализируемом объекте и математико-статистическую обработку результатов анализа.
Расчет массы навески
Масса анализируемого вещества, достаточная для единичного гравиметрического определения (аналитическая проба, навеска), зависит от задаваемой точности анализа, чувствительности используемых аналитических весов, массовой доли определяемого компонента в анализируемом объекте, природы осаждаемой и гравиметрической форм.
Как правило, масса гравиметрической формы — m(ГФ) является наименьшей из масс, определяемых в ходе анализа. Поэтому относительная погрешность в определении массы гравиметрической формы – Еr= Еr(взв.) чаще всего определяет и общую точность анализа.
Так как погрешность единичного взвешивания на наиболее распространенных аналитических весах составляет ±1·10 -4 г, а масса гравиметрической формы m(ГФ) определяется по разности результатов двух взвешиваний, то абсолютная погрешность ее определения ∆m(ГФ) может составить 2∙10 -4 г. Поэтому, чтобы относительная погрешность гравиметрического определения не превышала 0,2%, масса аналитической пробы должна быть такой, чтобы масса полученной из нее гравиметрической формы была не меньше 0,1 г:
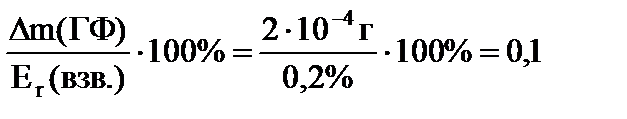
m(ГФ) = г
Очевидно, что точность гравиметрического определения, при прочих равных условиях, тем выше, чем больше масса гравиметрической формы, а, следовательно, и осаждаемой формы. Однако получение большого количества осадка существенно увеличивает временные затраты на проведение анализа. Оптимальной считается масса гравиметрической формы 0,1 г, получаемая из объемных аморфных осадков, 0,1 – 0,2 г – из легких кристаллических осадках и 0,2 – 0,5 г – из тяжелых кристаллических осадков.
Масса навески анализируемого вещества зависит также от массовой доли определяемого компонента Х в нем и от массовой доли Х в гравиметрической форме (величины гравиметрического фактора, фактора пересчета, аналитического множителя, обозначаемого как F(x/x a y b).
С учетом перечисленных выше факторов масса навески вещества, достаточная для единичного определения в нем компонента Х, гравиметрической формой которого является соединение X a Y b, вычисляется по формуле:
 =
= 
где m(нав.) – масса навески, г.;
m(ГФ) – масса гравиметрической формы, г;
ω%(Х) – массовая доля Х в анализируемом веществе, %;

– гравиметрический фактор.
Пример 1. Рассчитайте массу навески образца воздушно-сухого растительного лекарственного сырья для определения его влажности, если взвешивание проводить на технохимических весах с точностью ±0,1 г, а определение желательно выполнить с относительной погрешностью 1%. Анализируемое сырье содержит предположительно до 10% влаги.
∆m(взвешивания) = 0,1 г
Решение. Влажность растительного лекарственного сырья определяется обычно методом отгонки, т.е. по разности масс анализируемого образца до и после высушивания до постоянной массы при температуре 100 – 150ºС. Поскольку масса воды является наименьшей из масс, определяемых в ходе анализа, то относительная погрешность ее определения должна составлять 1%. Следовательно,

Так как влажность анализируемого образца составляет 10%, то

m(нав.) =
Пример 2. Рассчитайте массу навески сплава, которую необходимо взять для гравиметрического определения цинка в виде пирофосфата цинка Zn2P2O7, если сплав содержит около 10% цинка, а оптимальная масса гравиметрической формы равна 0,4 г.
Решение. Вычислим гравиметрический фактор, а затем массу навески:



m(нав.) = 1,7 ≈ 2 г.
Пример 3. Образец алюмокалиевых квасцов содержит предположительно до 15% примесей, не осаждающихся ионами бария и хлорид-ионами. Какой должна быть навеска квасцов для определения сульфат-ионов в виде сульфата бария, если оптимальная масса гравиметрической формы составляет 0,3 г?
Решение. Вычисляем гравиметрический фактор:

Рассчитываем массу навески квасцов с учетом того, что ω%(квасцов) = 85%:

Порядок выполнения практической работы
Задание: решите задачи (3 из предложенных вариантов на ваш выбор)
1. Рассчитайте массу навески сплава, которую необходимо взять для гравиметрического определения серебра в виде AgCl, если сплав содержит около 75% серебра, а оптимальная масса гравиметрической формы составляет 0,5 г.Ответ: 0,5 г.
2. Массовая доля железа в образце составляет приблизительно 25%. Рассчитайте массу навески образца для гравиметрического определения железа, если оптимальная масса гравиметрической формы оксида железа(III) равна 0,1 г.Ответ: 0,3 г.
3. Образец содержит приблизительно 1,8% серы. Рассчитайте массу навески данного образца для гравиметрического определения серы в нем в виде сульфата бария, если считать оптимальной массу гравиметрической формы равной 0,40 г. Ответ: 3,2 г.
4. Технический образец медного купороса содержит приблизительно 85% основного вещества и примеси, которые не осаждаются действием хлорида бария. Рассчитайте массу навески образца медного купороса для гравиметрического определения в нем сульфат-ионов в виде сульфата бария, если оптимальная масса гравиметрической формы составляет 0,4 г.Ответ: 0,5 г.
5. Образец железоаммонийных квасцов содержит приблизительно 5% примесей, которые не осаждаются совместно с гидратированным оксидом железа(III). Рассчитайте массу навески для гравиметрического определения железа в виде оксида железа(III), принимая оптимальной массу гравиметрической формы равную 0,1 г.Ответ: 0,6 г.
Сформулируйте вывод по работе
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Найдите 2 минуты и прочитайте про:
Образовательный процесс в ДОУ Образовательный процесс как фактор развития личности (сущность, функции, значение, принципы и особенности).
Звено и инстанция судебной системы Российской Федерации Суды, входящие в судебную систему, наделяются различными судебными полномочиями и выполняют различные процессуальные функции.
Классификация органов государственной власти, их виды Орган государства – это часть государственного механизма.
Основные функции культуры Культура представляет собой многофункциональную систему. Функциональный анализ культуры предполагает наличие в любом социуме.
Обзор попытки 1 Тест начат Среда 17 Июнь 2015, 22:03 Завершен Среда 17 Июнь 2015, 22:43 Прошло времени 39 мин 22 сек Набрано баллов 21/32 (65.
Источник: studopedia.ru