Одним из способов защиты от коррозии является нанесение поверхностных гальванических покрытий. Электроосаждение имеет ряд преимуществ перед другими методами защиты, т.к. оно позволяет:
• регулировать толщину слоя;
• экономно расходовать цветные металлы;
• наносить покрытия из металлов, имеющих высокую температуру плавления, как хром, никель, медь, серебро, платина.
Защитные электрохимические покрытия должны обладать:
• способностью изолировать изделие от агрессивной среды;
• собственной коррозионной стойкостью;
• заданными физико-механическими свойствами.
Вид покрытия, его толщина и назначение регулируются ГОСТ 9.303-84, и ГОСТ 9.306-85.
Защитные антикоррозионные покрытия могут быть анодными и катодными.
Металлические покрытия должны быть непроницаемыми для коррозионных агентов. Однако, если в металлическом покрытии есть дефекты в виде пор, царапин, вмятин, то характер коррозионного разрушения основного металла определяется электрохимическими характеристиками обоих металлов. По отношению к стали цинковое покрытие является анодным, а медное покрытие — катодным.
Антикоррозионные покрытия: металлические, лакокрасочные, полиуретановые, силикатно-эмалевые
Поэтому первоначально начинает разрушаться цинк. При этом он защищает от разрушения железо или сталь тем дольше, чем больше толщина покрытия, т.е. является протектором (рис. 4, а). Медь является катодным покрытием по отношению к железу, т.к. имеет потенциал более положительный.
Поэтому разрушению будет подвергаться железо и тем в большей степени, чем выше пористость медного покрытия (рис. 4, б).
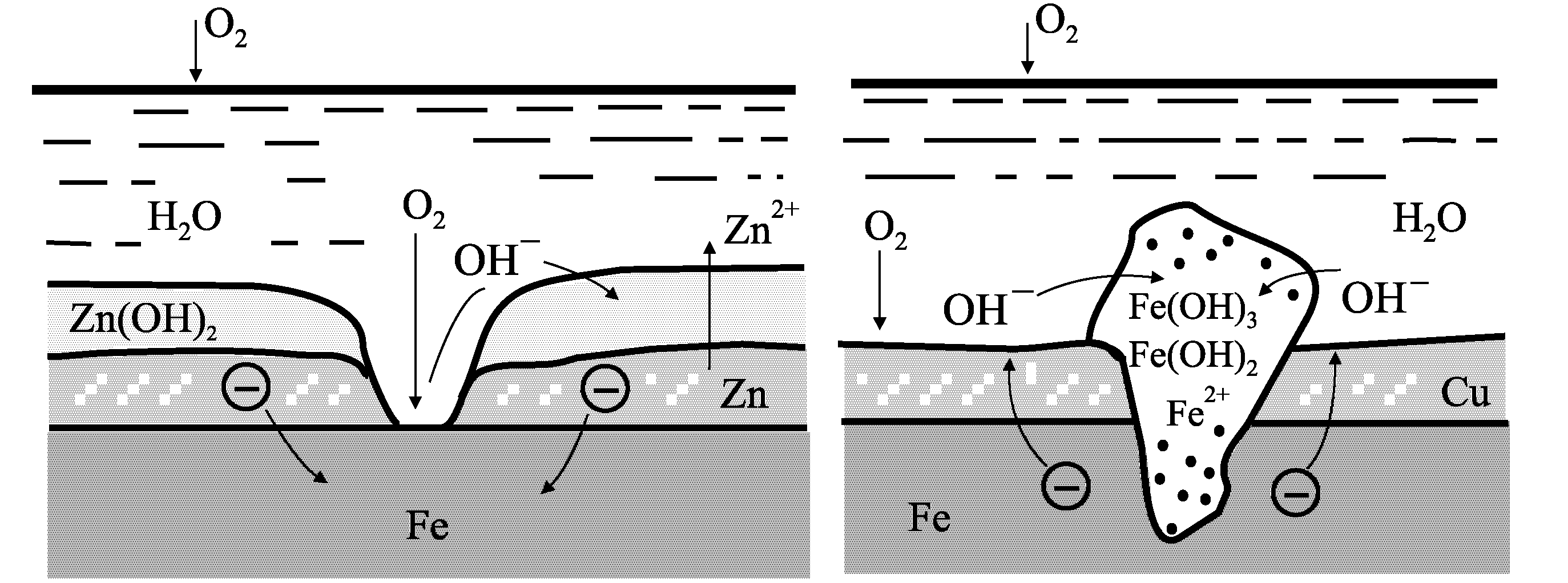
Рис.4. Схема, поясняющая действие анодных (а) и катодных (б) по отношению к основному металлу металлических покрытий
1.3.3. Цинкование и кадмирование
Цинковые покрытия применяются для защиты от коррозии деталей машин, трубопроводов, стальных листов. Цинк — дешевый и доступный металл. Он защищает основное изделие механическим и электрохимическим способом, так как при наличии пор или оголенных мест происходит разрушение цинка, а стальная основа не корродирует.
Покрытия из цинка занимают доминирующее положение. С помощью цинка защищают от коррозии примерно 20 % всех стальных деталей и около 50% производимого в мире цинка расходуется на гальванические покрытия.
Цинк нашел широкое применение в качестве защитного покрытия железных и стальных изделий. Цинк—легкоплавкий (Tпл= 419° С), мягкий и малопрочный металл. ПДК в воде — 0,01 мг/л. Стандартный электродный потенциал цинка Zn 2+ + 2е =Zn равен —0,76 В.
В 3 %-м растворе NaCl электродный потенциал цинка равен —0,83 В.

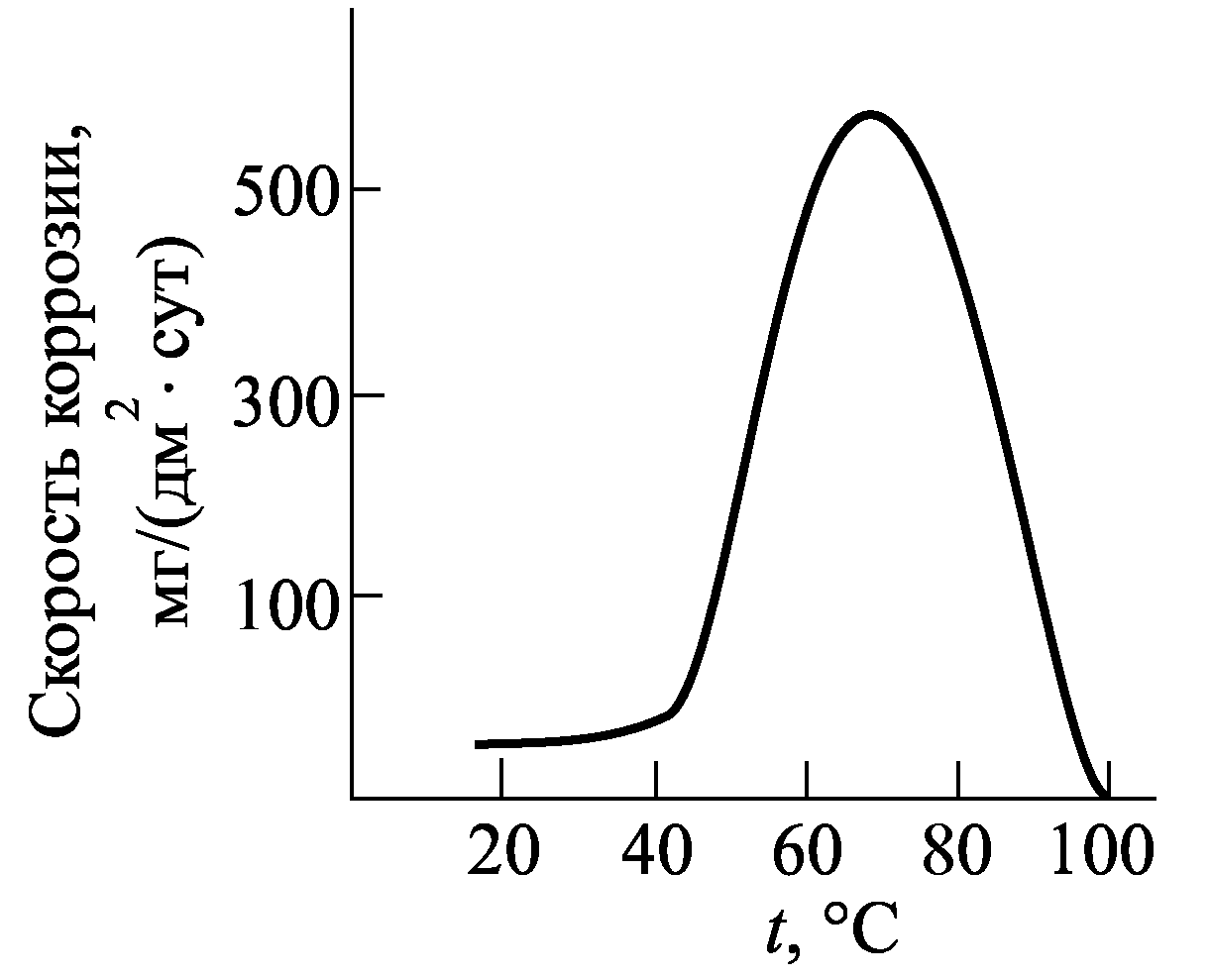
Рис.5 Влияние рН на кор- рис.6.
розию Zn. Влияние температуры
на скорость коррозии Zn в
Цинк обладает максимальной устойчивостью в интервале рН между 9 и 11 (рис. 5). Применение цинковых покрытий нерационально, если рН среды заметно меньше 7 или более 12 из-за усиления коррозии цинка.
6 способов защиты от коррозии
В воде цинк устойчив до 55 ° С (рис. 6). Скорость коррозии резко повышается с увеличением температуры и достигает максимума при 70 °С, а затем снижается. Наблюдаемые закономерности связывают с тем, что при температурах до 50 °С и выше 95 °С, на цинке образуется плотная пленка с высокими защитными свойствами.
В интервале температур (55-65) °С наблюдается образование рыхлых продуктов коррозии с низкими защитными свойствами. При 100° С продукты коррозии уплотняются, а также происходит уменьшение растворимости кислорода в коррозионной среде.
В чистой и морской атмосферах цинк стоек, так как покрывается слоем продуктов коррозии из гидроксидов и основных углекислых солей цинка. В загрязненных SO2, SO3, HC1 средах индустриальных районов устойчивость цинка и цинковых покрытий заметно снижается.
Цинк используется для защиты стали от атмосферной коррозии. Применяется для получения медных, никелевых, магниевых сплавов, в производстве аккумуляторов и как протектор при электрохимической защите железных сплавов.
Кадмий — серебристо-белый, мягкий металл. Плотность равна 8,65. Стандартный электродный потенциал кадмия Cd 2+ + 2е = Cd равен —0,40 В, а стационарный потенциал в 0,5н. растворе NaCl —0,52 В. ПДК в воде составляет 0,005 мг/л.
Кадмий — тягучий и ковкий металл, который легко прокатывается в листы и вытягивается в проволоку.
Способность к пассивации у кадмия невелика. Поэтому в контакте с железом, обладающим склонностью к пассивации, в большинстве случаев кадмий оказывается анодом. Кадмий употребляют в основном для нанесения анодных покрытий на сталь и на алюминиевые сплавы.
Кадмий сходен по коррозионному поведению с цинком. В нейтральных растворах кадмий корродирует с кислородной деполяри-зацией. В отличие от цинка скорость коррозии кадмия с увеличением рН понижается.
Вследствие менее отрицательного электродного потенциала кадмий имеет большую устойчивость в кислых и нейтральных растворах по сравнению с цинком. В щелочах он вполне устойчив. Кадмий устойчив к морской воде и морской атмосфере. Присутствие в газах SO2 и SO3 приводит к быстрому разрушению кадмия. Кадмий используется для получения сплавов с медью. Высокая токсичность кадмия ограничивает его применение в качестве защит-
Кадмий имеет более близкий потенциал к железу, чем цинк. Характер защиты кадмием зависит от коррозионной среды. Во влажной атмосфере и в присутствии хлор-ионов потенциал кадмия становится электроотрицательнее потенциала железа и кадмий электрохимически защищает металл от коррозии.
Для цинкования и кадмирования предложены электролиты, в которых металлы находятся в виде простых солей или в виде комплексных соединений. Наибольшее применение получили сульфатные электролиты. Их состав (г/л):

Катодная плотность тока для цинкования 100-400 А/м 2 , для кадмирования — 80-120 А/м 2 . Температура электролита для обоих процессов—15-30° С.
Источник: studfile.net
Элементы первой группы главной подгруппы
Металлы главной подгруппы первой группы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fг — называются щелочными металлами. Во внешнем электронном слое атомы щелочных металлов имеют по одному электрону ns 1 . В соединениях проявляют всегда степень окисления +1.
Таблица. Сравнительная характеристика щелочных металлов.
| Символ | Кем и когда открыт | Внешний электронный слой | Радиус атома (нм) | Плотность(г/см 3 ) | t° кипения | t° плавления |
| Li камень | 1817 г. АрфведсонШвеция | 2s 1 | 0,155 | 0,53 | ||
| Na бурлящее вещество | 1807 г. Дэви Англия | 3s 1 | 0,189 | 0,97 | 97,8 | |
| К поташ | 1807 г. Дэви Англия | 4s 1 | 0,236 | 0,86 | 63,55 | |
| Rb глубокий красный цвет | 1861 г. Бунзен, Кирхгоф Германия | 5s 1 | 0,248 | 1,53 | 38,8 | |
| Cs | 1860 г. Воклен Клапро Германия | 6s 1 | 0,268 | 1,9 | 28,5 | |
| Fr | 1939 г. Перей Франция | 7s 1 | 0,280 | 2,1 — 2,4 | = 20 |
Физические свойства:
Щелочные металлы — очень мягкие металлы, легко режутся ножом. На срезе — белого цвета с серебристым металлическим блеском, исчезающим на воздухе из-за окисления.
Химические свойства:
Являются сильными восстановителями.
1. Взаимодействие с кислородом. Рубидий и цезий самовоспламеняются на воздухе. Все щелочные металлы, кроме лития, образуют пероксиды:
2. Взаимодействие с галогенами, с выделением большого количества тепла:
3. Взаимодействие с серой и азотом, при нагревании:
6Li + N2 = 2Li3N (при комнатной температуре)
4. Взаимодействие с водородом при нагревании:
5. Взаимодействие с водой:
6. Взаимодействие с кислотами:
2Na + 2HCl = 2NaCl + H2↑
7. Взаимодействие с солями менее активных металлов:
Получение:
1. Натрий и литий получают электролизом расплавов их соединений:
2NaCl эл . ток 2Na + Cl2
2LiBr эл . ток 2Li + Br2
2. Калий — восстановлением из расплавов КОН или КСl натрием:
KCl + Ca = CaCl + K
3. Рубидий и цезий восстановлением из их хлоридов кальцием:
2RbСl + Са = СаСl2 + 2Rb
2CsCl + Ca = CaCl2 + 2Cs
Соединения щелочных металлов:
Щелочные металлы — самые сильные восстановители, их ионы не проявляют окислительных свойств.
Таблица. Соединения щелочных металлов.
| Гидроксиды — едкие щелочи | Соли щелочных металлов |
| Твердые кристаллические вещества, хорошо растворимы в воде, типично ионные соединения, сильные основания. Для них характерны все свойства оснований. NаОН — едкий натр (каустическая сода) КОH — едкий калий Получение: 1. Электролиз водного раствора NаСl: 2NаС1 + 2Н2О = Сl2 + Н2 + 2NаОН 2. Каустификация соды: К2СО3 + Са(ОН)2 = 2КОН + СаСО3 | Типично ионные соединения, хорошо растворимые в воде (кроме некоторых солей лития). Для них характерны все свойства солей. Если соль образована слабой кислотой, то соли гидролиуются: Na2СО3 + Н2О = NаНСО3 + NаОН К2S + Н2О = КНS + КОН Качественные реакции: окрашивание пламени ионами Li + — карминово-красное Na + — желтое K + — фиолетовое |
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Анодным или катодным покрытием является никель для цинка для серебра
Привет Лёва Середнячок
помогите ответить
1. Какой из металлов является анодным покрытием изделия из олова:
1) Cu 2) Zn 3) Ag 4) Au
2. Какой из металлов является катодным покрытием изделия из нике-ля:
1) Cu 2) Fe 3) Al 4) Cr
3. Как протекает анодный процесс атмосферной коррозии пары ме-таллов никель-олово:
1) A: O2 + 2H2O + 4ē → 4OH– 2) A: Ni0 – 2ē → Ni2+
3) A: 2H+ + 2ē → H2 4) A: Sn0 – 2ē → Sn2+
4. Как протекает катодный процесс атмосферной коррозии пары ме-таллов алюминий-никель:
1) K: Al3+ + 3ē → Al0 2) K: O2 + 2H2O + 4ē → 4OH–
3) K: Ni2+ + 2ē → Ni0 4) K: 2H+ + 2ē → H2
5. Как протекает катодный процесс коррозии пары металлов серебро-золото в кислой среде:
1) K: 2H+ + 2ē → H2 2) K: Au0 – 3ē → Au3+
3) K: Ag0 – 1ē → Ag+ 4) K: O2 + 2H2O + 4ē → 4OH–
0 (0 оценок)

ванно1 7 лет назад
Светило науки — 2 ответа — 0 раз оказано помощи
1).2
2)4
. как-то так!
Источник: vashurok.com