Анионы третьей аналитической группы не имеют группового реагента. Эта группа включает следующие анионы: нитрит-анион NO — 2, нитрат-анион NO — 3 и ацетат-анион СН3СОО — . Анионы этой группы не образуют осадков ни с хлоридом бария, ни с нитратом серебра. Анионы NO2, NO — 3 и СН3СОО — — бесцветны.
Нитрит-ион NO — 2 является анионом азотистой кислоты HNO2, которая существует только в холодных разбавленных водных растворах. Она неустойчива и легко разлагается на оксид азота (III) и воду:
В свою очередь, оксид азота (III) устойчив только при низких температурах. При комнатной температуре он сразу же разлагается:
Соли азотистой кислоты более устойчивы, чем кислота. Все соли хорошо растворимы в воде. Меньше всего растворим нитрит серебра AgNO2, но он легко растворяется при нагревании. Комплексные соли, содержащие нитрит-ион NO2, слабо растворяются. Например, K3[Co(NO2)6] и (NH4)3[Co(NO2)6].
1. Реакция с кислотами. Разбавленные кислоты вытесняют из солей азотистую кислоту, которая разлагается при этом на воду и оксиды азота:
Реакция серебра 900 пробы с концентрированной азотной кислотой
Оксид азота (IV) — бурый газ, оксид азота (II) — бесцветный. Концентрированная серная кислота реагирует более энергично, чем разбавленная. Реакция является фармакопейной.
2. Действие окислителей. Перманганат калия КМnО4 в присутствии разбавленной серной кислоты обесцвечивается солями азотистой кислоты:
3. Йодид калия KI в кислой среде окисляется азотистой кислотой до свободного йода:
Реакцию нельзя проводить в присутствии других окислителей.
4. Антипирин в кислой среде образует с нитрит-ионами раствор зеленого цвета. Реакция является фармакопейной.
5. Риванол, или этакридин (I) в кислой среде образует с нитритами раствор красного цвета. Реакция специфична для нитритов.
1. Сульфат железа (II) FeSO4 в присутствии концентрированной серной кислоты восстанавливает анион NO — 3 до оксида азота (II):
Оксид азота (II) с избытком ионов Fe 2+ (не успевшим окислиться) образует неустойчивые комплексные ионы [FeNO] 2+ бурого цвета:
NO + Fe 2+ =[FeNO] 2+ .
Если неизвестно, нитрат или нитрит находятся в растворе, необходимо сначала провести реакцию с разбавленной серной кислотой. Образующееся соединение бурого цвета доказывает присутствие нитрит-иона NO2. Если бурого окрашивания не видно, необходимо повторить реакцию с концентрированной верной кислотой. Появление бурого кольца докажет присутствие NO — 3 -иона. Реакцию проводят, осторожно наслаивая на кристаллик сульфата железа (II) анализируемый раствор и концентрированную серную кислоту.
2. Раствор дифениламина (С6Н5)2NН в концентрированной серной кислоте образует с нитрат-ионом интенсивно-синее окрашивание, вследствие окисления дифениламина образующейся азотной кислотой. NO — 3, CrO 2- 4 и другие окислители образуют с раствором дифениламина подобное окрашивание. Реакцию проводят на предметном стекле, смешивая стеклянной палочкой анализируемый раствор и раствор дифениламина.
Три способа получения азотной кислоты [NurdRage]
Ацетат-ион является анионом уксусной кислоты. Это слабая одноосновная кислота. Почти все ее соли хорошо растворимы в воде. Трудно растворимы лишь соль серебра и некоторые основные соли.
1. Сильные кислоты (H2SO4, HCl) вытесняют свободную уксусную кислоту из ее солей:
Уксусная кислота обнаруживается по характерному острому запаху. Небольшое нагревание усиливает выделение уксусной кислоты и делает реакцию более чувствительной.
2. Хлорид железа (III) FeCl3 дает с солями уксусной кислоты на холоде растворимый ацетат железа (III) Fe(CH3COO)3 красно-бурого цвета:
При разбавлении водой и нагревании происходит гидролиз ацетата железа (III) с образованием красно-бурого осадка основного ацетата железа (III):
Обнаружению ацетат-иона СН3СОО — с помощью этой реакции мешают анионы, осаждающие ионы Fe 3+ (например, РO 3- 4, СО 2- 3), мешают ей и йодид-ионы, которые окисляются ионами Fe 3+ до свободного йода, придающего раствору красно-бурую окраску. Все мешающие ионы удаляют действием Ba(NO3)2 и AgNO3. Исследуемый раствор должен быть нейтральным. Реакция является фармакопейной.
3. Этанол С2Н5ОН с уксусной кислотой в присутствии концентрированной серной кислоты образует этилацетат или уксусноэтиловый эфир, обладающий приятным запахом, напоминающим запах плодов.
ВОПРОСЫ
1. Что положено в основу классификации анионов?
2. С помощью каких реакций можно отличить нитрит-ион от нитрат-иона?
3. Почему нитрит-ион NO2 и окислители мешают обнаружению иона NO — 3?
4. Какие органические реагенты используют для обнаружения нитрит-иона NO — 2?
5. Каковы особенности проведения реакции обнаружения ацетат-ионов СН3СОО — с помощью хлорида железа (III)?
ГЛАВА 15. СИСТЕМАТИЧЕСКИЙ ХОД

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса.

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар.
Расчетные и графические задания Равновесный объем — это объем, определяемый равенством спроса и предложения.
Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности.
Схема рефлекторной дуги условного слюноотделительного рефлекса При неоднократном сочетании действия предупреждающего сигнала и безусловного пищевого раздражителя формируются.
Уравнение волны. Уравнение плоской гармонической волны. Волновое уравнение. Уравнение сферической волны Уравнением упругой волны называют функцию , которая определяет смещение любой частицы среды с координатами относительно своего положения равновесия в произвольный момент времени t.
Медицинская документация родильного дома Учетные формы родильного дома № 111/у Индивидуальная карта беременной и родильницы № 113/у Обменная карта родильного дома.
Толкование Конституции Российской Федерации: виды, способы, юридическое значение Толкование права – это специальный вид юридической деятельности по раскрытию смыслового содержания правовых норм, необходимый в процессе как законотворчества, так и реализации права.
Значення творчості Г.Сковороди для розвитку української культури Важливий внесок в історію всієї духовної культури українського народу та її барокової літературно-філософської традиції зробив, зокрема, Григорій Савич Сковорода (1722—1794 pp.
Источник: studopedia.info
Азотная кислота и её соли

С помощью этого видео учащиеся смогут узнать о промышленном и лабораторном способе получения азотной кислоты, о её физических и химических свойствах, увидят разницу в химических свойствах разбавленной и концентрированной азотной кислоты. Кроме этого, здесь есть материал по применению азотной кислоты и её солей – нитратов, открытию азотной кислоты, а для систематизации знаний в конце урока обобщается материал темы.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Азотная кислота и её соли»
Азотная кислота и её соли
Азотная кислота – бесцветная жидкость, «дымит» на воздухе и окрашивается в жёлтый цвет, который придаёт ей оксид азота (IV), она обладает резким раздражающим запахом, кипит при температуре 83 0 C, с водой смешивается в любых соотношениях.

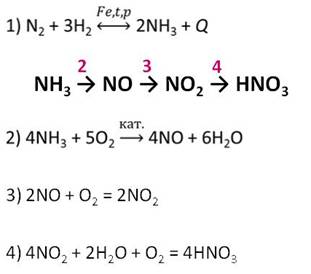
Сырьём для получения азотной кислоты в промышленности служат азот и водород. Азот превращают в аммиак, затем аммиак окисляют кислородом воздуха в присутствии катализатора до оксида азота (II), потом оксид азота (II) окисляют до оксида азота (IV), а при растворении оксида азота (IV) в воде и в присутствии кислорода воздуха образуется азотная кислота.
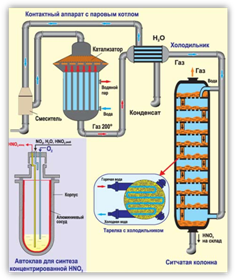
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на твёрдый нитрат натрия при незначительном нагревании.
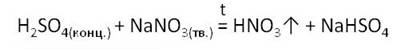
Способ получения азотной кислоты по обменной реакции открыт более трёхсот пятидесяти лет назад немецким химиком и аптекарем Глаубером. В результате взаимодействия нитрата калия с серной кислотой Глаубер получил «спиритус нутри» ― «дух селитры», а в России в старину азотную кислоту называли «селитряной дымистой водкой».


В водном растворе азотная кислота проявляет все свойства кислот. Она является сильной одноосновной кислотой, поэтому диссоциирует по первой ступени на ион водорода и анион кислотного остатка.
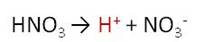
Азотная кислота, как и другие кислоты, реагирует с основными и амфотерными оксидами. Например, в реакции оксида магния с азотной кислотой образуется нитрат магния и вода, в реакции оксида алюминия с азотной кислотой, образуется соль – нитрат алюминия и вода.
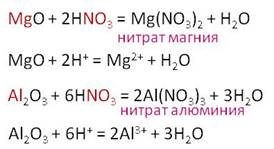
Азотная кислота реагирует с основаниями, как с растворимыми, так и нерастворимыми. В реакции взаимодействия гидроксида натрия с азотной кислотой, образуется соль – нитрат натрия и вода, в результате взаимодействия гидроксида меди (II) с азотной кислотой, также образуется соль – нитрат меди (II) и вода.
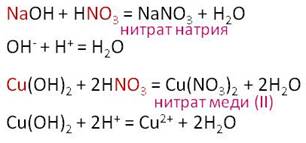
Азотная кислота вступает во взаимодействие с солями слабых кислот. Например, в реакции карбоната натрия с азотной кислотой образуется соль – нитрат натрия, углекислый газ и вода.
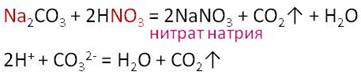
Азотная кислота является одним из сильнейших окислителей, за счёт азота в высшей степени окисления +5, поэтому она окисляет многие простые и сложные вещества.
Так, концентрированная азотная кислота реагирует практически со всеми металлами, расположенными в ряду активности как до, так и после водорода, кроме золота и платины. Так как окислителем в концентрированной азотной кислоте являются ионы кислотного остатка, а не ионы водорода, то при взаимодействии с металлами, водород не выделяется.
Например, если в пробирку с медными стружками осторожно прилить концентрированную азотную кислоту и немного подогреть, то можно увидеть, что раствор приобретает голубую окраску, из-за образования гидратированных ионов меди, а из раствора выделяется бурый газ – оксид азота (IV).
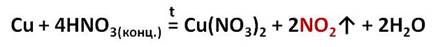
Некоторые металлы, такие как железо, алюминий, хром пассивируются в концентрированной азотной кислоте, поэтому концентрированную азотную кислоту хранят и перевозят в стальных или алюминиевых ёмкостях.



Разбавленная азотная кислота также является окислителем за счёт атома азота. Поэтому в реакции меди с разбавленной азотной кислотой образуется газ – оксид азота два и вода.
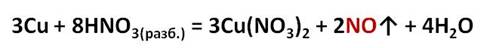

Молекулы азотной кислоты относительно нестойкие и концентрированная азотная кислота под действием теплоты и света частично разлагается на оксид азота четыре, кислород и воду.

Поэтому её хранят в прохладном тёмном месте.
Концентрированная азотная кислота окисляет многие органические вещества. Например, тлеющая лучинка, опущенная в склянку с нагретой концентрированной азотной кислотой, загорается ярким пламенем.

Скип@$https://videouroki.net/video/24-azotnaia-kislota-i-ieio-soli.html» target=»_blank»]videouroki.net[/mask_link]
Азотная кислота реагирует с нитратом серебра
Вопрос по химии:
В реакцию с раствором азотной кислоты вступает
нитрат бария
хлорид серебра
карбонат магния
сульфат бария
2.
Установите соответствие между формулой вещества и классом неорганических веществ
ФОРМУЛА ВЕЩЕСТВА КЛАСС ВЕЩЕСТВА
А. KOH 1)оксид
Б. P2O5 2)кислота
В. H2SO4 3)соль
Г. HOH 4)основание
3.Неметаллические свойства усиливаются в ряду
литий – натрий — калий
фтор – кислород — азот
фосфор – сера — хлор
бериллий – магний – кальций
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 08.03.2016 13:14
- Химия
- remove_red_eye 7801
- thumb_up 5
Источник: online-otvet.ru