Увеличение растворимости малорастворимых соединений часто связано с образованием комплексов. Во многих случаях осаждаемые ионы способны взаимодействовать с различными лигандами, в результате чего они влияют на состояние равновесия между осадком и раствором. Так, ионы винной кислоты и других оксикислот мешают осаждению железа в виде гидроксида. Растворимость сульфата свинца в присутствии Рb(NО3)2 увеличивается в результате образования комплексных катионов [Pb2SO4] 2+ , [Pb3(SO4)2] 2+ и др. При осаждении ионов серебра избытком хлороводородной кислоты или хлорида натрия часть осадка хлорида серебра переходит в раствор в виде комплексных анионов [AgCl2] — или [AgC13] 2- .
Сдвиг состояния равновесия между осадком и раствором в сторону растворения осадка зависит от произведения растворимости осадка, устойчивости комплекса, концентрации лиганда, кислотности раствора и других условий.
С помощью лигандов можно связать различные ионы, которые мешают анализу, методом осаждения или другими методами. По существу этот процесс соответствует разделению без фильтрования, промывания и т. д., которые требуют много времени.
плавка хлорида серебра
Расчеты растворимости осадков при образовании комплексов связаны с некоторыми затруднениями. Обусловлено это тем, что для многих комплексных соединений пока не установлены константы нестойкости или устойчивости. Кроме того, комплексные ионы, аналогично многоосновным кислотам, образуются и диссоциируют ступенчато. Состояние равновесия между отдельными формами комплексных групп зависит от концентрации лиганда и кислотности раствора.
ПРИМЕР 3.10 Рассчитать растворимость хлорида серебра в 1М растворе NH3 при условии, что после достижения равновесия концентрация избытка аммиака [NH3] составила 0,1моль/л.
Решение: Растворимость хлорида серебра в растворе аммиака связана с образованием аммиачного комплекса:
Это соединение представляет собой сильный электролит и диссоциирует на ионы [Ag(NH3)2] + и С1 — . Таким образом, комплексным является катион [Ag(NH3)2] + , который очень слабо диссоциирует. Поэтому растворимость в этом случае связана с взаимодействием ионов серебра с аммиаком по уравнению:
Константа устойчивости комплекса имеет вид:
Произведение растворимости хлорида серебра:
ПPAgCI = [Ag + ][С1 — ] = 1∙10 -10 .
Уравнение реакции между хлоридом серебра и аммиаком можно записать следующим образом:
Константа равновесия этой реакции
Если это выражение умножить и поделить на концентрацию ионов серебра [Ag + ] и подставить соответствующие значения, то
К=1,7∙10 7 ∙10 -10 =1,7∙10 -3
Состояние равновесия реакции смещается вправо тем больше, чем больше растворимость осадка и чем меньше константа диссоциации комплекса, т. е. чем больше его устойчивость.
При растворении осадка AgCl в растворе NH3 количества ионов С1 — и [Ag(NH3)2] + будут равны, т.е. [C1 — ] = [Ag(NH3)2] + .
Тогда можно записать:
Следовательно, растворимость AgCl, в воде равна 10 -5 М, а в 1М растворе аммиака увеличивается до 3,7∙10 -3 М, т.е. осадок практически полностью переходит в раствор.
разные способы восстановления после хлорида серебра
3.5. ДРОБНОЕ ОСАЖДЕНИЕ
Нередко прибавляемый реагент образует малорастворимое соединение не с одним, а с двумя или несколькими ионами, находящимися в растворе. Используя правило произведения растворимости, можно понять, как происходит осаждение ионов в подобных случаях.
Допустим, что в растворе одновременно присутствуют катионы Ca 2+ и Ba 2+ , их концентрации равны 10 -1 моль/л. При постепенном прибавлении к этой смеси раствора оксалата аммония (NH4)2C2O4 возможно течение двух реакций:
Первым выпадает в осадок то соединение, для которого раньше будет достигнута (и превышена) величина произведения растворимости.
Исходя из значений ПР, можно вычислить, какие концентрации иона C2O4 2- необходимы для начала осаждения оксалата кальция и бария:
Из приведенных расчетов видно, что для осаждения оксалата кальция требуется значительно меньшая концентрация оксалат-иона (2,6∙10 -8 моль/л), чем для оксалата бария (1,6∙10 -6 моль/л).
Следовательно, из смеси будет первым осаждаться оксалат кальция, для которого произведение растворимости достигается раньше.
Таким образом, осаждение ионов из их смеси происходит в той последовательности, в какой достигаются произведения растворимости малорастворимых электролитов, образующихся при действии того или иного реактива, т.е. первым выпадет в осадок соединение с меньшим значением произведения растворимости. Такое последовательное осаждение называется фракционированным (или дробным).
Последовательность выпадения осадков зависит не только от величины ПР, но и от концентрации соответствующих ионов в растворе. Например, увеличив концентрацию ионов Вa 2+ в 100 раз и больше по отношению к концентрации ионов Ca 2+ , удается вызвать обратную последовательность осаждения оксалатов бария и кальция, т. е. первым выпадает осадок BaC2O4.
Дробное осаждение используют достаточно часто в качественном химическом анализе, осадочной хроматографии и т. д.
3.6. Превращение одних малорастворимых
соединений в другие
В аналитической химии часто приходится иметь дело с реакциями, в которых одно малорастворимое соединение переводят в другое, еще менее растворимое в данных условиях. Например, осадок SrSO4 (ПР=3,2·10 -7 ) легко превращается в SrCO3 (ПР = 1,1∙10 -10 ) при действии избытка раствора Na2CO3 на осадок SrSO4.
Это имеет большое практическое значение, т. к. SrSO4 не растворяется в кислотах, а SrCO3 – растворим. Поэтому, чтобы перевести SrSO4 в раствор, его сначала превращают в карбонат, а затем растворяют в кислотах.
Если сравнить произведения растворимости BaSO4 (ПР=1,1·10 -10 ) и BaCO3 (ПР=5,1·10 -9 ), может показаться, что перевести сульфат бария в карбонат нельзя. Однако это не так. Осадок BaCO3 образуется всегда, когда произведение растворимости его окажется превышенным, т. е. .
Превращение BaSO4 в BaCO3 должно происходить при условии: , т. е. ,
Таким образом, чтобы превращение BaSO4 в BaCO3 происходило, надо, чтобы [CO3 2- ] в растворе превышала [SO4 2- ] более, чем в 50 раз.
На практике для более полного перевода осадка осуществляют многократное действие свежей порцией раствора Na2CO3 на осадок, сливая при этом жидкость с осадка.
Процессы превращения одних малорастворимых соединений в другие могут быть с успехом использованы для разделения ионов, особенно при их дробном обнаружении.
Источник: studopedia.ru
Чем можно растворить хлорид серебра?
У нас есть 16 ответов на вопрос Чем можно растворить хлорид серебра? Скорее всего, этого будет достаточно, чтобы вы получили ответ на ваш вопрос.
Содержание
- Чем можно растворить серебро?
- Как восстановить изделия из серебра?
- Чем можно растворить хлорид серебра? Ответы пользователей
- Чем можно растворить хлорид серебра? Видео-ответы
Отвечает Илья Бикмуллин
Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
Чем можно растворить серебро?
Чтобы растворить серебро, металл расплавляют с другим металлом, который хорошо растворяется в соляной кислоте (например, с медью). Если нужно отделить золото от серебра, то расплавленный сплав выливают в воду, в результате реакции образуются мельчайшие частички сплава.
Как восстановить изделия из серебра?
В небольшую емкость нужно налить воды, добавить туда нашатырный спирт в пропорции 1 к 10, положить украшения и оставить их на 30 минут. Если после получаса не удалось вернуть блеск серебру, нужно подержать его подольше в растворе. После процедуры остается только вытереть кольца, цепочки или браслет насухо.
Источник: querybase.ru
Уравнение растворения осадка хлорида серебра

Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.

Молекулярная и кристаллическая структура
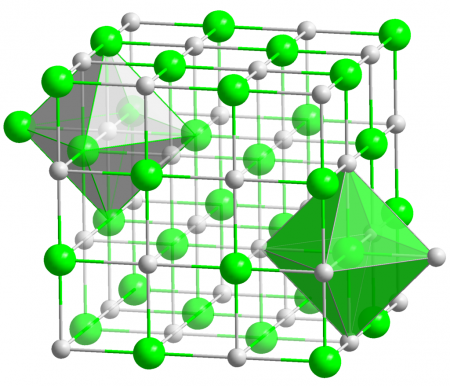
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):

Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Хлорид Серебра (свойства реакции применение FAQ)
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit) фото, синоним — роговая серебряная обманка.
Основное применение хлорида серебра в производстве некоторых органических веществ, лекарственных препаратов, светочувствительных компонентов и т.д.

Что такое хлорид серебра (AgCl)
Это белый порошок который на свету темнеет становясь серым , при нагревании плавится становясь жёлто — коричневым , при дальнейшем нагревании кипит без разложения.
Не растворим в воде и не образует кристаллогидратов. С концентрированными гидратом аммиака , образуя комплексное соединение.

Температура плавления — 455°C
Температура кипения — 1554°C
Состояние — Твёрдое
Молярная масса — 143,32г/моль
Плотность -5,56
Твёрдость -2,5
Получение в лабораторных условиях
Реакцией всех растворимых солей серебра с соляной кислотой :
Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Хлорид серебра обладает слабыми свойствами фотолиза и медленно разлагается на свету на простые вещества серебро и хлор :
При температуре выше 450°C в присутствии щелочей разлагается получением простого вещества серебра , хлорида щелочного металла и кислорода :
4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание до температуры свыше 850°C приводит к получению свободного вещества серебра , хлорида натрия , углекислого газа и кислорода :

Нагревание хлорида натрия с оксидом бария при температуре выше 330°C приводит к свободному серебру хлориду бария и кислороду :
4AgCl + 2BaO = 2BaCl2 + 4Ag + O2
Реакция с перекисью водорода , гидроксида калия ( разб . ) даёт свободное вещество серебро , хлорид калия и кислород :
С сульфидом натрия натрия при нагревании , получается сульфид серебра и хлорид натрия :
Фтор будучи более сильным галогеном чем хлор вытесняет его , образуя фторид серебра и хлор :

C концентрированным водным раствором аммиака образует комплексное соединение хлорид аммиакат серебра :
Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
Реакция с тиосульфатом натрия ( конц .) даёт комплексное соединение бис(тиосульфато)аргентат(I) и хлорид натрия :
Хлорид серебра реагирует солями цианидов ( конц .) образуя комплексные соединения и хлорид калия :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Минерал хлорид серебра
Это минерал хлораргирит химический состав: Ag — 75,3%, Сl — 24,7%. В качестве примесей иногда присутствует Hg (Br, Cl).
В свежих образцах бесцветный, прибывание на свету окрашивает его вначале фиолетово-серый, а потом даже черный цвет.
Образуется в зоне окисления серебросодержащих месторождений, где ассоциирует с минералами серебра, меди, кальцитом, баритом и др.
Используется как руда в получении серебра и иногда как сопутствующие с ним вещества ртуть и бром.
Применение хлорида серебра
- В фотографической промышленности для получения светочувствительных компонентов.
- В производстве некоторых косметических средств на основе ионов серебра , борющихся с проблемной кожей в основном у молодёжи.
- Хлорид серебра используется в производстве лекарственных препараторов .
- В гомеопатии используется как материал с антибактериальными свойствами .
- Использование в производстве материала для линз в ИК — спектроскопии .
- Как промежуточный продукт в производстве серебра из руд содержащих сульфид серебра Ag2S .
- Применяется в производстве серебро органических соединений, например ацетиленид серебра и т.д.
Что мы узнали о хлориде серебра?
- Что такое хлорид серебра
Это химическое соединение в состав которого входит серебро и хлор.
Какого цвета осадок хлорида серебра
Хлорид серебра (I) в расплавленном виде, имеет желто–коричневый цвет. Расплав хлорида серебра (I) после остывания, образует полупрозрачную массу, которая в обиходной речи, иногда называется как — «роговое серебро».
Как из AgCl получить серебро
Для этого нужно прореагировать его с перекисью водорода в присутствии гидроксида калия.
Есть минерал в состав которого входит хлорид серебра
Это минерал называется хлораргирит, в его химическую формулу могут входить и другие химические элементы такие как ртуть и бром
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Полное ионное уравнение с образованием осадка хлорида серебра AgCl
Ионные уравнения – результат химического взаимодействия катионов и анионов. С их помощью расписывают реакции замещения и обмена.
Характеристика ионных реакций
Ионные уравнения обладают рядом особенных характеристик.
- Валентности ионов не меняются в ходе реакции.
- В ходе реакции должны образоваться плохорастворимый осадок, газ или слабый электролит.
Если исходные и образовавшиеся вещества – это растворимые соединения, то реакция обратима. Такие взаимодействия не идут до конца и, как правило, в химии используются редко. Обратимые реакции не расписывают как уравнения ионного обмена. Например, хлорид натрия NaCl и нитрат калия KNO3 – растворимые соединения, в результате взаимодействия которых образуются растворимые соединения.
- молекулярное уравнение
- полное уравнение
Na + +Cl — +K + +NO3 — ⇄Na + +NO3 — +K + +Cl —
- краткое уравнение
Чтобы расписать краткое уравнение, нужно вычеркнуть одинаковые ионы в обеих частях уравнения. Например, справа есть ион Na + и слева есть ион Na + , поэтому оба иона вычеркиваются. В данном случае вычеркиваются все ионы.
Если в результате реакции образуются газ, плохорастворимый осадок или слабый электролит, то реакция необратима.
- Газов в природе немного, поэтому химики их запоминают: H2, N2, O2, F2, Cl2, инертные газы (VIII группа в периодической таблице Д.И. Менделеева), все водородные соединения неметаллов, несколько оксидов углерода, азота, серы. В реакциях газы обозначаются стрелкой вверх ↑.
- Осадки – нерастворимые соединения, которые определяют с помощью таблицы растворимости. Осадки обозначаются стрелкой вниз ↓.
- Чтобы определить силу электролита, необходимо вычислить степень диссоциации по формуле:
Если степень диссоциации меньше 3 %, то такие электролиты называют слабыми. К слабым электролитам относится вода, слабые и органические кислоты, нерастворимые основания.
Для необратимых реакций расписывают ионные уравнения.
Необратимое ионное уравнение
На практике, как правило, проводят именно необратимые реакции.
Источник: all-equa.ru