При решении задач на материал этой главы к формулам, которыми мы пользовались в предыдущих двух главах, необходимо добавить закон электролиза в форме (3.5.6) или (3.5.8). Кроме того, надо четко представлять себе природу электрического тока в различных средах.
Металлический прямоугольный параллелепипед ребра которого имеют длину d, b, с (d^> с; с), движется с ускорением а в направлении, параллельном меньшему ребру (рис.
3.63). Найдите на-пряженность электрического поля, возникающего вследствие ускоренного движения металлического бруска, а также поверхностную плотность электрических зарядов на боковых гранях бруска, перпендикулярных направлению ускорения.
Решение. При ускоренном движении бруска свободные электроны «отстают» и накапливаются на задней его грани. В результате задняя грань заряжается отрицательно, а передняя — положительно, и между этими гранями внутри бруска возникает электрическое поле.
Перераспределение свободных электронов внутри бруска закончится тогда, когда возникшее электрическое поле будет в состоянии сообщать электронам ускорение а. Напряженность Е поля внутри бруска при этом достигнет максимального значения.
Электролиз. Законы Фарадея. Задачи
Согласно второму закону Ньютона
где т не — масса и заряд электрона. Отсюда
Поверхностную плотность электрических зарядов на передней и задней гранях найдем из формулы напряженности поля между обкладками плоского конденсатора
В электролитической ванне происходит покрытие детали никелем. Зная напряжение U между электродами, удельное сопротивление раствора электролита р, расстояние I между электродами, найдите скорость покрытия (т. е. скорость увеличения толщины h слоя никеля). Электрохимический эквивалент никеля k, плотность никеля — рн.
Согласно закону электролиза
m = kIAt. (3.21.1)? Масса никеля, выделившегося при электролизе,
где S — площадь поверхности покрываемой никелем детали. Сила тока в растворе электролита, согласно закону Ома,
где R = р ^ . Отсюда
Подставляя выражение для массы (3.21.2) и силы тока (3.21.3) в соотношение (3.21.1), получим:
Решение. По закону Ома искомое падение напряжения U = где I — сила тока в цепи. Ток одинаков во всех сечениях три конденсатора. На положительную пластину этот ток обусловлен только отрицательными ионами, а на отрицательную — только положительными. Через произвольное сечение внутри конденсатора проходит некоторая доля как положительных, так и отрицательных ионов.
К источнику высокого напряжения через резистор сопротивлением R = 103 Ом подключен конденсатор емкостью С = = 10″11 Ф с расстоянием между пластинами d = 3 мм (рис. 3.64). Воздух в пространстве между пластинами конденсатора ионизуется рентгеновскими лучами так, что в 1 см3 ежесекундно образуется п = 104 пар ионов. Заряд каждого иона равен по модулю заряду электрона. Найдите падение напряжения на резисторе R, считая, что все ионы достигают пластин конденсатора, не успевая рекомбинировать.
Сила тока I = enSd, где е — заряд электрона, a S — площадь пластин. Из формулы для емкости плоского конденсатора
При электролизе 2,5 М (ρ=1,25 г/мл) раствора Сu(NO3)2 выделилось 44,8 л (н.у.)
находим: Следовательно 2
1,6 • ю-11 в. Задача 4
Вычислите чувствительность электронно-лучевой трубки к напряжению, т. е. значение отклонения пятна на экране, вызванного разностью потенциалов на управляющих пластинах в1В. Длина управляющих пластин Z, расстояние между ними d, расстояние от конца пластин до экрана L и ускоряющая разность потенциалов UQ.
Решение. На рисунке 3.65 схематически изображены управляющие пластины A vs. В трубки, экран MN и траектория электрона ОС.
Начало системы координат находится в точке О.
При движении между пластинами в направлении оси Y
электрон находится под действием силы F = е^, где U — разность потенциалов между пластинами Л и В. Эта сила сообща-
ет электрону ускорение a — — = . Здесь m — масса электрона.
Расстояние l вдоль оси X электрон проходит за время t^ — — ;
vx — проекция скорости электрона на ось X, определяемая из
условия —g— = eU0. За время электрон отклоняется в направ-лении оси У на величину
at eUl2 У і = — = 2 •
Движение электрона вне пластин происходит с постоянной
скоростью в течение времени І2 — — .
Проекция скорости на ось Y равна vy = atv Отклонение в области вне пластин
, eUlil , r У = Ух+У2= 2 12 + L ) ~
Концентрация электронов проводимости в германии при комнатной температуре пе = 3 • 1019 м-3. Какую часть это число составляет от общего числа атомов? Плотность германия р = 5400 кг/м3, молярная масса германия М = 0,073 кг/моль. Во сколько раз увеличится концентрация электронов проводимости при введении в германий примеси мышьяка, составляющей по массе р = 10_5% ? Молярные массы мышьяка и германия считать одинаковыми.
Решение. Число атомов германия определяется по формуле
Следовательно, концентрация атомов германия
Концентрация электронов проводимости примеси мышьяка П1 = nAs + Пе-
а общая концентрация электронов проводимости Отсюда +1«150.
пе Мпе 1. Концентрация электронов проводимости возросла в 150 раз. Упражнение 7
Сплошной металлический цилиндр радиусом R вращается с постоянной угловой скоростью со.
Найдите зависимость напряженности возникающего поля от расстояния г до оси цилиндра и разность потенциалов между поверхностью цилиндра и осью.
С какой частотой п следует вращать металлический диск радиусом R = 25 м (рис. 3.66), чтобы можно было обнаружить разность потенциалов между осью и краем диска, возникшую при его вращении? Чувствительность гальванометра U = Ю-5 В/дел. Отношение за-
ряда электрона к его массе — = = 1,76 • 1011 Кл/кг. Рис. 3.66
Один полюс источника тока к электрической лампочке присоединили медным проводом, а другой полюс — алюми-ниевым проводом; диаметры проводов одинаковые. Сравните скорости упорядоченного движения электронов в подводящих проводах, считая, что на каждый атом приходится один электрон проводимости. Плотности алюминия и меди соответственно равны 2,7 • 103 кг/м3 и 8,9 • 103 кг/м3, их относительные атомные массы 27 и 64.
При электролизе раствора серной кислоты за время t = = 50 мин выделился водород массой т = 3 • Ю-4 кг. Определите количество теплоты, выделившееся при этом в растворе электролита, если его сопротивление R = 0,4 Ом, а электрохимический эквивалент водорода k = Ю-8 кг/Кл.
Три электролитические ванны соединены так, как показано на рисунке 3.67. В двух из них имеется раствор AgN03, а в третьей — раствор CuS04. Сколько серебра выделилось в первой ванне, если во второй выделилось т2 = 60,4 мг серебра, а в третьей — т3 = 41,5 мг меди? Электрохими-ческий эквивалент серебра kc = 1,118 мг/Кл, меди — feM = 0,329 мг/Кл.
Чему равна масса серебра, выделившегося за 1 ч при электролизе раствора AgN03? Сопротивление раствора
электролита 1,2 Ом, напряжение на зажимах ванны 1,5 В, а электродвижущая сила поляризации 0,8 В.
При электролизе положительные и отрицательные ионы непрерывно нейтрализуются на соответствующих элект-
родах. Почему концентрация ионов в растворах электро-литов поддерживается на постоянном уровне? В каких участках раствора происходит пополнение убыли ионов?
Полная плотность тока в растворах электролитов опреде-ляется как сумма плотностей двух токов — плотности тока положительных ионов и плотности тока отрицательных ионов:
где е — модуль заряда иона, пи и с соответствующими индексами — концентрации и скорости положительных и отрицательных ионов.
Почему же масса вещества, выделившегося, к примеру, на катоде, считается пропорциональной полной плотности тока, а не плотности тока en+v+l
При никелировании детали в течение 2 ч на ней отложился слой никеля толщиной d = 0,03 мм. Электрохимический эквивалент никеля k = 3 • 10~7 кг/Кл. Плотность никеля р = 8,9 • 103 кг/м3. Определите плотность тока при электролизе.
При электролизе за 20 мин при силе тока 2,5 А на катоде выделилось 1017 мг двухвалентного металла. Какова его относительная атомная масса? «г
Сколько пар ионов возникает ежесекундно под действием ионизатора в 1 см3 газоразрядной трубки, в которой течет ток насыщения 4 • Ю-8 мА? Площадь каждого плоского электрода равна 1 дм2, а расстояние между ними 5 мм. Считать, что заряд каждого иона равен заряду электрона.
При какой напряженности поля начнется самостоятельный разряд в воздухе, если энергия ионизации молекул равна 2,4 • 10~18 Дж, а средняя длина свободного пробега 4 мкм? Какова скорость электронов при столкновении с молекулой? К электростатической машине подключены соединенные параллельно лейденская банка и разрядник. Сила тока электростатической машины I = 10~5 А. Емкость лейденской банки С = 10~8 Ф. Чтобы произошел искровой разряд, машина должна работать t = 30 с. Длительность раз- ряда т = 10 6 с. Определите среднюю силу разрядного тока I и напряжение зажигания искрового разряда С/ .
Что произойдет с горящей электрической дугой, если сильно охладить «отрицательный» уголь; «положительный» уголь?
Между нитью накала, испускаю- ~ щей электроны, и проводящим кольцом создана разность потенциалов U (рис. 3.68). Электроны _ движутся ускоренно вдоль оси кольца. При этом их кинетическая энергия увеличивается, в то время как батарея, создающая разность потенциалов U, не совершает работы, так как ток в цепи не идет.
(Предполагается, что электроны не попадают на кольцо.) Как это согласовать с законом сохранения энергии?
Три одинаковых диода, анодные характеристики которых могут быть приближенно представлены отрезками прямых:
где k = 0,12 мА/В, включены в цепь, как показано на рисунке 3.69.
Начертите график зависимости силы тока I в цепи от напряжения U, если ft = 2 В, ft = 5 В, ft = 7 В, a U может меняться от —10 до +10 В.
Триод прямого накала включен в цепь (рис. 3.70). ЭДС анодной батареи = 80 В, батареи накала ё2 = 6 В и сеточной батареи ?3 = 2 В. С какими энергиями электроны будут достигать анода лампы? Как изменится энергия электронов, достигающих анода, если ЭДС ?3 будет изменяться по модулю или даже переменит знак? Анодный ток считать малым по сравнению с током накала.
В электронно-лучевой трубке поток электронов с кинетической энергией Wk = 1,28 • Ю-15 Дж движется между вертикально отклоняющими пластинами плоского конденсатора длиной I = 4 см. Расстояние между пластинами d = 2 см, а разность потенциалов между ними U = 3,2 кВ. Найдите вертикальное смещение у электронного пучка на выходе из пространства между пластинами.
Пучок электронов, ускоренных в поле с разностью потен-циалов U = 300 В, влетает в плоский конденсатор парал-лельно его пластинам; пластины расположены горизон-тально. Найдите разность потенциалов Uv приложенную к пластинам конденсатора, если пучок смещается на экране на расстояние h — 3,6 см. Длина пластин конденсатора I — 4 см, расстояние от конца конденсатора до экрана
= 10 см, расстояние между пластинами конденсатора d = 1,2 см.
Пучок электронов влетает в конденсатор параллельно его пластинам со скоростью vQ. Конденсатор включен в цепь, как показано на рисунке 3.71. ЭДС источника тока 6, его внутреннее сопротивление г, длина пластин конденсатора I и расстояние между ними d считаются известными величинами. Резистор какого сопротивления R надо подсоеди-
800 600 400 200
-400 -300 -200 -100 о
0,4 0,8 jjt в -0,4 2. Рис. 3.72
нить параллельно конденсатору, чтобы пучок электронов вылетел из него под углом а к пластинам?
Сколько процентов (по массе) индия необходимо ввести в германий, чтобы концентрация дырок была nIn = 1022 м-3? Концентрацию собственных свободных носителей заряда в германии считать пренебрежимо малой. Молярная масса индия AfIn = 0,115 кг/моль. Плотность германия pGe =
Получится ли р—га-переход, если вплавить олово в германий или кремний?
Какая часть вольт-амперной характеристики германиевого диода (рис 3.72) отражает зависимость силы тока от на-пряжения в пропускном направлении? Какая — в запи-рающем направлении? Найдите внутреннее сопротивление диода при прямом напряжении 0,4 В и при обратном напряжении 400 В.?
Источник: scicenter.online
помогите пожалуйста
1 Определите массу серебра, выделившегося на катоде при электролизе,
азотнокислого серебра за 2 часа, если к раствору приложено напряжение 2 В,
а его сопротивление 5 Ом.
1 задача
Дано:
t = 2 ч = 7200 c
U = 2 В
R = 5 Ом
k = 1,118·10⁻⁶ кг/Кл
____________
m — ?
Сила тока при электролизе:
I = U / R = 2/5 = 0,4 А
Масса выделившегося серебра:
m = k·I·t = 1,118·10⁻⁶ · 0,4 · 7200 ≈ 3,2·10⁻³ кг или 3,2 г
Электрической дугой можно осуществлять сварку и резку металлов под водой, что имеет большое значение при судоремонтных работах, ликвидации аварий и подъеме затонувших судов, восстановлении и разборке обрушившихся мостов и т. д.
Источник: sous-otvet.net
Электролиз. Пример 1.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч
Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч. при силе тока 4А?
Решение. Согласно законам Фарадея
m = ЭIt /96500, (1)
где т — масса вещества, окисленного или восстановленного на электроде; Э — молярная масса эквивалента вещества; I — сила тока, A; t — продолжительность электролиза, с.
Молярная масса эквивалентов меди в CuSO4 равна 63,54: 2 = =31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4 А, t= 60 ∙ 60 = 3600 с, получим
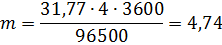
Пример 2. Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Подставляя в формулу (1) числовые значения, получаем
Э = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)
I = m 96500/Эt
Так как дан объем водорода, то отношение т/Э заменяем отношением VH; /VЭ(Н 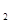 ), где V H
), где V H 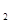 — объем водорода, л.; VЭ(Н
— объем водорода, л.; VЭ(Н 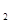 ) объем эквивалентной массы водорода, л. Тогда
) объем эквивалентной массы водорода, л. Тогда
I = VH 96500/ VЭ(Н ).
Объем эквивалентной массы водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VН = 1,4 л, VЭ(Н ) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025 с), находим
I = 1,4∙96,500/(11.2∙6025) = 2А
Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Объем эквивалентной массы кислорода (н.у.) 22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 ∙ 2 = 112,22 г (56,11 г/моль — молярная и эквивалентная масса КОН).
8.3.Коррозия металлов
При решении задач этого раздела см. табл. 8.
Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате их химического или электрохимического взаимодействия с окружающей средой.
При электрохимической коррозии на поверхности металлаодновременно протекают два процесса: анодный — окисление металла
Ме°-пе=Ме п+ и катодный — восстановление ионов водорода
или молекул кислорода, растворенного в воде,
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород [1].
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Zn°-2e — =Zn 2+ катодный процесс:
в кислой среде 2Н + + 2е — = Н2
в нейтральной среде ½ О2 + Н2О + 2е — = 2ОН —
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru