Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.
Молярная масса. 8 класс.

Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс.
Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12 C).

Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16.
Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.

Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль.
Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12 С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 10 23 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы.
Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.

Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен.
Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.

Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
Источник: fb.ru
Чему равна молярная масса серебра?
У нас есть 20 ответов на вопрос Чему равна молярная масса серебра? Скорее всего, этого будет достаточно, чтобы вы получили ответ на ваш вопрос.
Содержание
- Сколько весит 1 моль серебра?
- Чему равна молярная масса меди?
- Как найти молярную массу с примерами?
- Как вычислить моль молярная масса?
- Какая масса у Купрума?
- Чему равна молярная масса серебра? Ответы пользователей
- Чему равна молярная масса серебра? Видео-ответы
Отвечает Алексей Половинкин
Молярная масса серебра равна 107,8682 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и .
Сколько весит 1 моль серебра?
Молярная масса серебра равна 107,8682 г/моль. Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Чему равна молярная масса меди?
63,546 а. е. м.Медь / Атомная масса
Как найти молярную массу с примерами?
Молярная масса вещества равна сумме молярных масс элементов, входящих в состав его молекул. Например, молярная масса метана CH4 определяется следующим образом: М(CH4) = M(C) + 4·M(H) = 12 + 4 = 16 г/моль.
Как вычислить моль молярная масса?
Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль). Например, число молей в m г воды составляет: n = m/18. Для m г металлического натрия: n = m/23, и так далее.
Какая масса у Купрума?
63,546 а. е. м.Медь / Атомная масса
Источник: querybase.ru
Как определить молярную массу серебра
Порядковый номер – 47. Строение атома показано на рис. 1. Металл d-семейства.
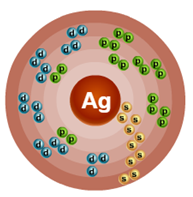
Рис. 1. Схема строения атома серебра.
В обычных условиях серебро представляет собой вещество белого цвета с гранецентрированной кубической решеткой. Металлу свойственна исключительная пластичность. Серебро значительно превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 10,5 г/см 3 . Температура плавления 961,2 o C, кипения 2170 o C.
Молярная масса серебра равна 107,8682 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Серебро не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет хмоль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
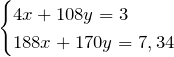
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя xможно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Молярная масса серебра
Молярная масса серебра.










Молярная масса серебра:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅10 23 моль −1 ).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12 C.
Молярную массу обозначают M.
Молярная масса серебра (M (Ag)) составляет 107,8682(2) г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Молярная масса и другие характеристики серебра
Серебро — это химический элемент, который обозначается символом Ag. Атомный номер — 47. Точная молярная масса серебра составляет 107,8682(2) а. е. м. (г/моль). Этот металл мягкий, белый и блестящий. Обладает самой высокой электропроводностью, теплопроводностью и отражательной способностью из всех металлов.
В природе встречается в чистом виде (самородное серебро), в виде сплава с золотом и другими металлами, а также в минералах (например, в аргентите).
В основном производится в качестве побочного продукта от переработки меди, золота, свинца и цинка.Серебро еще с древнейших времен ценится как драгоценный металл. Он более распространенный, чем золото, и поэтому его часто использовали в качестве материала для изготовления монет. В современном мире серебро применяется во многих отраслях. Ниже перечислены самые известные способы его использования.
Монеты и украшения
Электрум (так называют сплав золота и серебра) начали использовать для чеканки монет еще около 700 лет до нашей эры. Позже этот металл стали применять в чистом виде. Многие народности использовали серебро в качестве основной денежной единицы. Например, валюта «фунты стерлингов» (£) получила свое название потому, что означала стоимость одного фунта серебра. Другие исторические валюты, такие как французский ливр, имеют сходную этимологию.
В XIX веке были открыты крупные месторождения этого драгоценного металла в Северной и Южной Америке. Опасаясь резкого снижения стоимости серебра, большинство государств к 1900 году перешли на золотой стандарт. В некоторых языках, среди которых санскрит, иврит, испанский и французский, понятия «деньги» и «серебро» эквивалентны одному слову.
Серебряные монеты до сих пор чеканятся в некоторых странах как памятные и коллекционные предметы. Обычно они не входят в общую валютную циркуляцию, но известны некоторые исключения. Например, в американском штате Юта серебро до сих пор считается легальным платежным средством. Серебряные монеты и слитки также используются в качестве инвестиций для защиты от инфляции и девальвации.
Относительно небольшая молярная масса данного металла благоприятно сказывается на фактической массе ювелирных изделий из него. Например, ожерелья не вызывают ощущения тяжести и дискомфорта у тех, кто их носит. Украшения традиционно изготавливаются из стерлингового (стандартного) серебра. Этот сплав состоит из 92,5% серебра и 7,5% меди.
Стерлинговое серебро более твердое и имеет более низкую температуру плавления по сравнению с чистым серебром или чистой медью. В США настоящим признают сплав, в котором не более 10% меди.
В Великобритании признаком качества считается сплав, состоящий из серебра на 95,8%. Ювелиры, которые специализируются на этом металле, обычно работают и с другими: золотом, медью, сталью, латунью. Они производят ювелирные изделия, столовые приборы, подсвечники, вазы и другие художественные элементы.
Серебро и его характеристики
Общая характеристика серебра
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих руд получают около 80% всего добываемого серебра.
Чистое серебро – очень мягкий, тягучий металл (рис. 1), оно лучше всех металлов проводит теплоту и электрический ток.
Серебро – малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов – результат образования на поверхности черного сульфида серебра Ag2S.

Рис. 1. Серебро. Внешний вид.
Атомная и молекулярная масса серебра
Поскольку в свободном состоянии серебро существует в виде одноатомных молекул Ag, значения его атомной и молекулярной масс совпадают. Они равны 107,8682.
Изотопы серебра
Известно, что в природе серебро может находиться в виде двух стабильных изотопов 107 Ag и 109 Ag. Их массовые числа равны 107 и 109 соответственно. Ядро атома изотопа серебра 107 Ag содержит сорок семь протонов и шестьдесят нейтронов, а изотопа 109 Ag – такое число протонов и шестьдесят два нейтрона.
Существуют искусственные нестабильные изотопы серебра с массовыми числами от 93-х до 130-ти, а также тридцать шесть изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 104 Ag с периодом полураспада равным 69,2 минуты.
Ионы серебра
На внешнем энергетическом уровне атома серебра имеется один электрон, который является валентным:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 9 5s 2 .
В результате химического взаимодействия серебро отдает свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
Молекула и атом серебра
В свободном состоянии серебро существует в виде одноатомных молекул Ag. Приведем некоторые свойства, характеризующие атом и молекулу серебра:
Энергия ионизации атома, кДж/моль
Сплавы серебра
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18 г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет х моль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
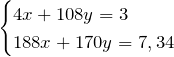
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя x можно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Источник: ollimpia.ru