
Честно скажу, для меня незаменимым средством на кухне является сода. Ее и в еду, и ей же потом от еды все отчищаю))) В данном случае покажу как отчистить дно кастрюли.

У каждой хозяйки наверняка где-то на кухне хранится «бабушкина» чугунная посуда! Тот чугун, который можно купить сейчас, не сравнится с тем качеством, которое было раньше. Но как готовить вкусные блюда, когда посуда покрыта неотмываемым подгоревшим слоем жира? И возможно ли дать любимой кастрюльке вторую жизнь? Выход есть!
С этим способом ваша старая любимая посуда будет как новая!

Натрия тиосульфат. Детокс. Очищение организма мой личный опыт.
Химические свойства
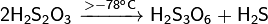
Если прокипятить водный раствор сульфита натрия с серой и, отфильтровав излишек серы, оставить охлаждаться, то из раствора выделяются бесцветные прозрачные кристаллы нового вещества, состав которого выражается формулой. Это вещество — натриевая соль тиосерной кислоты.
Тиосерная кислота неустойчива. Уже при комнатной температуре она распадается. Значительно устойчивее ее соли — тиосульфаты. Из них наиболее употребителен тиосульфат натрия, известный также под неправильным названием «гипосульфит».
При добавлении к раствору тиосульфата натрия какой-нибудь кислоты, например соляной, появляется запах диоксида серы и через некоторое время жидкость становится мутной от выделившейся серы.
Изучение свойств тиосульфата натрия приводит к выводу, что атомы серы, входящие в его состав, имеют различную окисленность: у одного из них степень окисленности +4, у другого 0. Тиосульфат натрия — восстановитель. Хлор, бром и другие сильные окислители окисляют его до серной кислоты или до ее соли.
Тиосульфа?ты — соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфат натрия и тиосульфат аммония.
Строение. Структура тиосульфат-иона
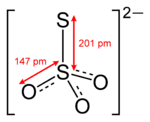
Тиосульфат-ион по строению близок к сульфат-иону. В тетраэдре [SO3S]2− связь S-S (1.97А) длиннее, чем связи S-O
Тиосульфат натрия можно отнести к довольно нестойким веществам. Тиосульфат натрия при нагревании до 220°C распадается: В реакции термического разложения тиосульфата натрия получаем полисульфида натрия, который также далее разлагается на сульфид натрия и элементарную серу. Взаимодействие с кислотами: выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается: В такую же реакцию будет вступать и соляная и азотная кислоты. Разложение сопровождается выделением, который имеет неприятный запах.
Окислительно-восстановительные свойства тиосульфата натрия: в связи с наличием атомов серы со степенью окисления 0 ион тиосульфата обладает восстановительными свойствами, например, слабыми окислителями (I2, Fe3+) тиосульфат окисляется до иона тетратионата: В щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
А более сильные окислители окисляют его до иона сульфата:
Сильными восстановителями ион восстанавливается до производных S2-: В зависимости от условий, тиосульфат натрия может проявлять как окислительные, так и восстановительные свойства.
Комплексообразующие свойства тиосульфатов:
Тиосульфат-ион – сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра: Металлами S2O32- ион координируется через атом серы, поэтому тиосульфатные комплексы легко превращаются в соответствующие сульфиды.
Применение тиосульфата натрия
Тиосульфат натрия довольно широко применяется как в быту так и в промышленности. Основными областями применения тиосульфата натрия будут медицина, текстильная и горнорудная промышленность, фотография.
Тиосульфат натрия в текстильной и бумажной промышленности используется для удаления следов хлора после отбеливания тканей и бумаги, при производстве кожи его используют в качестве восстановителя хромовой кислоты.
В горной промышленности тиосульфат натрия применяют для извлечения серебра из руд с низкой концентрацией серебра. Комплексные соединения серебра с тиосульфатами являются довольно стабильными, во всяком случае более стабильными чем комплексные соединения с фтором, хлором, бромидами, роданидами. Поэтому выделение серебра в виде растворимого комплексного соединения состава или является промышленно выгодной. Ведутся работы по применению при извлечении золота. Но в данном случае константа нестойкости комплексного соединения значительно выше и комплексы менее стабильны по сравнению с серебряными.
Первым применением тиосульфата натрия была медицина. И до сего времени не потерял своего значения в медицине. Правда, для лечения многих заболеваний уже найдены другие, более эффективные лекарства, поэтому тиосульфат натрия начали более широко использовать в ветеринарии. Тиосульфат натрия в медицине используют в качестве антидота при отравлении мышьяком, ртутью и другими тяжёлыми металлами, цианидами (переводит их в роданиды):
Как было сказано выше тиосульфат-ион создает стабильные комплексные соединения с многими металлами, среди которых много токсичных тяжелых металлов. Созданные комплексные соединения являются малотоксичными в выводятся из организма. На этой особенности тиосульфата натрия и основано его применение в токсикологии и лечении отравлений.
Также тиосульфат натрия используют для дезинфекции кишечника при пищевых отравлениях, для лечения чесотки (совместно с соляной кислотой), как противовоспалительное и противоожоговое средство.
Тиосульфат натрия широко используют в аналитической химии, поскольку он является реактивом в иодометрии. Иодометрия является одним из методов количественного определения концентраций веществ и для определения концентрации иода используют окислительно-восстановительную реакцию с тиосульфатом натрия:
И последним довольно распространенным применением тиосульфата натрия является его использование в качестве фиксажа в фотографии. И хотя обычная черно-белая фотография уже уступила место цветной и обычная фотопленка используется довольно редко, во многом уступая цифровой фиксации изображения, есть довольно много мест, где до сих пор используют фотопластины и фотопленку. В качестве примера можно привести рентгеновские аппараты, как медицинского применения, так и промышленные, научную аппаратуру, фототелескопы.
Для того, чтобы мы получили фотографическое изображение достаточно, чтобы проявилось около 25% бромистого серебра в фотопленке. А вся остальная его часть остается в фотопленке и сохраняет свою светочувствительность. Если фотопленку после проявления вынести на свет, то не проявленное галогенное серебро, которое осталось в ней проявится проявителем и негатив потемнеет. Даже если весь проявитель будет вымыт, то на свету негатив, так или иначе, потемнеет из-за разложения галогенида серебра.
Чтобы сохранить изображение на пленке, не проявленное галогенное серебро из нее надо удалить. Для этого используют процесс фиксации изображения, во время которого галогениды серебра переводят в растворимые соединения и вымывают из фотопленки или фотографии. Для фиксирования изображения и используют тиосульфат натрия.
В зависимости от концентрации тиосульфата натрия в растворе образовываются различные соединения. Если в растворе фиксажа содержится небольшое количество тиосульфата, то реакция протекает согласно уравнения:
Полученный тиосульфат серебра не растворим в воде, поэтому его сложно выделить из фотослоя, он довольно нестоек и разлагается с выделением серной кислоты:
Сульфид серебра зачерняет изображение и его невозможно удалить из фотослоя.
При наличии в растворе излишка тиосульфата натрия будут образовываться комплексные соли серебра:
Полученная комплексная соль — тиосульфатоаргентат натрия довольно стоек, но плохо растворим в воде.
При большом излишке тиосульфатов в растворе образуются сложные и хорошо растворимые в воде комплексные соли серебра:
На этих свойствах тиосульфата натрия и основано его применение в качестве фиксажа в фотографии.
Тетратноповая кислота принадлежит к группе политно новых кислот. Это двухосновные кислоты общей формулы, где может принимать значения от 2 до 6, а возможно и больше. Полнтионовые кислоты неустойчивы и известны лишь в водных растворах. Соли полнтиоиовых кислот — политионаты — более устойчивы; некоторые из них получены в виде кристаллов.
Политионовые кислоты — соединения серы с общей формулой H2SnO6, где n>=2. Их соли называются политионатами.
Тетратионат-ион можно получить окислением тиосульфат-иона иодом (реакция используется в иодометрии):
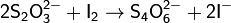
Пентатионат-ион получают действием SCl2 на тиосульфат-ион и из жидкости Вакенродера при добавлении к ней ацетата калия. Вначале выпадают призматические кристаллы тетратионата калия, затем — пластинчатые кристаллы пентатионата калия, из которого действием винной кислоты получают водный раствор пентатионовой кислоты.
Гексатионат калия K2S6O6 лучше всего синтезировать действием KNO2 на K2S2O3 в концентрированной HCl при низких температурах.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Как использовать серебряный тиосульфат?

магазин до 30 дней в холодильнике (лучше всего использовать свежие каждый раз). Хранить в темноте. STS можно хранить в холодильнике в течение месяца. Тем не менее, лучше, когда это сделано непосредственно перед использованием, так как он быстро окисляется.
Что делает серебряный тиосульфат для цветов?
серебряный тиосульфат использовался для продления срока службы вазы срезанных цветов, блокируя эффект этилена (Farnham et al., 1981; Veen and Van de Geijn, 1978). Подобное действие блокировки этилена STS, вероятно, ответственна за производство мужских цветов на женских конопляных растениях в нашем исследовании.
Является ли противоядие тиосульфата натрия?
Комбинация тиосульфата натрия и нитрита натрия использовалась в Соединенных Штатах с 1930 -х годов в качестве первичного противоядия для цианидной интоксикации .
Как вы идентифицируете тиосульфат?
ион тиосульфата содержит два атома серы, но они имеют разные числа окисления, 0 и +4 . Максимальное количество окисления серы составляет +6.
- kmno 4 снижается до mn 2 + катионов с помощью s 2 o 3 2 – в кислых растворах. …
- kmno 4 снижается до mno 2 с помощью s 2 o 3 2 – в щелочных решениях.
Как образуется тиосульфат натрия?
Формирование. Тиосульфат продуцируется реакцией сульфитного иона с элементной серой, и путем неполного окисления сульфидов (окисление пирита) тиосульфат натрия может образовываться путем диспропорции серы в гидроксиде натрия (аналогично фосфору).
реагирует ли серебро с нитратом серебра?
Синтез. Нитрат серебра может быть приготовлен с помощью реагирования серебра , таких как слитки серебра или серебряную фольгу, с азотной кислотой, что приводит к нитрату серебра, воде и оксидам азота. Побочные продукты реакции зависят от концентрации используемой азотной кислоты.
Токсично ли серебряный тиосульфат?
Комплекс тиосульфата с серебром серебра имеет низкую токсичность , который можно отнести к серебру, комплексному тиосульфатом. Серебряный нитрат является одним из самых токсичных серебряных соединений. Токсичный потенциал хлоридных комплексов серебра в морской воде является и будет важной проблемой для исследования.
Насколько дорого нитрат серебра?
о нитрате серебра
Нитрат серебра доступен только в виде общего препарата. Самая низкая цена GoodRX для наиболее распространенной версии общего серебряного нитрата составляет около 13,52 долл. США, 53% от средней розничной цены в 29,03 долл. США.
безопасно ли коллоидное серебро для растений?
коллоидное серебро по существу является чистой водой с ультра-плотными наночастицами серебра, подвешенных внутри. … Красота использования коллоидного серебра в саду заключается в том, что это очень безопасно для растений , но он целесообразно нацелен на бактерии, паразиты и другие патогены.
Advertisements
Как вы делаете и используете серебряные растворы тиосульфата?
Приготовьте A 0,02 м STS, медленно залив 20 мл раствора серебряного нитрата серебра в 80 мл 0,1 М раствора натрия тиосульфата . STS можно хранить в холодильнике до месяца. Однако, рекомендуется подготовка STS непосредственно перед использованием.
Семена от гермафродитной женщины?
Интересно, что все семена, собранные из гермафродитных цветов, производили женские растения , что не относится к семенам, которые поступают из перекрестных растений. Коммерческие культиваторы полагаются на черенки от женских материнских растений, поскольку они генетически идентичны материнскому растению и развивают только женские цветы.
Как превратить мужское растение в самку?
Можете ли вы повернуть мужскую растение? Пол растения определяется его генетикой еще до начала прорастания. С сексом генетически кодировано, невозможно сделать самцов растения самки или самка.
безопасно ли пить тиосульфат натрия?
Кристаллин тиосульфата натрия из химикатов TIB вносит важный вклад в здоровье и может быть растворен в воде или чае и используется в качестве напитка один раз в день.
Является ли тиосульфат натрия?
Приглашение: тиосульфат натрия является агентом с низким порядком токсичности . Прием больших доз может вызвать нарушения раздражения желудочно -кишечного тракта с тошнотой, рвотой, административными спаземами, диареей, метаболическим ацидозом и гипернатриемией.
Что делает тиосульфат натрия с цианидом?
тиосульфат натрия действует как донор сера для детоксикации цианида в тиоцианат ферментом родана, тогда как гидроксокобаламин связывает цианид и образует нетоксичный цианокобаламин, который выделяется почечным.
тиосульфат такой же, как тиосульфат натрия?
тиосульфат натрия (тиосульфат натрия) является неорганическим соединением с формулой Na 2 s 2 o 3 xh 2 o. … тиосульфат натрия используется в добыче золота, обработке воды, аналитической химии, разработке фотографической пленки и принтов на основе серебра, а также медицины.
в чем разница между сульфатом и тиосульфатом?
Как существительное. Разница между тиосульфатом и сульфатом
заключается в том, что тиосульфат является солью тиосульфуриновой кислоты , в то время как сульфат (органическая химия) любого эфира серной кислоты.
Ниже ли тиосульфат натрия?
Попробуйте тиосульфат натрия. … Проверьте рН бассейна после обработки тиосульфатом натрия. Химическая реакция с хлором и водой снижает общий рН бассейна , что может сделать его слишком кислым.
Как вы растворяете хлорид серебра?
Вопрос: В то время как хлорид серебра нерастворим в водном растворе, оно обнаруживается, что он растворим в водном растворе после добавления аммиака , тиосульфата натрия или цианида калия.
Источник: www.onsecrethunt.com