ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Периодическая система химических элементов
Универсальная таблица растворимости
кислот, солей и оснований в воде
Коллекция таблиц к урокам по химии
Информационные и справочноинструктивные
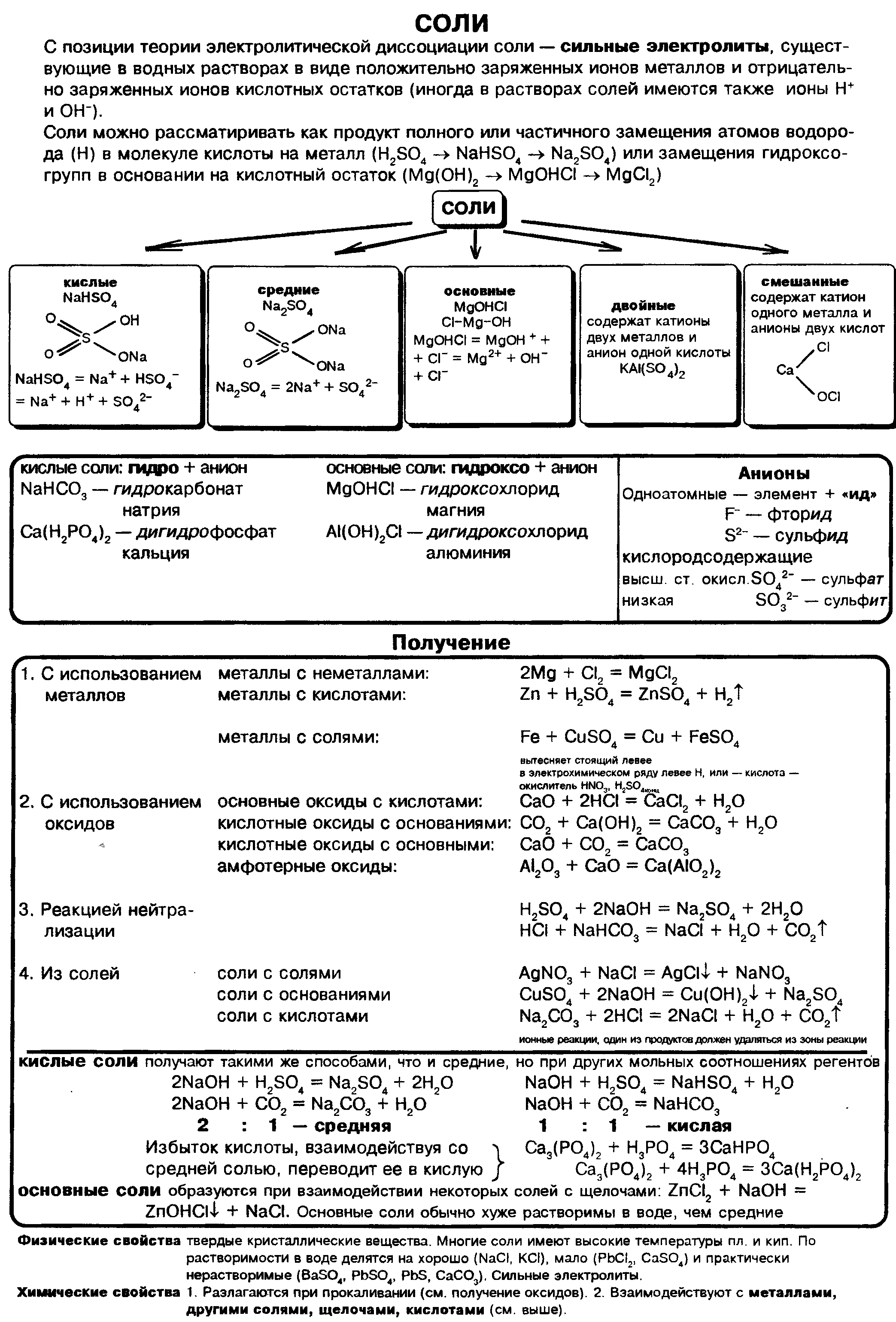
Соли: классификация, номенклатура, способы получения
«Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь»
А. Дистервег (немецкий педагог)
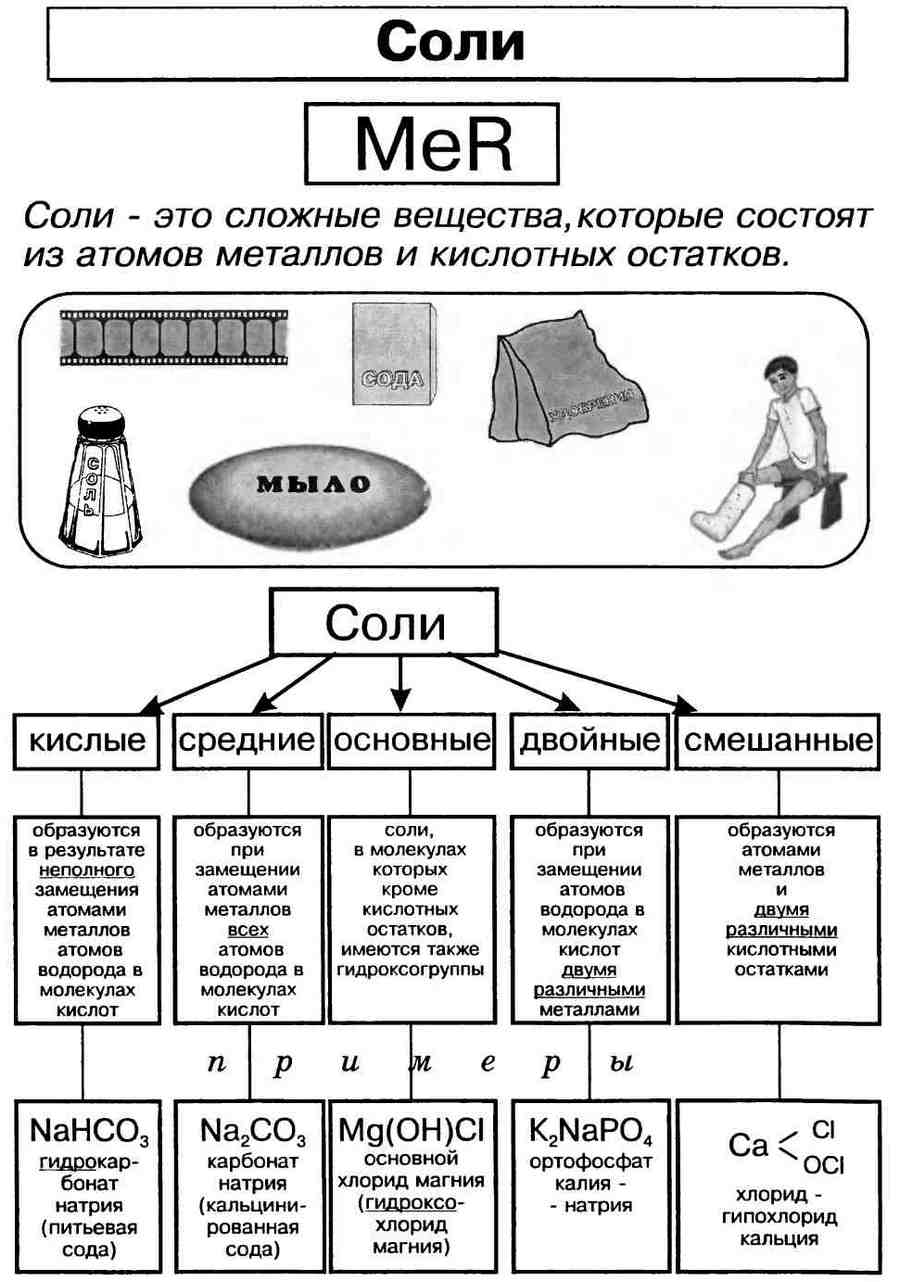
Что называют солью
Генетические ряды металла и неметалла завершает класс солей:

Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Как прёт наркотик соль? Какой кайф от солей с 3:50 мин.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете?
Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
Как видит мир человек под СОЛЬЮ? ALPHA PVP /Scammers
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са 2+ + 2НСО3 –
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.

Умягчение жёсткой воды проводят разными способами:
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
Средняя , или нормальная, соль образуется в результате полного замещения катионов водорода в кислоте на катионы металла.
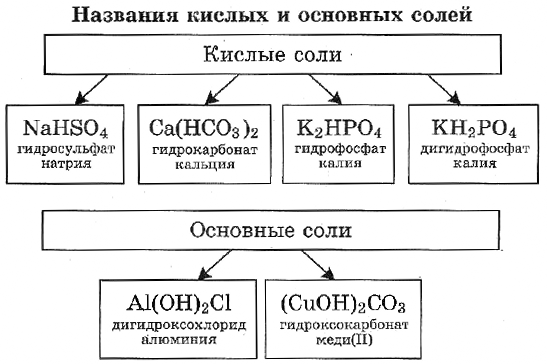
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
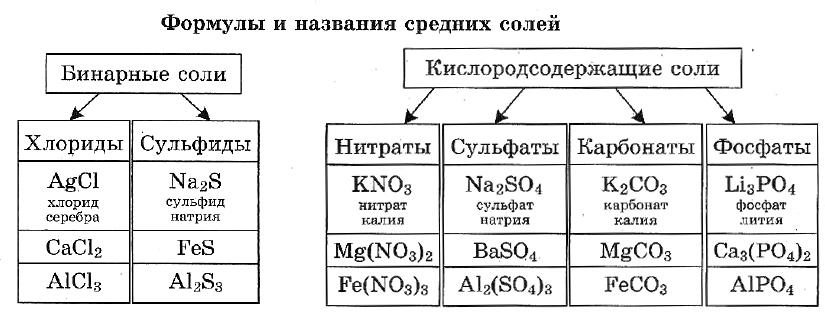
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Названия солей с центральным атомом в промежуточной степени окисления — S +4 , N +3 — содержат суффикс «-ит»: Na2SO3 — сульфит натрия, KNO2 — нитрит калия. Это соли сернистой и азотистой кислот.
Некоторые соли имеют свои традиционные (тривиальные) названия. Так, ряд солей серной кислоты называют купоросами: FeSO4 • 7Н2O — железный купорос, CuSO4 • 5Н2O — медный купорос, ZnSO4 • 7Н2O — цинковый купорос. Общее название нитратов натрия, калия, аммония, кальция и бария — селитры: NaNO3 — натриевая селитра, NH4NO3 — аммонийная селитра. Кроме того, К2СO3 — поташ, AgNO3 — ляпис, РЬСгO4 — желтый крон, Na2SO4 • 10Н2О — глауберова соль, NaCl — поваренная соль, Na2CO3 • 10Н2O — сода кристаллическая, CaSO4 • 2Н2O — гипс.
Общие химические свойства солей
- Соли взаимодействуют с кислотами при соблюдении некоторых условий.
- Соли взаимодействуют со щелочами при соблюдении некоторых условий.
- Растворы солей взаимодействуют с металлами (вспомните электрохимический ряд напряжений металлов и сформулируйте условия протекания таких реакций).
- Соли взаимодействуют с другими солями в растворах при соблюдении ряда условий.
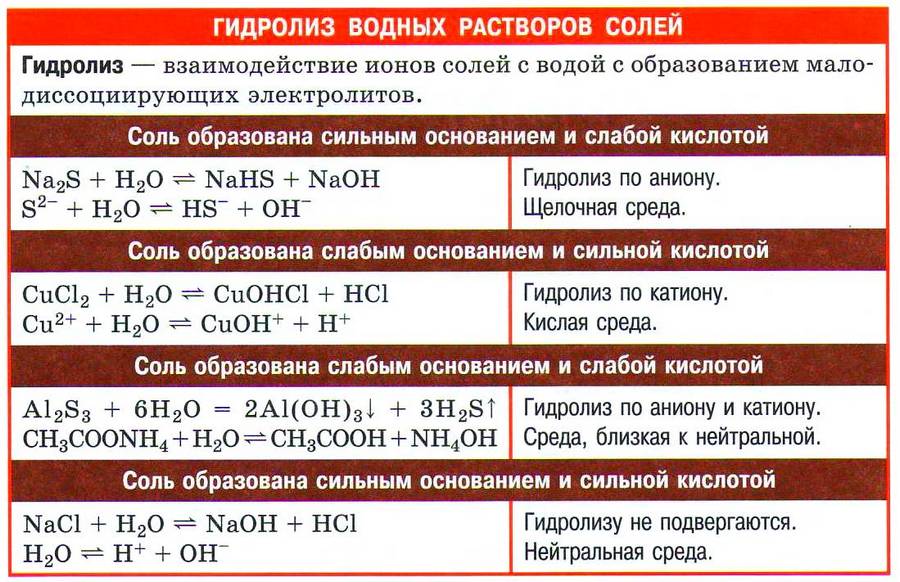
- Соли подвергаются гидролизу (вспомните случаи гидролиза солей).
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Источник: uchitel.pro
Химические свойства солей

Сложные неорганические соединения, образованные металлами и кислотными остатками, называются солями. Химические свойства солей позволяют получать различные соединения.
Виды
Общая формула солей –
где М – металл, Ac – кислотный остаток, n и m – количество атомов металла и кислотного остатка соответственно.
По составу и образованию соли делятся на шесть видов:
- средние(нормальные) – образуются путём полного замещения водорода в кислоте атомами металла или гидроксильной группы в основании кислотными остатками (Na3PO4 образован из H3PO4, CuSO4 – из Cu(OH)2, AlCl3 – из HCl);
- кислые– образуются при неполном замещении водорода в кислотах атомами металла (NaHSO4 образован при присоединении Na к H2SO4, Na2HPO4 – из H3PO4);
- основные– образуются при неполном замещении гидроксильных групп кислотными остатками (CaOHCl образован из Ca(OH)2, FeOHCl2 – из Fe(OH)3);
- двойные– состоят из двух металлов и одного кислотного остатка (КNaSO4);
- смешанные– состоят из одного металла и нескольких кислотных остатков (CaClBr);
- комплексные– состоят из комплексного аниона или катиона ([Cu(NH3)4]SO4).
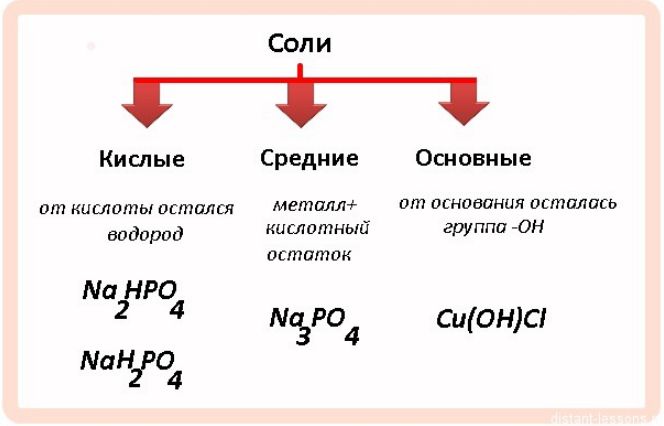
Наиболее активными являются кислые соли, включающие водород. Химические свойства кислых солей сходны со свойствами кислот. Они взаимодействуют с металлами, их оксидами и гидроксидами, другими солями, щелочами.
Физические свойства
Соли – это кристаллические вещества разных цветов.
Основные физические свойства солей:
- ионная кристаллическая решётка;
- высокие температуры плавления;
- в твёрдом состоянии плохо проводят электричество;
- по растворимости выделяют растворимые, малорастворимые и нерастворимые соли.
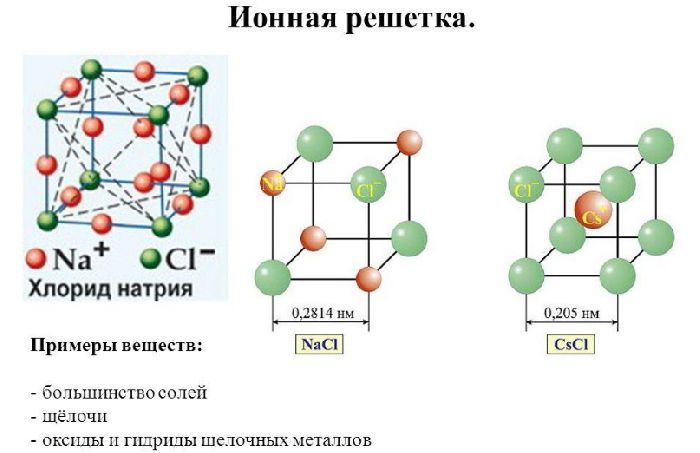
Некоторые соли имеют ковалентное или промежуточное, образованное ионными и ковалентными связями, строение.
Получение
-
с активными металлами –
2HCl + Zn → ZnCl2 + H2;
2HCl + CaO → CaCl2 + H2O;
HCl + NaOH → NaCl + H2O;
Основания могут взаимодействовать:
6KOH + 3S → K2SO3 + 2K2S + 3H2O;
2NaOH + CO2 → Na2CO3 + H2O;
2KOH + FeCl2 → Fe(OH)2 + 2KCl.
Существую также другие способы получения:
-
взаимодействие двух солей –
CuCl2 + Na2S → 2NaCl + CuS↓;
Fe + S → FeS
SO3 + Na2O → Na2SO4;
Fe + CuSO4 → FeSO4 + Cu.
Химические свойства
Растворимые соли являются электролитами и подвержены реакции диссоциации. При взаимодействии с водой они распадаются, т.е. диссоциируют на положительно и отрицательно заряженные ионы – катионы и анионы соответственно. Катионами являются ионы металлов, анионами – кислотные остатки. Примеры ионных уравнений:
- NaCl → Na + + Cl − ;
- Al2(SO4)3 → 2Al3 + + 3SO4 2− ;
- CaClBr → Ca2 + + Cl – + Br – .
Помимо катионов металлов в солях могут присутствовать катионы аммония (NH4 + ) и фосфония (PH4 + ).
Другие реакции описаны в таблице химических свойств солей.
Реакция
Особенности
Уравнение
Более активный металл вытесняет менее активный
Свойственно солям, образованным более слабыми кислотами. Образуются новые соли
Взаимодействуют соли, образованные нерастворимыми основаниями
Взаимодействуют растворимые соли. Образуется осадок

Некоторые соли в зависимости от вида разлагаются при нагревании на оксид металла и простые вещества. Например, СаСO3 → СаO + СО2, 2AgCl → Ag + Cl2.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях и видах солей. Сложные неорганические соединения состоят из металлов и кислотных остатков. Могут включать водород (кислые соли), два металла или два кислотных остатка. Это твёрдые кристаллические вещества, которые образуются в результате реакций кислот или щелочей с металлами. Реагируют с основаниями, кислотами, металлами, другими солями.
Источник: obrazovaka.ru