8,1517, 16,342, 33,46 и 45,13 эВ; сродство к электрону 1,22 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,133, ионный радиус Si 4+ (в скобках указаны координац. числа) 0,040 нм (4), 0,054 нм (6), ковалентный — 0,1175 нм. К ремний-второй после кислорода по распространенности в земной коре элемент (27,6% по массе). В своб. состоянии в природе не встречается, находится преим. в виде SiO 2 (см. Кремния диоксид) или силикатов. В виде SiO 2 кремний входят в состав растит. и животных организмов (напр., скелетные части).
Свойства. Компактный кремний- в-во серебристо-серого цвета с металлич. блеском. Кристаллич. решетка устойчивой модификации кубич. гранецентрированная типа алмаза, а=0,54307 нм, пространств. группа Fd3m, z=4.
При высоких давлениях существуют др. полиморфные модификации: при 20 ГПа-кремний I с тетрагон. решеткой (а=0,4686 нм, с=0,2585 нм), выше 20 ГПа-кремний II с кубич. (а=0,644 нм) и кремний III с гексагон. (а=0,380 нм, с=0,628 нм). При кристаллизации из газовой фазы на пов-стях с т-рой ниже 600 °С образуется аморфный кремний. Для кристаллич. Si т. пл. 1415 °С (плавится с уменьшением объема на 9%), т. кип. 3249 °С; плотн.
Химия 9 класс: Кремний
2,33 г/см 3 ; C 0 p 20,16 Дж/(моль . К); D H 0 пл 49,9 кДж/моль, D H 0 исп 445,2 кДж/моль; S 298 18,9 Дж/(моль . К); давление пара 0,046 Па (1415 °С); температурный коэф. линейного расширения 3,72 . 10 -6 К -1 (291-1273 К) и -.0,6 . 10 -6 К -1 (84 К); теплопроводность 95,5 Вт/(м . К); р 2,4-10 7 Ом м (25 °С); т-ра Дебая 645 К; e 12; диамагнетик, магн. восприимчивость — 3,9 . 10 -6 . При обычных условиях кремний хрупок, выше 800 °С становится пластичным. Кремний прозрачен для И К излучения при длинах волн l >1 мкм; коэф. преломления 3,565 ( l =1,05 мкм), 3,443 ( l =2,6 мкм), 3,45 ( l = 2-10 мкм); отражат. способность 0,3 ( l >1,5 мкм).
Кремний — полупроводник; ширина запрещенной зоны 1,21 эВ при т-ре ок. 0 К и 1,09 эВ при 300 К; концентрация носителей тока в кремнии с собственной проводимостью 1,5-10 16 м -3 (300 К); температурная зависимость подвижности электронов и дырок [м 2 /(В . с)] определяется соотв. выражениями: m n =4,0 . 10 5 Т -2,6 (300 [ T [ 400 К) и m р = 2,5 . 10 4 T -2,3 (150 [ T [ 400 К); при 300 К m n = 0,145 м 2 /(В . с), m p =0,048 м 2 /(В . с), коэф. диффузии электронов 3,5 . 10 -3 м 2 /с, дырок — 1,3 . 10 -3 м 2 /с.
Электрофиз. св-ва кремния зависят от природы и концентрации присутствующих примесей и структурных дефектов. Для получения монокристаллов кремния с дырочной проводимостью используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с электронной проводимостью — Р, As, Sb (донорные примеси).
Примеси Аu, Сu, Fe, Mn, V и нек-рые др. существенно снижают время жизни носителей тока в монокристаллах кремния. Макс, р-римость примесей в кремнии наблюдается при 1200-1300 °С и м. б. грубо оценена по значению коэф. распределения между твердым кремнием и его расплавом. Акцепторные примеси в кремнии имеют большие значения коэф. диффузии, чем донорные. Ряд примесей (Li, Сu, Аu) диффундирует по междоузлиям кристаллич. решетки с очень высокими скоростями. Для определения содержания примесей в кремнии высокой чистоты используют прецизионные методы: спектральный и активационный анализ, метод ЭПР и др.
Углерод и кремний IVА группа | Химия ЕГЭ, ЦТ
Страница «КРЕМНИЙ» подготовлена по материалам химической энциклопедии.
Еще по теме:
Источник: xumuk.ru
Соединения кремния

Кремний – активный неметалл, вступающий в реакции с металлами и неметаллами. Соединения кремния в зависимости от входящих в состав веществ называются силанами, силицидами, силикатами.
Простое вещество
Кремний (Si) – хрупкое кристаллическое вещество. Имеет переменную валентность II и IV. Электроны располагаются на трёх энергетических уровнях. Четыре валентных электрона находятся на s- и p-подуровнях. Электронная конфигурация элемента – 1s 2 2s 2 2p 6 3s 2 3p 2 .
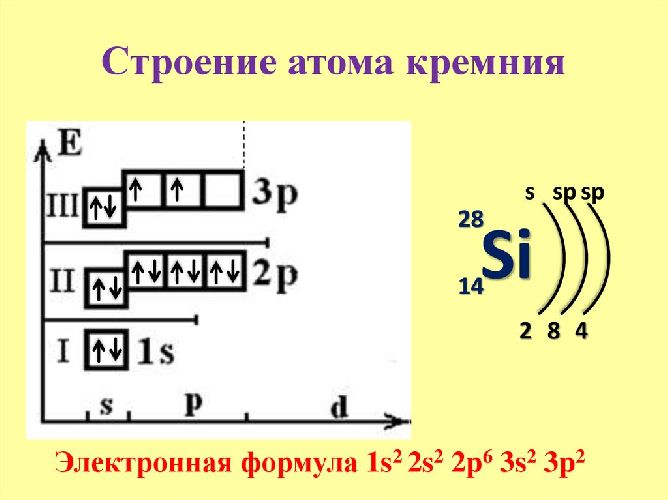
В реакциях с металлами кремний проявляет свойства окислителя и имеет отрицательную степень окисления -4. С галогенами и неметаллами кремний ведёт себя как восстановитель и имеет степень окисления +4. Третья степень окисления +2 проявляется в монооксиде кремния.
Соединения
Общая характеристика соединений кремния представлена в таблице.

Вещество
Формула
Физические свойства
Химические свойства
Монооксид, оксид кремния (II) или кремнезём
Аморфное вещество. Не проводит электричество, не образует соли. Растворяется в плавиковой кислоте. При нагревании разлагается на кислород и кремний
Реагирует при нагревании:
– с углекислым газом: SiO + СО2 → SiO2 + CO;
Диоксид, оксид кремния (IV) или песок
Кристаллическое тугоплавкое вещество. Не растворяется в воде. Диэлектрик
– С металлами: SiO2 + 2Mg → Si + 2MgO;
– с оксидами: SiO2 + CaO → CaSiO3;
Образует гомологичный ряд с общей формулой SinH2n+2. Ядовитый бесцветный газ с запахом, воспламеняется на воздухе. Нерастворим в холодной воде. Разлагается при нагревании и в горячей воде
– с концентрированным гидроксидом натрия: SiH4 + 4NaOH → Na4SiO4 + 4H2;
– с перманганатом калия: 3SiH4 + 8KMnO4 → 8MnO2 + 3SiO2 + 8KOH + 2H2O
Карборунд или карбид кремния
Тугоплавкое твёрдое вещество. Кристаллическая решётка схожа с решёткой алмаза. Полупроводник
– С водяным паром при высокой температуре: SiC + 2H2O → SiO2 + CH4;
– с концентрированными кислотами: 3SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O;
– со щелочами в присутствии кислорода: SiC + 4NaOH + O2 → Na4SiO4 + C + 2H2O;
– с кислородом при нагревании: 2SiC + 3O2 → 2SiO2 + 2CO
– с металлами при нагревании: 2SiC + 5Mg → 2Mg2Si + MgC2;
– с галогенами при нагревании: SiC + 2Cl2 → SiCl4 + C
Соединения с активными металлами. Электропроводны
Mg2Si не реагирует с водой, но взаимодействует с разбавленными кислотами
Условно называются гидроксидами кремния. Существует несколько видов. Наиболее известные метакремниевая (H2SiO3) и ортокремниевая (H4SiO4) кислоты. Слабые, без кислого вкуса. Плохо растворимы в воде. Не меняют цвет индикатора
– Растворяются в растворах и расплавах щелочей: H2SiO3 + 2KOH → K2SiO3 + 2H2O;
Соли кремниевых кислот. Твёрдые вещества, входящие в состав земной коры. Тугоплавки
В природе наиболее распространённое вещество – песок. Кварц, аметист, агат, хрусталь и другие вещества являются модификацией песка.

Что мы узнали?
Из урока 9 класса узнали, какие вещества образует кремний. Элемент активно взаимодействует с металлами и неметаллами, образуя оксиды, кислоты, силаны, силициды, силикаты. В зависимости от реакции кремний проявляет свойства восстановителя или окислителя и имеет степени окисления +2, +4, -4. Большинство веществ – твёрдые тугоплавкие вещества, плохо растворимые в воде.
Кислоты кремния – слабокислые жидкости, силаны – газы с неприятным запахом. За счёт активности кремний встречается в природе только в составе сложных веществ.
Источник: obrazovaka.ru
Кремний





Кремний (лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086, неметалл, полупроводник. В природе элемент представлен тремя стабильными изотопами: 28 Si (92,27%), 29 Si (4,68%) и 30 Si (3,05%). Кремний 2 по распространённости элемент на Земле после кислорода. Играет важнейшую роль на планете.
Кремний и его соединения являются важнейшей неотъемлемой частью в современном мире с его научно-техническим развитием и прогрессом в научных исследованиях. Соединения кремния, а также кремний в чистом виде широко применяются в различных отраслях промышленности и научных исследованиях. Чистый кремний особенно широкое распространение получил в электронной промышленности.
Из кристаллов чистого кремния изготавливают практический все процессоры, микрочипы, транзисторы и другие электронные приборы. С развитием современной науки на основе кремния разрабатывают и получают новые композитные материалы с принципиально новыми физическими и химическими свойствами. Композитные материалы на основе кремния по своим характеристикам превосходят изделия из металлов и других элементов, отличаясь, например, от изделий из металлов повышенной прочностью, жаропрочностью и лёгкостью, а также другими свойствами. Особенно широкое применение композитных материалов приходится на авиастроение и космическую промышленность. Также кремний играет важную роль в жизни всего живого на Земле.
Историческая справка.
Кремний как один из самых распространённых элемент в чистом виде на Земле не встречается. Кремний широко распространён в виде различных химических соединений. Одним из самых распространённых соединений кремния является так называемый кремнезём — SiO2. Человечество ещё с незапамятных времён познакомилось с соединениями кремния.
Первобытные люди каменного века изготавливали свои первобытные орудия труда. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. В дальнейшем с развитием человеческого общества человек начал заниматься переработкой соединений кремния. Около 3000 лет до нашей эры в Древнем Египте научились получать стекло.
Раньше других известное соединение кремния — двуокись SiO2 (кремнезём). В 18 веке кремнезём считали простым телом и относили к «землям» (что и отражено в его названии). Сложность состава кремнезёма установил И. Я. Берцелиус. Он же впервые, в 1825 году, получил элементарный кремний из фтористого кремния SiF4, восстанавливая последний металлическим калием.
Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название ввёл Г. И. Гесс в 1834 году.
Распространённость в природе.
При магматических процессах происходит слабая дифференциация кремния: он накапливается как в гранитоидах (32,3%), так и в ультраосновных породах (19%). При высоких температурах и большом давлении растворимость SiO2 повышается. Возможна его миграция и с водяным паром, поэтому для пегматитов гидротермальных жил характерны значительные концентрации кварца, с которым нередко связаны и рудные элементы (золото-кварцевые, кварцево-касситеритовые и др. жилы).
Физические и химические свойства.
Кремний образует тёмно-серые с металлическим блеском кристаллы, имеющие кубическую гранецентрированную решётку типа алмаза с периодом а = 5,431Å, плотностью 2,33 г/см 3 . При очень высоких давлениях получена новая (по-видимому, гексагональная) модификация с плотностью 2,55 г/см 3 . Кремний несмотря на то что он не метал достаточно устойчив к высоким температурам. Температура плавления кремния выше некоторых металлов и совсем немного ниже железа.
Температура закипания кремния значительно выше температуры плавления. Кремний плавится при 1417°С, кипение кремния происходит при температуре в 2600°С. Удельная теплоёмкость (при 20—100°С) 800 дж/(кг×К), или 0,191 кал/(г×град); теплопроводность даже для самых чистых образцов не постоянна и находится в пределах (25°С) 84—126 вт/(м×К), или 0,20—0,30 кал/(см×сек×град).
Температурный коэффициент линейного расширения 2,33×10 -6 К -1 ; ниже 120K становится отрицательным. Кремний прозрачен для длинноволновых ИК-лучей; показатель преломления (для l=6 мкм) 3,42; диэлектрическая проницаемость 11,7. Кремний диамагнитен, атомная магнитная восприимчивость —0,13×10 -6 . Твёрдость кремния по Моосу 7,0, по Бринеллю 2,4 Гн/м 2 (240 кгс/мм 2 ), модуль упругости 109 Гн/м 2 (10890 кгс/мм 2 ), коэффициент сжимаемости 0,325×10 -6 см 2 /кг. Кремний хрупкий материал; заметная пластическая деформация начинается при температуре выше 800°С.
Кремний — полупроводник. Свойства кремния как полупроводника нашли широкое применение и являются неотъемлемой важной частью в создании электроники и электронных приборов. Электрические свойства кремния очень сильно зависят от примесей. Зависимость электрических свойств кремния от добавляемых примесей позволяет создавать широкий спектр электронных приборов.
Собственное удельное объёмное электросопротивление кремния при комнатной температуре принимается равным 2,3×10 3 ом×м (2,3×10 5 ом×см). Полупроводниковый кремний с проводимостью р-типа (добавки В, Al, In или Ga) и n-типа (добавки Р, Bi, As или Sb) имеет значительно меньшее сопротивление. Ширина запрещенной зоны по электрическим измерениям составляет 1,21 эв при 0 К и снижается до 1,119 эв при 300 К.
В соответствии с положением кремния в периодической системе Менделеева 14 электронов атома кремния распределены по трём оболочкам: в первой (от ядра) 2 электрона, во второй 8, в третьей (валентной) 4; конфигурация электронной оболочки 1s 2 2s 2 2p 6 3s 2 3p 2 (см. Атом). Последовательные потенциалы ионизации (эв): 8,149; 16,34; 33,46 и 45,13. Атомный радиус 1,33Å, ковалентный радиус 1,17Å, ионные радиусы Si 4+ 0,39Å, Si 4- 1,98Å. В соединениях кремний (аналогично углероду) 4-валентен. Однако, в отличие от углерода, кремний наряду с координационым числом 4 проявляет координационное число 6, что объясняется большим объёмом его атома (примером таких соединений являются кремнефториды, содержащие группу [SiF6] 2- ).
Химическая связь атома кремния с другими атомами осуществляется обычно за счёт гибридных sp 3 -орбиталей, но возможно также вовлечение двух из его пяти (вакантных) 3d-орбиталей, особенно когда кремний является шести-координационным. Обладая малой величиной электроотрицательности, равной 1,8 (против 2,5 у углерода; 3,0 у азота и т. д.), кремний в соединениях с неметаллами электроположителен, и эти соединения носят полярный характер.
Большая энергия связи с кислородом Si—O, равная 464 кдж/моль (111 ккал/моль), обусловливает стойкость его кислородных соединений (SiO2 и силикатов). Энергия связи Si—Si мала, 176 кдж/моль (42 ккал/моль); в отличие от углерода, для кремния не характерно образование длинных цепей и двойной связи между атомами Si.
На воздухе кремний благодаря образованию защитной окисной плёнки устойчив даже при повышенных температурах. В кислороде окисляется начиная с 400°С, образуя кремния двуокись SiO2. Известна также моноокись SiO, устойчивая при высоких температурах в виде газа; в результате резкого охлаждения может быть получен твёрдый продукт, легко разлагающийся на тонкую смесь Si и SiO2.
Кремний устойчив к кислотам и растворяется только в смеси азотной и фтористоводородной кислот; легко растворяется в горячих растворах щелочей с выделением водорода. Кремний реагирует с фтором при комнатной температуре, с остальными галогенами — при нагревании с образованием соединений общей формулы SiX4 (см. Кремния галогениды).
Водород непосредственно не реагирует с кремнием, и кремневодороды (силаны) получают разложением силицидов (см. ниже). Известны кремневодороды от SiH4 до Si8H18 (по составу аналогичны предельным углеводородам). Кремний образует 2 группы кислородсодержащих силанов — силоксаны и силоксены. С азотом кремния реагирует при температуре выше 1000°С.
Важное практическое значение имеет нитрид Si3N4, не окисляющийся на воздухе даже при 1200°С, стойкий по отношению к кислотам (кроме азотной) и щелочам, а также к расплавленным металлам и шлакам, что делает его ценным материалом для химической промышленности, для производства огнеупоров и др. Высокой твёрдостью, а также термической и химической стойкостью отличаются соединения кремния с углеродом (кремния карбид SiC) и с бором (SiB3, SiB6, SiB12). При нагревании кремний реагирует (в присутствии металлических катализаторов, например, меди) с хлорорганическими соединениями (например, с CH3Cl) с образованием органогалосиланов [например, Si (CH3)3CI], служащих для синтеза многочисленных кремнийорганических соединений.
Кремний образует соединения почти со всеми металлами — силициды (не обнаружены соединения только с Bi, Tl, Pb, Hg). Получено более 250 силицидов, состав которых (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si и др.) обычно не отвечает классическим валентностям. Силициды отличаются тугоплавкостью и твёрдостью; наибольшее практическое значение имеют ферросилиций (восстановитель при выплавке специальных сплавов, см. Ферросплавы) и силицид молибдена MoSi2 (нагреватели электропечей, лопатки газовых турбин и т. д.).
Получение и применение.
Кремний технической чистоты (95—98%) получают в электрической дуге восстановлением кремнезёма SiO2 между графитовыми электродами. В связи с развитием полупроводниковой техники разработаны методы получения чистого и особо чистого кремния. Это требует предварительного синтеза чистейших исходных соединений кремния, из которых кремний извлекают путём восстановления или термического разложения.
Чистый полупроводниковый кремний получают в двух видах: поликристаллический (восстановлением SiCI4 или SiHCl3 цинком или водородом, термическим разложением Sil4 и SiH4) и монокристаллический (бестигельной зонной плавкой и «вытягиванием» монокристалла из расплавленного кремния — метод Чохральского).
Специально легированный кремний широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, управляемые диоды — тиристоры; солнечные фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку кремний прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике (см. также Кварц).
Кремний имеет разнообразные и всё расширяющиеся области применения. В металлургии кремний используется для удаления растворённого в расплавленных металлах кислорода (раскисления). Кремний является составной частью большого числа сплавов железа и цветных металлов.
Обычно кремний придаёт сплавам повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает механическую прочность; однако при большем его содержании кремний может вызвать хрупкость. Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие кремний. Всё большее количество кремния идёт на синтез кремнийорганических соединений и силицидов. Кремнезём и многие силикаты (глины, полевые шпаты, слюды, тальки и т. д.) перерабатываются стекольной, цементной, керамической, электротехнической и другими отраслями промышленности.
Бережной А. С., Кремний и его бинарные системы. К., 1958; Красюк Б. А., Грибов А. И., Полупроводники — германий и кремний, М., 1961; Реньян В. Р., Технология полупроводникового кремния, пер. с англ., М., 1969; Салли И. В., Фалькевич Э. С., Производство полупроводникового кремния, М., 1970; Кремний и германий. Сб. ст., под ред. Э. С. Фалькевича, Д. И. Левинзона, в. 1—2, М., 1969—70; Гладышевский Е. И., Кристаллохимия силицидов и германидов, М., 1971; Wolf Н. F., Silicon semiconductor data, Oxf. — N. Y., 1965.
Ссылки для перехода в следующие разделы:
Источник: geography-a.ru