К элементам 1 группы относятся литий, натрий, калий, рубидий, цезий и франций. Групповое название элементов – щелочные металлы – связано с тем, что их гидроксиды являются едкими щелочами. Франций – радиоактивный и малодоступный для изучения элемент, период его полураспада составляет всего 22 минуты.
1.1. Место щелочных металлов в Периодической системе химических элементов
Щелочные металлы относятся к s-элементам. На внешнем энергетическом уровне атомы щелочных металлов имеют 1 электрон, их электронная конфигурация ns 1 . Они легко отдают один электрон, проявляя степень окисления +1. Радиусы атомов возрастают при переходе от лития к францию, значения потенциала ионизации и относительной электроотрицательности уменьшаются. Все щелочные металлы в электрохимическом ряду напряжений располагаются в начале ряда и являются сильными восстановителями, эта способность возрастает с увеличением заряда ядра атома.
1.2. Распространенность в природе
В свободном состоянии щелочные металлы в природе не встречаются, наиболее распространенными являются натрий и калий.
Щелочные металлы. Видеоурок 14. Химия 9 класс
Содержание натрия в земной коре 2,27 мас. %, калия – 1,84 мас. %. Натрий входит в состав поваренной (каменной) соли NaCl, мирабилита (глауберовой соли) Na2SO4 · 10H2O, сильвинита NaCl · KCl, содержится в морской воде.
Основными минералами калия являются: сильвин KCl, сильвинит NaCl · KCl, карналлит KCl · MgCl2 · 6H2O, ортоклаз (калиевый полевой шпат) K[AlSi3O8], входит в состав морской воды и растений.
Литий, рубидий и цезий относятся к числу редких и рассеянных элементов. Содержание лития в земной коре составляет 6,5·10 -3 мас. %, рубидия – 1,5·10 -2 мас. %, цезия – 3,7·10 -4 мас. %. Литий образует собственные минералы – сподумен LiAlSi2O6, амблигонит LiAl(PO4)(OH, F), входит в состав различных силикатов и алюмосиликатов. Цезий входит в состав редких минералов поллуцита 4Cs2O · 4Al2O3 · 18SiO2 · 2H2O и авогадрита (K, Cs)[BF4], содержится в минералах калия. Рубидий собственных минералов не образует, в качестве примеси содержится в минералах калия – сильвините и карналлите.
1.3. Физические свойства щелочных металлов
Литий, натрий, калий, рубидий в свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Все металлы очень мягкие и пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу.
В кристаллическом состоянии все они имеют объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Все щелочные металлы имеют небольшую плотность, самый легкий металл – литий, его плотность составляет всего 0,53 г/см 3 .
Металлы имеют достаточно низкие температуры плавления и кипения, причем с увеличением порядкового номера элемента температура плавления металла понижается.
Все металлы очень активны, поэтому их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства щелочных металлов приведены в таблице.
Источник: studfile.net
Щелочные металлы — список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.

Что представляют собой
Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:
- литий;

- натрий;

- калий.

- рубидий;

- цезий;

- франций.
Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
- Самые распространенные элементы – натрий с калием.
- Литий, рубидий, цезий причислены к редким и рассеянным.
- Самым редкостным щелочным металлом является франций. По редкости этот радиогенный материал – второй на планете: суммарный объем в земной коре не превышает трети килограмма.
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
- Хлорид натрия – обычная каменная соль. Ее содержит вода морей и океанов.
- Глауберова соль.
- Соли калия находят в почвах.
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
- Электролиз. Материалом служат расплавы их хлоридов (или других галогенидов) либо гидроксиды. Растворы солей как исходник не годятся: конечным продуктом становятся водород и щелочи.
- Восстановление из бромида, хромата либо хлорида. Восстановителями выступают магний, цирконий, кальций, кремний. Процесс получения протекает в вакууме при температурах под 1000°С, образующийся металл периодически отгоняется.
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
При взаимодействии металлов с водой выделяется водород, возможен взрыв.
Окраска пламени щелочными металлами и их соединениями:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.

Более 8000 видов товара из 500 разновидностей натурального камня. Ежедневное обновление!
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Как опознать щелочной металл
Вид щелочного металла «выдает» окрас пламени:
Натрий либо его соединения делают пламя охристо-желтым.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
- Пищевая сода нашла применение как домашнее средство для устранения ангины, обязательный ингредиент выпечки, натуральный консервант.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
- Перед началом работы надеть защитные перчатки и очки (маску).
- Кусочек отрезают скальпелем от массива, не вытаскивая из керосина.
- В емкости, заполненной аргоном, счищают с поверхности остатки оксидов.
- Очищенный образец помещают в сосуд, где будет проводиться опыт.
- Остатки, не затронутые реакцией, засыпают сухим спиртом.
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Источник: jgems.ru
Словари
Все словари русского языка: Толковый словарь, Словарь синонимов, Словарь антонимов, Энциклопедический словарь, Академический словарь, Словарь существительных, Поговорки, Словарь русского арго, Орфографический словарь, Словарь ударений, Трудности произношения и ударения, Формы слов, Синонимы, Тезаурус русской деловой лексики, Морфемно-орфографический словарь, Этимология, Этимологический словарь, Грамматический словарь, Идеография, Пословицы и поговорки, Этимологический словарь русского языка.
Уважаемый пользователь, сайт развивается и существует только на доходы от рекламы — пожалуйста, отключите блокировщик рекламы.
щелочные металлы
Энциклопедический словарь
Щелочны́е мета́ллы — химические элементы Li, Na, K, Rb, Cs, Fr. Название от щелочей — гидроксидов щелочных металлов.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНЫ́Е МЕТА́ЛЛЫ, химические элементы Li, Na, K, Rb, Cs, Fr. Название от щелочей — гидроксидов щелочных металлов.
Большой энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы Li, Na, K, Rb, Cs, Fr. Название от щелочей — гидроксидов щелочных металлов.
Энциклопедия Кольера
ПОДГРУППА IА. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ЛИТИЙ, НАТРИЙ, КАЛИЙ, РУБИДИЙ, ЦЕЗИЙ, ФРАНЦИЙ
Электронное строение щелочных металлов характеризуется наличием на внешней электронной оболочке одного электрона, относительно слабо связанного с ядром. С каждого щелочного металла начинается новый период в периодической таблице. Щелочной металл способен отдавать свой внешний электрон легче, чем любой другой элемент этого периода.
Разрез щелочного металла в инертной среде имеет яркий серебристый блеск. Щелочные металлы отличаются невысокой плотностью, хорошей электропроводностью и плавятся при сравнительно низких температурах (табл. 2).
В свободном виде щелочные металлы получают электролизом расплавов таких солей, как NaCl, CaCl2, CaF2 или гидроксидов (NaOH), так как нет более активного металла, способного вытеснить щелочной металл из галогенида. При электролизе галогенидов необходимо изолировать выделяющийся на катоде металл, так как одновременно на аноде выделяется газообразный галоген, активно реагирующий с выделяющимся металлом.
Поскольку у щелочных металлов на внешнем слое всего один электрон, каждый из них является наиболее активным в своем периоде, так, Li самый активный металл в первом периоде из восьми элементов, Na соответственно во втором, а K самый активный металл третьего периода, содержащего 18 элементов (первый переходный период). В подгруппе щелочных металлов (IA) способность отдавать электрон возрастает сверху вниз.
Химические свойства. Все щелочные металлы активно реагируют с кислородом, образуя оксиды или пероксиды, отличаясь в этом друг от друга: Li превращается в Li2O, а другие щелочные металлы в смесь M2O2 и MO2, причем Rb и Cs при этом возгораются. Все щелочные металлы образуют с водородом солеподобные термически стабильные при высоких температурах гидриды состава M+H, являющиеся активными восстановителями; гидриды разлагаются водой с образованием щелочей и водорода и выделением теплоты, вызывающей воспламенение газа, причем скорость этой реакции у лития выше, чем у Na и K.
В жидком аммиаке щелочные металлы растворяются, образуя голубые растворы, и (в отличие от реакции с водой) могут быть выделены снова при испарении аммиака или добавлении соответствующей соли (например, NaCl из его аммиачного раствора). При реакции с газообразным аммиаком реакция протекает подобно реакции с водой:
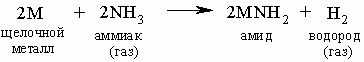
Амиды щелочных металлов проявляют основные свойства подобно гидроксидам. Большинство соединений щелочных металлов, кроме некоторых соединений лития, хорошо растворимы в воде. По атомным размерам и зарядовой плотности литий близок к магнию, поэтому свойства соединений этих элементов похожи.
По растворимости и термической устойчивости карбонат лития подобен карбонатам магния и бериллия элементов подгруппы IIA; эти карбонаты разлагаются при относительно невысоких температурах вследствие более прочной связи МО. Соли лития лучше растворимы в органических растворителях (спиртах, эфирах, нефтяных растворителях), чем соли других щелочных металлов. Литий (как и магний) непосредственно реагирует с азотом, образуя Li3N (магний образует Mg3N2), тогда как натрий и другие щелочные металлы могут образовывать нитриды только в жестких условиях. Металлы подгруппы IA реагируют с углеродом, но наиболее легко протекает взаимодействие с литием (очевидно, благодаря его малому радиусу) и наименее легко с цезием. И наоборот, активные щелочные металлы непосредственно реагируют с СО, образуя карбонилы (например, K(CO)x), а менее активные Li и Na только в определенных условиях.
Применение. Щелочные металлы применяются как в промышленности, так и в химических лабораториях, например для синтезов. Литий используется для получения твердых легких сплавов, отличающихся, однако, хрупкостью. Большие количества натрия расходуются для получения сплава Na4Pb, из которого получают тетраэтилсвинец Pb(C2H5)4 антидетонатор бензинового топлива.
Литий, натрий и кальций используются как компоненты мягких подшипниковых сплавов. Единственный и поэтому подвижный электрон на внешнем слое делает щелочные металлы прекрасными проводниками тепла и электричества.
Сплавы калия и натрия, сохраняющие жидкое состояние в широком интервале температур, применяют как теплообменную жидкость в некоторых типах ядерных реакторов и благодаря высоким температурам в ядерном реакторе используются для производства пара. Металлический натрий в виде подводящих электрических шин используется в электрохимической технологии для передачи токов большой мощности.
Гидрид лития LiH является удобным источником водорода, выделяющегося в результате реакции гидрида с водой. Литийалюминийгидрид LiAlH4 и гидрид лития используются в качестве восстановителей в органическом и неорганическом синтезе. Благодаря малому ионному радиусу и соответственно высокой зарядовой плотности литий активен в реакциях с водой, поэтому соединения лития сильно гигроскопичны, и хлорид лития LiCl используется для осушки воздуха при эксплуатации приборов. Гидроксиды щелочных металлов сильные основания, хорошо растворимые в воде; они применяются для создания щелочной среды. Гидроксид натрия как наиболее дешевая щелочь находит широкое применение (только в США ее расходуется в год более 2,26 млн. т).
Натрий. Известен с древности, выделил его Х.Дэви в 1807. Это мягкий металл, широко применяются такие его соединения, как щелочь (гидроксид натрия NaOH), пищевая сода (бикарбонат натрия NaHCO3) и кальцинированная сода (карбонат натрия Na2CO3). Находит применение и металл в виде паров в неярких газоразрядных лампах уличного освещения.
Калий. Известен с древности, выделил его также Х.Дэви в 1807. Соли калия хорошо известны: калиевая селитра (нитрат калия KNO3), поташ (карбонат калия K2CO3), едкое кали (гидроксид калия KOH) и др. Металлический калий также находит различное применение в технологии теплообменных сплавов.
Рубидий был открыт методом спектроскопии Р.Бунзеном в 1861; содержит 27,85% радиоактивного рубидия Rb-87. Рубидий, как и другие металлы подгруппы IA, химически высокоактивен и должен храниться под слоем нефти или керосина во избежание окисления кислородом воздуха. Рубидий находит разнообразное применение, в том числе в технологии фотоэлементов, радиовакуумных приборов и в фармацевтике.
Цезий. Соединения цезия широко распространены в природе, обычно в малых количествах совместно с соединениями других щелочных металлов. Минерал поллуцит силикат содержит 34% оксида цезия Cs2O. Элемент был открыт Р.Бунзеном методом спектроскопии в 1860. Основным применением цезия является производство фотоэлементов и электронных ламп, один из радиоактивных изотопов цезия Cs-137 применяется в лучевой терапии и научных исследованиях.
Франций. Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре в более чем следовых количествах. Сведения о франции и его соединениях основаны на исследовании ничтожного его количества, искусственно полученного (на высокоэнергетическом ускорителе) при a-распаде актиния-227.
Наиболее долгоживущий изотоп 22387Fr распадается за 21 мин на 22388Ra и b-частицы. Согласно приблизительной оценке, металлический радиус франция составляет 2,7 . Франций обладает большинством свойств, характерных для других щелочных металлов, и отличается высокой электронодонорной активностью. Он образует растворимые соли и гидроксид. Во всех соединениях франций проявляет степень окисления I.
Иллюстрированный энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. Мягкие металлы, легко режутся (кроме Li), Rb, Cs и Fr почти пастообразны при обычных условиях; Li — самый лёгкий из всех металлов, Na и K легче воды. Химически очень активны, с водой реагируют бурно, со взрывом. Na и K в виде солей широко распространены в природе, остальные редки.
Источник: sanstv.ru