Механизмы нуклеофильного замещения в галогеналканах
Общая схема реакции: R–X + :Y R–Y + :X – , где X – галоген; :Y – нуклеофильный реагент – донор пары электронов (H2O:, HO: – , :NH3, :NH2R, :CN – и т.п.).
Замещение галогена происходит по одному из двух возможных механизмов. Рассмотрим эти механизмы на примере замещения галогена на гидроксильную группу (гидролиз галогеноуглеводородов) в изопропилхлориде (CH3)2CH–Cl под действием водного раствора щелочи:
(CH3)2CH–Cl + :OH – (CH3)2CH–OH + :Cl –
Механизм I (двухстадийный)
Cтадия 1. Алкилгалогенид, отщепляя галоген (электролитическая диссоциация), превращается в карбокатион:
Cтадия 2. Карбокатион взаимодействует с нуклеофилом (донором пары электронов) с образованием конечного продукта:
Стадия 1 является лимитирующей. Поскольку в ней участвует только одна частица (молекула галогеналкана), реакция считается мономолекулярной. Данный механизм обозначается символом SN1 (мономолекулярное нуклеофильное замещение).
Механизм реакции SN1
Механизм II (одностадийный)
Этот механизм нуклеофильного замещения заключается в практически одновременном отщеплении галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона) и идет в одну стадию:
Этот механизм называют бимолекулярным нуклеофильным замещением и обозначают символом SN2.
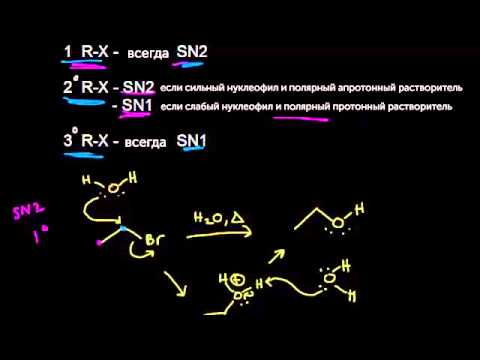
Механизм замещения зависит от строения реагентов и условий реакции. Для первичных галогеналканов предпочтительней одностадийный механизм (SN2), а для третичных – двухстадийный (SN1). Вторичные алкилгалогениды занимают промежуточное положение: механизм реакции зависит от условий ее проведения и может быть смешанным.
Как объяснить влияние строения галогеналкана на механизм реакции?
Источник: orgchem.ru
Таблица окисления химических элементов

Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Степень окисления может иметь три значения:
Бром и всё о нём. Химия – просто
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na 0 + Cl2 0 → 2Na +1 Cl -1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
-3, -2, -1, 0, +1, +2, +3, +4, +5
1, 0, +1, +3, +5, +7, редко +2 и +4
+2, +3, редко +4 и +6
-1, +1, +5, редко +3, +4
+3, +6, редко +2, +3, +5
+3, +4, +8, редко +2, +6, +7
-1, +1, +5, +7, редко +3, +4
+6, редко +2, +3, +4, +5
+2, +4, +6, +7, редко -1, +1, +3, +5
+3, +4, +6, +8, редко +2
+3, +4, +6, редко +1, +2
+2, +4, +6, редко +1, +3
+3, редко +3, +2, +4, +5
Или использовать на уроках этот вариант таблицы.

Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления.
Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Источник: obrazovaka.ru
Что означает sn в химии
Ключевое различие — реакции SN1 и SN2
Что такое реакции SN1?
- Образование карбокатиона за счет удаления уходящей группы.

- Реакция между карбокатионом и нуклеофилом (нуклеофильная атака).

- Это происходит только тогда, когда нуклеофил представляет собой нейтральное соединение (растворитель).

Что такое реакции SN2?
В реакциях SN2 одна связь разрывается, и одна связь образуется одновременно. Другими словами, это включает замещение уходящей группы нуклеофилом. Эта реакция протекает очень хорошо в метиловых и первичных алкилгалогенидах, тогда как в третичных алкилгалогенидах она протекает очень медленно, поскольку обратная атака блокируется объемными группами.

Общий механизм реакций SN2 можно описать следующим образом.
В чем разница между реакциями SN1 и SN2?
Характеристики реакций SN1 и SN2:
Механизм:
Барьеры реакции:
Нуклеофил:
Растворитель:
Определения:
Нуклеофил: химическое вещество, которое отдает пару электронов электрофилу для образования химической связи в связи с реакцией.
Электрофил: реагент, притянутый к электронам, это положительно заряженные или нейтральные частицы, имеющие свободные орбитали, которые притягиваются к центру, богатому электронами.
Источник: ru.strephonsays.com