У нас есть 23 ответов на вопрос В чем можно растворить хлорид серебра? Скорее всего, этого будет достаточно, чтобы вы получили ответ на ваш вопрос.
Содержание
- Чем можно растворить серебро?
- Как восстановить серебро из хлорида?
- Какая кислота чистит серебро?
- Как правильно осаждать серебро?
- Как растворить серебро́ в азотной кислоте?
- В чем можно растворить хлорид серебра? Ответы пользователей
- В чем можно растворить хлорид серебра? Видео-ответы
Отвечает Радик Радюшин
Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы): Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
«Недопечённый» хлорид. Аффинаж серебра, какие могут быть ошибки.
Хлори́д серебра́ (I) ( хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита .
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера . Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет.
Чем можно растворить серебро?
Чтобы растворить серебро, металл расплавляют с другим металлом, который хорошо растворяется в соляной кислоте (например, с медью). Если нужно отделить золото от серебра, то расплавленный сплав выливают в воду, в результате реакции образуются мельчайшие частички сплава.
Как восстановить серебро из хлорида?
В частном случае хлорид серебра перемешивают в растворе, содержащем 15-20% этилового спирта, а для восстановления серебра добавляют сахарный сироп, содержащий 70-90% сахара, причем восстановление серебра ведут при температуре 50-70°C.
Какая кислота чистит серебро?
Очистка серебра лимонной кислотой Разведите 100 г лимонной кислоты в двух стаканах воды, положите в емкость медную проволоку и поставьте ее на водяную баню. При закипании жидкости опустите в раствор серебряные изделия на 15 минут. Затем промойте серебро и тщательно протрите салфеткой.
Как правильно осаждать серебро?
Серебро осаждают из раствора в виде хлорида. Затем хлорид серебра перемешивают в водном растворе спирта и добавляют сахар с получением металлического серебра и раствора соляной кислоты. Маточный раствор осаждения хлорида серебра направляют на растворение исходного сырья.
Как растворить серебро́ в азотной кислоте?
Спасибо. 1) Растворение серебра в азотной кислоте , не содержащей соляную или хлориды, необходимо для перевода серебра в раствор и отделения его от золота (если оно присутствует в сплаве). Для растворения 10 грамм чистого серебра необходимо 12 грамм азотной кислоты 100%. Обычно она идет 60-65 % т.
Очистка серебра от примесей / Purification of silver from impurities
Источник: querybase.ru
Условия растворения осадков
Растворение и диссоциация соединений. Действуя щелочью на раствор соли Mg 2+ , можно получить малорастворимый гидроксид:

Если к части полученного осадка прилить хлороводородную кислоту, то он легко переходит в раствор. При добавлении к другой части осадка гидроксида магния небольшого количества хлорида аммония осадок также растворяется. Наконец, если к раствору хлорида магния сначала прибавить хлорид аммония, а затем КОН, то осадок гидроксида магния вовсе не выпадет. Сущность процессов растворения объясняется с помощью константы фазового равновесия — произведения растворимости.
Раствор, соприкасающийся с полученным осадком, насыщен по отношению к гидроксиду магния, и ионное произведение | Mg 2+ | • [ОН-] 2 = = nP(Mg(OH)2). Если прибавить к нему немного кислоты, то катионы Н + будут связывать ионы ОН- в недиссоциированные молекулы воды. В результате этого процесса произведение концентраций ионов ([Mg 2+ ]) • ([ОН-] 2 ) окажется меньше величины ПР, раствор станет ненасыщенным, что вызовет смещение равновесия в сторону реакции растворения осадка.
Через некоторое время динамическое равновесие может опять установиться, но если продолжать прибавление кислоты, то оно все время будет нарушаться, смещаясь в сторону растворения осадка, пока он не растворится полностью. Механизм растворения гидроксида магния можно изобразить следующей схемой:

Следовательно, для растворения какого-нибудь осадка необходимо связывать один из его ионов в растворе ионом другого вещества в мало- диссоциирующее соединение.
Малорастворимые соли слабых кислот потому и растворяются в сильных кислотах, что при этом ионы Н + связывают анионы солей в малодиссоциированные молекулы слабых кислот. Например:

Исключение составляют нерастворимые соли слабых кислот с очень малой величиной произведения растворимости, например сульфид ртути(Н) — nP(HgS) = 4 • IO- 53 . Сместить равновесие между осадком сульфида ртути и раствором, действуя сильной кислотой, невозможно, так как сероводородная кислота образует гораздо больше ионов HS-, чем их получается за счет растворимости HgS.
Кислые соли некоторых слабых кислот растворяются не только в сильных кислотах, но и в щелочах. Например, гидротартрат калия КНС4Н406 посылает в раствор анионы НС4Н40ё, частично отщепляющие ионы Н+, которые могут связываться анионами ОН- щелочи с образованием воды. В результате этого равновесие смещается вправо и осадок растворяется:

Растворение и комплексообразование. Иногда осадки солей растворяются с образованием прочных комплексных ионов. Так, хлорид серебра легко растворяется в растворе аммиака, потому что ионы Ag + , посылаемые осадком в раствор, связываются молекулами аммиака в комплексные катионы:

Понижение концентрации ионов Ag + приводит к нарушению равновесия между раствором и твердой фазой, т. е. к растворению осадка.
Наименее растворимые вещества (например, CuS, HgS и др.) переводят в раствор с помощью окислителей (концентрированная азотная кислота, или «царская водка», т. е. смесь одного объема концентрированной азотной кислоты с тремя объемами концентрированной хлороводородной кислоты). Малорастворимые соли сильных кислот (сульфаты щелочноземельных металлов BaS04, CaS04, SrS04, хлорид серебра AgCl и др.) в кислых средах не растворяются, так как при этом малодиссоциированные соединения не образуются. Для перевода сульфатов кальция, бария, стронция в раствор из осадков смесь обрабатывают при нагревании раствором соды Na2C03, сплавлением. При такой обработке сульфаты переходят в карбонаты:


Операцию обработки осадка сульфатов раствором соды повторяют несколько раз, периодически удаляя раствор, в котором накапливаются сульфат-ионы, поскольку они препятствуют растворению осадка. Образовавшиеся малорастворимые карбонаты растворяют в кислотах (хлороводородной, уксусной, азотной):
Источник: studme.org
Научная электронная библиотека


Это явление представляет собой частный случай рассмотренного выше.
Пусть имеется осадок хлорида серебра в равновесии с его насыщенным раствором. Если к системе постепенно добавлять хлорид-ионы, то произойдет растворение осадка вследствие образования хлоридного комплекса:
Пренебрегая той незначительной частью хлорида серебра, которая находится в растворе в недиссоциированном состоянии, растворимость AgCl (S) можно представить как сумму концентраций серебра во всех его формах:
Вынеся за скобки концентрацию свободных катионов серебра [Ag + ] и выразив ее через произведение растворимости хлорида серебра, получим:
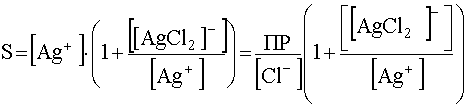
(56)
Учитывая, что константа нестойкости комплекса [[AgCl2] — ] представляет собой
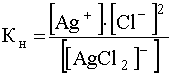
,
выразим [[AgCl2] — ] и подставим эту концентрацию в уравнение (56), в результате чего получим:
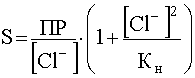
(57)
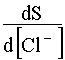
Уравнение (57) показывает, что с ростом концентрации [Cl — ] растворимость AgCl сначала резко падает в результате действия эффекта одноименного иона, а потом возрастает, проходя через минимум. Положение этого минимума на кривой зависимости S=f([Cl — ]) станет известным, если производную приравнять нулю:

.
Отсюда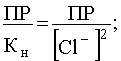
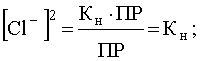
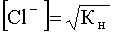 .
.
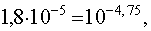
Учитывая, что константа нестойкости комплекса [AgCl2] — равна найдем концентрацию ионов Cl — , при которой растворимость садка AgCl будет минимальной и при дальнейшем ее увеличении растворимость S начнет возрастать вследствие образования хлоридного комплекса [AgCl2] — :
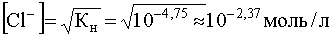
.
Ход кривой S = f([Cl — ]) представлен на рис. 14
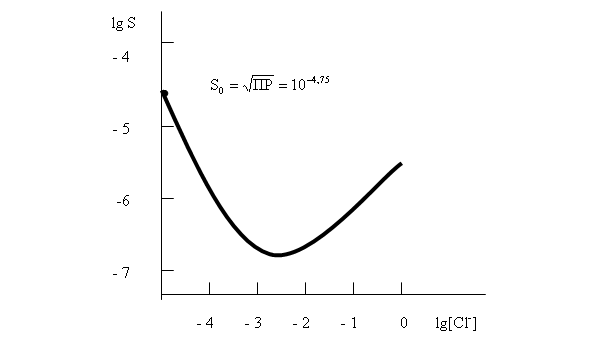
.
14 Зависимость растворимости S хлорида серебра от концентрации хлорид-ионов
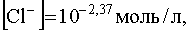
Растворимость осадка в точке минимума может быть определена из уравнения (57), если в него подставить рассчитанную выше. Она приблизительно равна 10 -7 моль/л.
Источник: monographies.ru