Металл золото — физические и оптические свойства, структура, морфология, классификация — энциклопедия Mineralpro.ru
Золото — свойства атома и сплавов
Золото (лат. Aurum), Au, химический элемент 1 группы периодической системы Менделеева; атомный номер 79, атомная масса 196,9665; тяжёлый металл жёлтого цвета, относящийся к благородным. Состоит из одного устойчивого изотопа 197Au.
Обзоры приведены в соответствии с энциклопедическими статьями С. А. Погодина и А. И. Стадниченко.
Разделы страницы о золоте как веществе и материале:
- Физические и физико-химические свойства золота
- Химические свойства золота и его соединений — см. также геохимию золота
- Золото в природе — см. также золоторудные поля и золотоносные узлы
- Историческая справка об использовании золота
- Извлечение золота — см. также разведку и добычу золота
- Золото в ноосфере (применение)
- Золото в биосфере и в медицине — см. также о биогенной концентрации золота
- Сетевые обзоры о золоте
- Сетевые новости о золоте
- Библиография по золоту
Физические и физико-химические свойства золота
ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197 Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0: Аи+: Аu2+: Аu3+ соответственно равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6).
РАЗДАЮ ДЕНЬГИ ЗА ПРАВИЛЬНЫЕ ОТВЕТЫ НА ВОПРОСЫ ПО ХИМИИ / Школьные вопросы
3олото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m.
Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г): твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото хорошо проводит тепло и электричество.
- Кристаллическая решётка золота гранецентрированная кубическая, а = 4,704 A.
- ⚛ Атомный радиус 1,44 A, ионный радиус Au1+ 1,37 A.
- tпл 1064,43°С, tkип 2947°С (приводится также величина 2880 °С); термический коэффициент линейного расширения 14,2·10-6 (0—100°С);
- температурные коэф. линейного расширения (5,98-19,10).10-6 К-1 (40-1200 К), объемного (1,79-5,73).10-5 К-1 (40-1200 К); теплопроводность 318 Вт/(м.К) при 273 К; r (2,06-2,84).10-8 Ом.м (273-373 К), температурный коэф. r 4,0.10-3 К-1 (273-373 К);
- удельная теплопроводность 311,48 вт/(м·К) [0,744 кал/см (сек·°С]; удельная теплоёмкость 132,3 дж/(кг·К) [0,0316кал/г·°С] (при 0°—100°С);
- удельное электросопротивление 2,25·10-8ом (м (2,25·10-6 ом (см) (при 20°С); температурный коэффициент электросопротивления 0,00396 (0—100°С).
- С0p 25,39 Дж/(моль.К); DH0пл 12,55 кДж/моль, DH0исп 348 кДж/моль; S0298 47,40 Дж/(моль.К);
- ур-ния температурной зависимости давления пара: для твердого 3. lgp (гПа) = 3,94 — 19820/T — 0,3061gT — 0,16.10-3 Т (298-1337 Т), для жидкого lgp(Пa) = 10,710 + 17866/Т (1337-3150 К);
- диамагнетик, магн. восприимчивость —29,59.10-6.
- Плотность твердого золота 19,32 г/см3 (при 20°С), жидкого 17,22 г/см3 (1100°С);
- Модуль упругости 79·103Мн/м2 (79·102кгс/мм2), для отожжённого золота предел прочности при растяжении 100—140 Мн/м2 (10—14 кгс/мм2), относительное удлинение 30—50%, сужение площади поперечного сечения 90%.
- После пластической деформации на холоду предел прочности повышается до 270—340 Мн/м2 (27—34 кгс/мм2). Твёрдость по Бринеллю 180 Мн/м2 (18 кгс/мм2) (для золота отожжённого около 400 °С).
Золото весьма стойко против химических воздействий. Оно устойчиво на воздухе и в воде. С О2, Н2, N2, P, Sb и С непосредственно не взаимодействует. Фосфид Аu2Р3 (DH0обр -102 кДж/моль) и антимонид AuSb2 (DH0обр — 13 кДж/моль) получают косвенным путем.
Наша Раша. Снежана Денисовна — Загадки на деньги
3олото не растворяется в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т — Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3): Аu + HNO3 + 4НСl: H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О. В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей золота раств. с образованием дицианоаурат-иона (цианирование): 2Au + 4CN- + Н2О + 0,5О2: 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения золота из руд. С галогенами в отсутствие влаги золото без нагревания не взаимод., при нагр. порошка золота в атмосфере галогенов образуются золота галогениды.
С многими металлами золото дает сплавы. На легком образовании амальгамы золота основан один из методов извлечения золота из горных пород. Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла.
Химические свойства золота и его соединений
Конфигурация внешних электронов атома золота 5d10 6s1. В соединениях золото имеет валентности 1 и 3 (известны комплексные соединения, в которых золото 2-валентно).
Для золота характерна лёгкая восстановимость его из соединений до металла и способность к комплексообразованию. Существование закиси золота, т. е. оксида золота (I) Au2O — сомнительно.
С неметаллами (кроме галогенов) золото не взаимодействует. С галогенами золото образует галогениды, например 2Au + 3Cl2 =2AuC13. В смеси соляной и азотной кислот золото растворяется, образуя золотохлористоводородную кислоту H [AuCl4].
В растворах цианида натрия NaCN (или калия KCN) при одновременном доступе кислорода золото превращается в цианоаурат (I) натрия 2Na [Au (CN)2]. Эта реакция, открытая в 1843 П. Р. Багратионом, получила практическое применение только в конце 19 в. (см. Цианирование).
Хлорид золота (I) AuCl получается при нагревании хлорида золота (III): AuC13 = AuCl + C12.
Хлорид золота (III) AuC13 получается действием хлора на порошок или тонкие листочки золота при 200 °С. Красные иглы AuCl3 дают с водой коричнево-красный раствор комплексной кислоты: AuC13 +Н2О=Н2[AuOC13].
При осаждении раствора AuC13 едкой щёлочью выпадает амфотерная жёлто-коричневая гидроокись золота(III) Au(OH)3 c преобладанием кислотных свойств; поэтому её называют золотой кислотой, а её соли — ауратами (III). При нагревании гидроокись золота (III) превращается в окись золота Au2O3, которая выше 220° разлагается по реакции: 2Au2O3 = 4Au + 3O2.
При восстановлении солей золота хлоридом олова (II) 2AuC13 + 3SnCl2 = 3SnCl4 + 2Au образуется весьма стойкий пурпуровый коллоидный раствор золота (кассиев пурпур); это используется в анализе для обнаружения золота. Количественное определение золота основано на его осаждении из водных растворов восстановителями (FeSO4, H2SO3, H2C2O4 и др.) или на применении пробирного анализа.
Гидроксид Au(OH)3 — темно-коричневые кристаллы; при нагревании дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на золото и О2; растворимость в воде 2,4.10-12 моль/л при 20°С, в р-рах НNО3 — до 0,38 моль/л при 25 °С, в растворах NaOH — до 8.10-4 моль/л при 25°С. В последнем случае в растворе золото находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13). Образуется Аu(ОН)3 при добавлении концентрированного раствора щелочи или Mg(OH)2 к растворам Н[АuСl4].
Ауpaты неустойчивы, легко разлагаются при нагревании. Аураты щелочных металлов хорошо растворяются в воде, растворимость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы. Аураты с некоторыми органическими веществами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид золота растворов щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2.
Другие кислородные соединения золота неустойчивы, легко образуют взрывчатые смеси. Соединение Аu2О3 с аммиаком Au2O3.4NH3 называется "гремучим золотом"; взрывается при 145°С, иногда и при более низких температурах; без взрыва растворяется в растворах цианидов щелочных металлов.
Гемисульфид золота Au2S — черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты. Сесквисульфид Au2S3 — черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного золота, р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами золота в безводном эфире на холоду. Известны комплексные соед., содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3-.
Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров золота на холоду селеноводородом осаждается сесквиселенид Au2Se3.H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного золота.
Селенат (IV) Au2(SeO3)3.3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах.
Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04.
Теллурид (гемителлурид) АuТе2 — кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3.
Тиоцианат AuSCN — бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. золота и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]-.
Коллоидное золото
При восстановлении золота в разб. р-рах его солей, а также при электрич. распылении золота в воде образуются коллоидные р-ры золота, окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы золота в коллоидном р-ре отрицательно заряжены. Гидрофобный золь золота в солянокислом водном р-ре можно представить схемой:
[Аu]m — ядро мицеллы (число атомов т в зависимости от условий может меняться от неск. сотен до миллионов единиц); АuСl4- — ионы, определяющие отрицательный заряд коллоидной частицы золота и величину потенциала адсорбционного слоя толщиной d0; Н+ — противоионы, определяющие потенциал диффузионного слоя (электрокинетич. потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n — кол-во ионов АuСl4-, адсорбированных на поверхности ядра мицеллы, при этом п
Сетевые обзоры и статьи о золоте
-
Обзор А. И. Стадниченко.
Сетевые новости о золоте
Библиография по золоту
См. также литературу при статье Золота сплавы.
- Общая металлургия, М., 1967.
- Некрасов Б. В., Основы общей химии, т. 3, М., 1970.
- Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966.
- Краткая химическая энциклопедия, т. 2, М., 1963.
- Левинсон Н. Р., Изделия из цветного и чёрного металла, в кн.: Русское декоративное искусство, т. 1—3, М., 1962—65.
- Вернадский В. И., Биогеохимические очерки. 1922—1932, М. — Л., 1940.
- Благородные металлы. Справочник, под ред. Е. М. Савицкого, М., 1984;
- Борисов С. М., Золото в экономике современного капитализма, М., 1968.
- Бусев А. И., Иванов В. М., Аналитическая химия золота, М., 1973;
- Магакьян И. Г., Рудные месторождения, 2 изд., Ер., 1961;
- Малышев В. М., Румянцев Д. В., Золото, М., 1979;
- Марфунин А. С., История золота, М., 1987.
- Михалевский Ф. И., Золото в период мировых войн, [М.], 1945;
- его же, Золото в системе капитализма после второй мировой войны, М., 1952;
- Паддефет Р., Химия золота, пер. с англ., М., 1982;
- Плаксин И. Н., Золото, в кн.: Краткая химическая энциклопедия, т. 2, М., 1966;
- Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966, с. 439—451;
- Русское золотое и серебряное дело 15—20 веков, М., 1967 (библ. с. 289—93);
- B. C. Стрижко, М. А. Меретуков.
- Ullmanns Enzykiopadie dertechnischen Chemie, 3 Aufl., Bd 8, Munch. — B., 1957, S. 253—307;
- Rosenberg М., Geschichte der Goldschmiedekunst auf technischer Grundlage, Fr./M., 1918.
На правах рекламы (см. условия): ◀ ◀ ◀ Место для размещения коммерческих ссылок (см., пожалуйста, условия) ▶ ▶ ▶ —> Хотите продать золотое кольцо? Скупка Златия поможет
Ключевые слова для поиска сведений о свойствах, добыче и выплавке золота: На русском языке: физические и химические свойства золота, атомные размеры и электронные оболочки Au; На английском языке: gold, Au.
Бриллианты "недорого" В мире существует общепризнанная система ценообразования на бриллианты, это прайс Рапапорта, который обновляется еженедельно. Относительно этого прайса в долларах крупные оптовые покупатели договариваются с производителями на куплю / продажу партий бриллиантов. Прайс Рапапорта не является обязательным к исполнению и даже относительно него для большинства бриллиантов делаются наценки, например, за превосходную огранку, или так называемый "Оверсайз". "Оверсайз" это дополн. Ниже скрин с таблицы цен на 03 апреля 2022 года. Где купить бриллианты в России безопасно и по минимальной цене. Вертикальный столбец — это цвет, выбираем D.
Золото

СТРУКТУРА
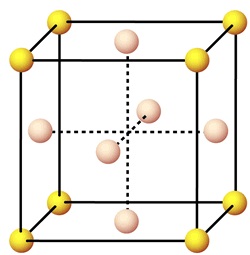
Кристаллическая структура золота
Кристаллизуется в кубической сингонии, в виде октаэдров, ромбододекаэдров, кубов и более сложных по форме кристаллов; нередко они искажены, сильно вытянуты, образуя “проволочки”, “волоски”, или уплощены параллельно грани октаэдра. Для самородного золота особенно низкопробного, характерно многообразие форм роста, оно обычно в виде скелетных кристаллов, дендритов, нитевидных и скрученно-нитевидных кристаллов. Широко распространены прожилковидные и неправильные комковидные, “крючковатые” выделения; на их поверхности нередко сохраняются отпечатки кристаллов других минералов, агрегаты которых включали скопления самородного золота. Травление выявляет кристаллически-зернистое строение золотых частиц.
СВОЙСТВА

Золотые слитки и самородки
Золото — очень тяжёлый металл: плотность чистого золота равна 19,32 г/см³ (шар из чистого золота диаметром 46,237 мм имеет массу 1 кг). Диамагнетик, то есть, магнитное поле в золоте ослабевает. Среди металлов по плотности занимает седьмое место после осмия, иридия, рения, платины, нептуния и плутония. Сопоставимую с золотом плотность имеет вольфрам (19,25). Высокая плотность золота облегчает его добычу, отчего даже простые технологические процессы — например, промывка на шлюзах, — могут обеспечить высокую степень извлечения золота из промываемой породы.
Золото — очень мягкий металл: твёрдость по шкале Мооса ~2,5, по Бринеллю 220—250 МПа (сравнима с твёрдостью ногтя).
Золото также высокопластично: оно может быть проковано в листки толщиной до ~0,1 мкм (100 нм) (сусальное золото); при такой толщине золото полупрозрачно и в отражённом свете имеет жёлтый цвет, в проходящем — окрашено в дополнительный к жёлтому синевато-зеленоватый. Золото может быть вытянуто в проволоку с линейной плотностью до 2 мг/м.
Температура плавления золота 1064,18 °C (1337,33 К), кипит при 2856 °C (3129 К). Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см 3 при температуре плавления. Жидкое золото довольно летучее, и активно испаряется задолго до температуры кипения.
ЗАПАСЫ И ДОБЫЧА

Содержание золота в земной коре очень низкое — 4,3·10 -10 % по массе (0,5-5 мг/т), но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. Один литр и морской, и речной воды содержит менее 5·10 −9 граммов Au, что примерно соответствует 5 килограммам золота в 1 кубическом километре воды.
Золоторудные месторождения возникают преимущественно в районах развития гранитоидов, небольшое их количество ассоциирует с основными и ультраосновными породами.
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). С развитием современных технологий более популярными становятся химические способы.
В 1947 году американские физики Ингрем, Гесс и Гайдн проводили эксперимент по измерению эффективного сечения поглощения нейтронов ядрами ртути. В качестве побочного эффекта эксперимента было получено около 35 мкг золота. Таким образом, была осуществлена многовековая мечта алхимиков — трансмутация ртути в золото. Однако экономического значения такое производство золота не имеет, так как обходится во много раз дороже добычи золота из самых бедных руд.
ПРОИСХОЖДЕНИЕ

Изделия из золота
Самородное золото – главная форма нахождения золота в природе. Оно концентрируется в гидротермальных месторождениях образуя золотые руды, неравномерно распределяясь в трещиноватом жильном кварце и в сульфидах – пирите, арсенопирите, пирротине и др. В существенно сульфидных рудах самородное золото тонкодисперсное. При окислении руд на земной поверхности мелкое самородное золото частично растворяется и переотлагается; в ряде случаев оно обогащает верхние части рудных тел. Процессы их разрушения приводят к освобождению частиц самородного золота и их накоплению в россыпях; перемещаясь водными потоками вместе с другим кластическим материалом, частицы окатываются, округляются, деформируются, частично перекристаллизовываются; в результате электрохимической коррозии на них образуется тонкая оболочка высокопробного золота, что приводит к общему повышению пробы самородного золота в россыпях.
ПРИМЕНЕНИЕ

Где купить бриллианты. Знаете ли вы, что многие потребители ювелирной продукции ориентрируются в своем выборе на мнение других покупателей, уже совершивших покупку в том или ином магазине? Ваш отзыв может стать для кого-то решающим! Добавить магазин. Покупатель! Ваше мнение важно! Оставьте свой отзыв и комментарий о работе ювелирных магазинов своего города! Информация для представителей фирм.
- https://www.garshin.ru/evolution/chemistry/atoms/aurum.html
- https://mineralpro.ru/minerals/gold/