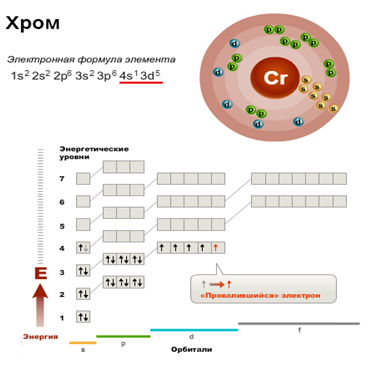
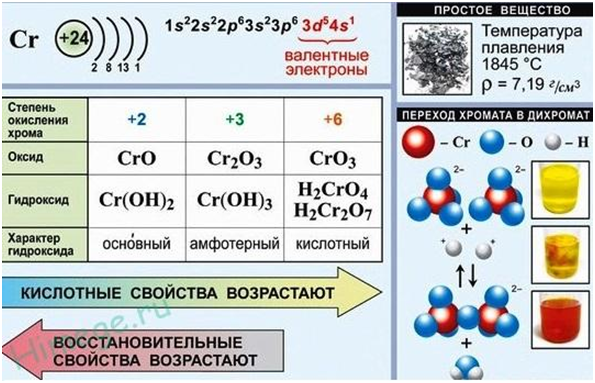
Элемент VI Б группы ПСХЭ. Электронная конфигурация хрома записывается как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 , то есть наблюдается “проскок электрона” (как и для меди). Наиболее часто проявляемые степени окисления хрома: +2, +3 и +6.
Важнейшие соединения хрома
Степень окисления хрома
H 2 CrO 4 – хромовая к-та
H 2 Cr 2 O 7 – дихромовая к-та
Характер оксида и гидроксида
CrO 4 2- хроматы
Cr 2 O 4 2- дихроматы
Химические свойства хрома
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде благодаря защитной оксидной плёнке, образующейся на поверхности металла.
I Взаимодействие с простыми веществами — неМе
- C кислородом реагирует при нагревании более 600 ºС с образованием зелёного оксида хрома (III):
4Cr + 3O 2 = 2Cr 2 O 3
- С хлором и фтором реагирует при более низких температурах (250 и 300 ºС соответственно):
2Cr + 3F 2 = 2CrF 3
ХИМИЯ 9 класс : Хром
2Cr + 3Cl 2 = 2CrCl 3
- С бромом хром реагирует при температуре красного каления (900 ºС):
2Cr + 3Br 2 = 2CrBr 3
- С азотом металлический хром реагирует при температуре выше 1000 ºС:
- С серой хром образует и сульфид хрома (II), и сульфид хрома III), что зависит от пропорций исходных веществ:
2Cr + 3S = Cr 2 S 3
- C водородом хром не реагирует!
II Взаимодействие со сложными веществами
- Взаимодействие с водой
Хром – металл средней активности, поэтому тонкоизмельченный хром при высокой температуре реагирует с водяным паром, образуя оксид хрома (III) и водород:
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2 ↑
- В электрохимическом ряду напряжений металлов хром находится до водорода, поэтому он вытесняет водород из разбавленных хлороводородной и серной кислот, образуя окрашенные в голубой цвет соли хрома (II):
Cr + 2HCl(разб.) = CrCl 2 + H 2 ↑
Cr + H 2 SO 4 (разб.) = CrSO 4 + H 2 ↑
На воздухе катионы Cr 2+ быстро окисляются до Cr 3+ :
4CrCl 2 + O 2 + 4HCl(разб.) = 4CrCl 3 + 2H 2 O
В присутствии кислорода воздуха разбавленные хлороводородная и серная кислоты реагируют с хромом с образованием солей хрома (III):
4Cr + 12HCl + 3O 2 = 4CrCl 3 + 6H 2 O
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании с образованием солей хрома (III) и продуктов восстановления кислот:
2Cr + 6H 2 SO 4 (конц.) = Cr 2 (SO 4 ) 3 + 3SO2 ↑ + 6H 2 O
Cr + 6HNO 3 (конц.) = Cr(NO 3 ) 3 + 3NO 2 ↑+ 3H 2 O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является N 2 :
10 Cr + 36HNO 3(разб) = 10Cr(NO 3 ) 3 + 6N 2 ↑ + 18 H 2 O
- При взаимодействии с сильными окислителями в щелочной среде хром окисляется до степени окисления +6, образуя хроматы:
Cr + KClO 3 + 2KOH = K 2 CrO 4 + KCl + H 2 O
Химические свойства соединений Хрома Cr (+6). Окислительно-восстановительные свойства хрома (+6).
Cr + 3NaNO 3 + 2NaOH = Na 2 CrO 4 + 3NaNO 2 + H 2 O
Соединения хрома (II) и их важнейшие химические свойства
Важнейшие соединения хрома (II) – оксид хрома (II) и гидроксид хрома (II)
Оксид хрома (II) СrO Гидроксид хрома (II) Сr(OH) 2
Оксид хрома (II) CrO и гидроксид хрома (II) Сr(OH) 2 проявляют основные свойства.
Оксид хрома (II) взаимодействует с кислотами с образованием солей:
CrO + 2HCl = CrCl 2 + H 2 O
При обычной температуре оксид хрома (II) устойчив на воздухе, при 1000 ºС окисляется до оксида хрома (VI):
4CrO + O 2 = 2Cr 2 O 3
С разбавленной серной и азотной кислотой, щелочами не взаимодействует.
Гидроксид хрома (II) Cr(OH) 2 – вещество коричневого или желтого цвета, плохо растворяется в воде, проявляет основные свойства, медленно реагирует только с концентрированными кислотами , образуя соли хрома (II) синего цвета :
Cr(OH) 2 + H 2 SO 4 = CrSO 4 + 2H 2 O.
С разбавленными кислотами и щелочами не взаимодействует.
Хороший восстановитель, легко окисляется кислородом воздуха:
4Cr(OH) 2 + O 2 + 2H 2 O = 4Cr(OH) 3
Соединения хрома (III) и их важнейшие химические свойства
Одни из важнейших соединений хрома (III) – оксид Cr 2 O 3 и гидроксид Cr(OH) 3
Оксид хрома (III) Cr 2 O 3 Гидроксид хрома (III) Cr(OH) 3
Взаимодействуют как с кислотами, так и со щелочами, доказывая свою амфотерную природу :
Cr 2 O 3 + 2KOH = 2KCrO 2 + H 2 O – при сплавлении со щелочами
Cr 2 O 3 + 3H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3H 2 O – с кислотами
Cr 2 O 3 + Na 2 CO 3 = 2NaCrO 2 + CO 2 – при сплавлении с карбонатами
Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O – c кислотами
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ] — в растворе со щелочами
При действии кислот хроматы разрушаются. Недостаток кислоты приводит к образованию гидроксида хрома (III):
NaCrO 2 + HCl + H 2 O = Cr(OH) 3 ↓ + NaCl
При избытке кислоты образуются соли:
NaCrO 2 + 4HCl = CrCl 3 + NaCl + 2H 2 O
Соединения хрома (VI) и их важнейшие химические свойства
Оксид хрома (VI) – темно-красное кристаллическое вещество, растворимое в воде.
Оксид хрома (VI) CrO 3
Типичный кислотный оксид , образует кислоты :
CrO 3 + H 2 O = H 2 CrO 4 – хромовая кислота
2CrO 3 + H 2 O = H 2 Cr 2 O 7 – дихромовая кислота
Как типичный кислотный оксид CrO 3 реагирует со щелочами и основными оксидами с образованием хроматов:
CrO 3 + BaO = BaCrO 4
CrO 3 + 2NaOH = Na 2 CrO 4 + H 2 O
H 2 CrO 4 H 2 Cr 2 O 7
Хромовая кислота Дихромовая кислота
Соединения хрома (VI) – сильные окислители!
По теме: методические разработки, презентации и конспекты

Важнейшие классы неорганических соединений, способы их получения и химические свойства. Оксиды.
Особенности программы под редакцией Новошинского И. И. состоят в нетрадиционном подходе к изложению материала (от простого к сложному, от общего к частному). В основе программы лежит идея зависи.

Важнейшие классы неорганических соединений, способы их получения и химические свойства. Основания.
Особенности программы под редакцией Новошинского И. И. состоят в нетрадиционном подходе к изложению материала (от простого к сложному, от общего к частному). В основе программы лежит идея зависи.

Важнейшие классы неорганических соединений, способы их получения и химические свойства. Соли.
Ресурс предназначен для учителей химии, работающих по программе И.И.Новошинского, по которой важнейшие классы изучаются в 2 этапа. Если Вы работаете по другой программе можно объеденить 2 презентации .
Характеристика свойств хрома и его соединений
материал может использоваться при изучении металлов побочных подгрупп.

Химические свойства основных классов неорганических соединений
материал по подготовке к ГИА по химии «Химические свойства основных классов неорганических соединенийhttps://nsportal.ru/shkola/khimiya/library/2020/08/30/himicheskie-svoystv-hroma-i-ego-soedineniy» target=»_blank»]nsportal.ru[/mask_link]
Готовимся к углубленному изучению химии
Элемент хром расположен в четвертом периоде и побочной подгруппе VI группы Периодической системы. Атом хрома имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 . Обратите внимание на провал электрона: подобно другим элементам шестой группы в соединениях хром проявляет максимальную степень окисления +6, однако наиболее устойчив в более низкой степени окисления +3.

Элемент хром был обнаружен в природном минерале в конце XVIII века. Тогда же были получены его соли, яркая и разнообразная окраска которых и объясняет данное элементу название – оно происходит от греческого слова «chroma» — цвет, краска.
НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ
В природе встречается преимущественно в виде двойного оксида – хромистого железняка FeCr2O4, переработкой которого и получают металл. Восстановление хромистого железняка углем в электрических дуговых печах приводит к феррохрому – сплаву железа и хрома:
FeCr2O4+4C−→−t, ∘ CFe+2Cr+4CO
Содержание хрома в нем может достигать 70%. Феррохром используют для производства хромированной стали. Металл не содержащий железа получают восстановлением оксида алюминием:
Cr2O3+2Al−→−t, ∘ CAl2O3+2Cr
Метод алюмотермии был разработан в конце XIX века как раз для производства хрома. Наиболее чистый хром получают электролизом растворов.
ФИЗИЧЕСКИЕ СВОЙСТВА
В свободном виде хром – довольно тяжелый серебристо-белый тугоплавкий (т. пл. 18750C, т. кип. 26800C) металл, обладающий высокой твердостью – он царапает стекло. Чистый хром пластичен, однако даже незначительные примеси кислорода, азота и углерода делают его хрупким. Такой металл при ударе молотком легко раскалывается.
Значительное влияние даже ничтожного количества примесей на физические свойства характерно и для большинства других переходных металлов.
Химические свойства хрома
При комнатной температуре хром малоактивен. В отличие от железа он не окисляется и не тускнеет даже при хранении на влажном воздухе и в воде. С этим качеством хрома связано его использование в борьбе с коррозией железа. Металлический хром используют в виде хромированного покрытия или добавляют при производстве нержавеющей стали. Лишь раскаленный до высокой температуры хром сгорает в кислороде с образованием темно-зеленого порошка оксида хрома(III):
4Cr+3O2=2Cr2O3
Выше 600°C хром реагирует с хлором и бромом, также давая соединения хрома(III).
Хотя в ряду напряжений хром расположен левее водорода, он не окисляется даже на влажном воздухе благодаря образованию на поверхности тонкой прозрачной пленки оксида. В разбавленных кислотах хром растворяется, образуя красивые ярко-синие растворы солей хрома(II), устойчивые лишь в отсутствие кислорода воздуха:
Cr+2HCl=CrCl2+H2
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr+12HCl+3O2=4CrCl3+6H2O
При комнатной температуре хром не реагирует с концентрированными растворами кислот-окислителей – серной и азотной. При нагревании с этими кислотами образуются соли хрома(III):
Подобно многим другим переходным металлам хром образует несколько рядов соединений, отвечающих различным степеням окисления.
СОЕДИНЕНИЯ ХРОМА(II)
Ярко-синие растворы солей хрома(II), образующиеся при растворении металла с разбавленных кислотах в атмосфере азота, на воздухе мгновенно окисляются до хрома(III), что сопровождается изменением окраски на серо-фиолетовую или зеленую:
4CrCl2+O2+4HCl=4CrCl3+2H2O
Cr 2+ – e – -> Cr 3+ |1 4| окисление, CrCl2– восстановитель за счет Cr 2+
O2 0 + 4e – -> 2O 2– |4 1| восстановление, O2 0 – окислитель
4Cr2+O2=4Cr3+2O2
Это свидетельствует о том, что хром в степени окисления +2 является сильным восстановителем.
При действии на соли хрома(II) растворами щелочей выпадает желтый осадок гидроксида, не реагирующий с избытком щелочи, то есть проявляющий основные свойства:
CrCl2+2NaOH=Cr(OH)2↓+2NaCl
Соответствующий ему оксид CrO также является основным.
Соединения хрома(III)
Одно из важнейших соединений хрома(III) – оксид Cr2O3 – представляет собой темно-зеленый порошок, нерастворимый в воде. В природе он встречается в виде минерала хромовой охры. На основе этого вещества изготавливают полировальные пасты.
Оксид и гидроксид хрома(III) реагируют как с кислотами, так и с щелочами, что доказывает их амфотерность. При растворении гидроксида хрома в кислотах образуются соли хрома(III) окрашенные в темно-зеленый или в фиолетовый цвет:
2Cr(OH)3+3H2SO4=Cr2(SO4)3+6H2O
Из фиолетового раствора, полученного добавлением к раствору сульфата хрома(III) сульфата калия на холоду кристаллизуются темно-фиолетовые октаэдрические кристаллы хромокалиевых квасцов KCr(SO4)2 ⋅ 12H2O– двойного сульфата хрома-калия. Раньше их использовали для выделки кож. При действии на раствор хромокалиевых квасцов ортофосфата аммония выпадает зеленый осадок фосфата хрома(III) CrPO4. Соли хрома(III) и слабых кислот – сероводородной, угольной, сернистой, кремниевой – не удается осадить из водных растворов вследствие полного необратимого гидролиза. Если к зеленому раствору хлорида хрома(III) прибавить раствор сульфида натрия наблюдается выделение сероводорода и выпадение серо-зеленого осадка гидроксида:
2CrCl3+3Na2S+6H2O=2Cr(OH)3↓+6NaCl+3H2S↑
При растворении гидроксида хрома(III) в щелочах образуются изумрудно-зеленые растворы хромитов:
Cr(OH)3+3KOH(водн.)=K3[Cr(OH)6]
Сплавлением оксида хрома(III) с щелочами или карбонатами щелочных металлов получают хромиты другого состава, например, NaCrO2:
Cr2O3+2NaOH→−t, ∘ C 2NaCrO2+H2O
При действии кислот хромиты разрушаются:
· при недостатке кислоты превращаясь в гидроксид хрома(III) NaCrO2+HCl+H2O=Cr(OH)3↓+NaCl
· в избытке кислоты образуя соли NaCrO2+4HCl=CrCl3+NaCl+2H2O
· Степень окисления +3 для хрома наиболее устойчива, поэтому соединения хрома(III) могут быть восстановлены до хрома(II) лишь под действием сильных восстановителей:
2CrCl3+Zn=2CrCl2+ZnCl2
Сильные окислители, например, пероксид водорода или бром в щелочной среде переводят соединения хрома(III) в соединения хрома(VI):
2Cr(OH)3+3Br2+10NaOH=2Na2CrO4+6NaBr+8H2O
О протекании реакции свидетельствует появление желтого окрашивания раствора. Хроматы – это соли хромовой кислоты H2CrO4H2CrO4, известной лишь в разбавленных водных растворах.
СОЕДИНЕНИЯ ХРОМА(VI)
Соединения хрома(VI) – сильные окислители . Хромовый ангидрид воспламеняет этиловый спирт, легко окисляет многие органические вещества. Раствор бихромата калия в крепкой серной кислоте называют хромовой смесью. Ее часто применяют в химических лабораториях для мытья посуды. Благодаря входящему в ее состав бихромату хромовая смесь проявляет сильные окислительные свойства.
Убедимся в этом на опыте. Пропустим через хромовую смесь сероводород. Оранжевая окраска раствора быстро сменяется на темно-зеленую, наблюдается выпадение осадка серы:
3H2S+K2Cr2O7+4H2SO4=3S+Cr2(SO4)3+K2SO4+7H2O
Бихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде. Так, при спекании с серой или углем они восстанавливаются:
Na2Cr2O7+S−→−t, ∘ C Na2SO4+Cr2O3
Эти реакции используют для получения оксида хрома(III).
Хроматы и бихроматы некоторых металлов используют в качестве желтых, красных и оранжевых пигментов.
Генетический ряд хрома
Изучение химии соединений хрома в различных степенях окисления позволяет проследить закономерности изменения кислотно-основных и окислительно-восстановительных свойств в ряду Cr(II) – Cr(III) – Cr(VI).
Запомнить! Оксид и гидроксид хрома(II) обладают основными свойствами, соединения хрома (III) амфотерны, а хрома(VI) – кислотные.
Соединения хрома(II) – типичные восстановители, а соединения хрома в высшей степени окисления – типичные окислители. Для соединений хрома(III) окислительно-восстановительные свойства нехарактерны.
Источник: himiy88.blogspot.com
Хром

Хром (лат. Chromium ) Cr — химический элемент VI группы периодической системы; атомный номер 24. Металл серо-стального цвета.
- 1 Природные источники
- 2 Физические свойства
- 3 Применение
- 4 Биологическая роль
Природные источники
По распространенности в земной коре занимает 22-е место. Из минералов наибольшее значение имеет хромитов FeO·Cr2O3. Месторождения в ЮАР, Индии, России, Казахстане, Турции.
Физические свойства
В свободном виде хром — серый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. Это единственное элементарное твердое соединение, которое проявляет антиферромагнитные свойства при комнатной температуре (и ниже). При температуре выше 38 °C он превращается в парамагнетик.
Хром имеет твердость по шкале Мооса 5, твердый из чистых металлов. Очень чистый хром достаточно хорошо поддается механической обработке.
Металлический хром на воздухе пассивируя под действием кислорода, образует тонкий защитный слой поверхностного оксида. Слой, состоящий всего из нескольких атомов толщиной, очень плотный и, в отличие от железа или нелегированной стали, предотвращает диффузию кислорода в материал и возникновение ржавчины. Пассивация может быть повышена путем кратковременного контакта с такой кислотой-окислителем как азотная. Противоположный эффект достигается при обработке сильным восстановителем, который разрушает защитный слой окисла на металле. Хром, обработанный таким способом, легко растворяется даже в слабых кислотах.
Применение
Основной потребитель — металлургия (добавки в сталь). Электролитическое покрытие хромом железных изделий (хромирование) придает им коррозионную стойкость. Хромовые сплавы применяются в машино- и приборостроении.
В текстильной и кожевенной промышленности используется как краситель и как составная часть дубильных растворов.
Биологическая роль
Хром играет важную биологическую роль в организме человека. Он положительно влияет на процессы кроветворения, а также на ферментативные системы. В составе фермента трипсина хром участвует в процессе пищеварения. Учеными установлено, что изъятие хрома из пищевого рациона животных приводит к повышению в крови и моче глюкозы.
Добавление хрома в еду больным диабетом нормализует углеводный обмен. Хром в организм человека попадает с такими продуктами питания, как соя, кукурузная и овсяная крупы. Суточная потребность организма в хроме составляет 5-10 мг.
Источник: cyclowiki.org