Германий (от латинского Germanium), обозначается «Ge», элемент IV-й группы периодической системы химических элементов Дмитрия Менделеева; порядковый номер элемента 32, атомная масса составляет 72,59. Германий — твёрдое вещество с металлическим блеском, имеющее серо-белый цвет. Хотя если честно, иногда он может быть серым как сталь, иногда серебристым, а иногда и вовсе черным. Внешне германий довольно близок к кремнию.
1. В своём докладе о периодическом законе химических элементов в 1869 году русский химик Дмитрий Иванович Менделеев предсказал существование нескольких неизвестных на то время химических элементов, в частности и германия. В статье, датированной 11 декабря (29 ноября по старому стилю) 1870 года, Д. И. Менделеев назвал неоткрытый элемент экасилицием (из-за его местонахождения в Периодической таблице) и предсказал его атомную массу и другие свойства.
В 1885 году в Фрайберге (Саксония) в одной из шахт был обнаружен новый минерал аргиродит. При химическом анализе нового минерала немецкий химик Клеменс Винклер обнаружил новый химический элемент. Учёному удалось в 1886 году выделить этот элемент, также химиком была отмечена схожесть германия с сурьмой.
Германия | Интересные факты про Германию ( 2023 )
Об открытии нового элемента Винклер сообщил в двухстраничной статье, датируемой 6 февраля 1886 года и предложил в ней имя для нового элемента Germanium и символ Ge. В последующих двух больших статьях 1886-1887 гг. Винклер подробно описал свойства германия.
2. Первоначально Винклер хотел назвать новый элемент «нептунием», но это название было дано одному из предполагаемых элементов, поэтому элемент получил название в честь родины учёного — Германии.
4. Металлический германий устойчив на воздухе при комнатной температуре и быстро окисляется при температуре выше красного каления (600-700°С) с образованием двуокиси, твёрдый германий не реагирует с азотом, водородом; жидкий германий при температуре 1000-1100°С взаимодействует с водородом.
5. Температура плавления германия составляет 938,25 °C, а температура кипения 2850 °C.
6. Германий является одним из немногих аномальных веществ, которые увеличивают плотность при плавлении. Плотность твёрдого германия 5,327 г/см3 (25 °С), жидкого — 5,557 г/см3 (1000 °С). Другие вещества, обладающие аналогичным свойством — вода, кремний, галлий, сурьма, висмут, церий.
7. Германий по электрофизическим свойствам является непрямозонным полупроводником.
8. Германий проводит ток не только в стандартном виде, но и в твердых растворах.
9. Слиток германия стоит практически столько же, сколько и слиток золота. Металл очень хрупок, почти как стекло, поэтому, уронив такой слиток, есть большая вероятность того, что металл просто разобьется.
10. Германий устойчив к воздействию растворов соляной и серной кислот, он не вступает во взаимодействие с растворами щелочей. При этом данный металл довольно быстро растворяется в царской водке (семи азотной и соляной кислот), а также в щелочном растворе пероксида водорода.
Германий — Полуметалл, Создающий СКОРОСТНОЙ ИНТЕРНЕТ!
11. Германий был обнаружен на поверхности солнца, а также в составе упавших с космоса метеоритов.
12. Германий — это элемент, который впервые стали применять в Японии для медицинских целей. После многочисленных исследований германийорганических соединений, проводимых на животных, а также в ходе исследований на людях, удалось обнаружить положительное воздействие таких руд на живые организмы. В 1967 году доктору К. Асаи удалось обнаружить тот факт, что у органического германия существует огромный спектр биологического воздействия.
13. Именно этот металл является стимулятором размножения клеток иммунитета. Он, в виде органических соединений, позволяет формировать гамма-интерфероны, которые подавляют размножение микробов.
14. Разведанные запасы германия в мире составляют около 1 000 тонн. Почти половина из них сокрыта в недрах США. Еще 410 тонн — достояние Китая.
15. Годовое производство германия колеблется в пределах 100-120 тонн, в зависимости от спроса.
16. Производство германия в промышленных масштабах в России началось в 1959 году, когда на Медногорском медно-серном комбинате (ММСК) был введён в действие цех переработки пыли. Специалисты комбината под руководством А. А. Бурбы в сотрудничестве с проектным институтом «Унипромедь» разработали и внедрили в производство уникальную химико-металлургическую технологию получения германиевого концентрата путём комплексной переработки пылей шахтных металлургических печей медеплавильного производства и золы от сжигания энергетических углей, служивших топливом для электростанции.
После этого СССР смог полностью отказаться от импорта германия. Впервые в мировой практике было выполнено извлечение германия из медноколчеданных руд. Между прочим, пуск промышленного цеха переработки пыли на ММСК относят к крупнейшим внедрениям в цветной металлургии XX века.
Далее для переработки выпускавшегося на ММСК германиевого концентрата в конечные продукты (чистый германий и его соединения) в 1961-1962 гг. на Красноярском аффинажном заводе (с 1967 г. — Красноярский завод цветных металлов) был создан цех по производству германия. В 1962—1963 гг. цех производил 600 кг монокристаллического германия в год. В 1968-1969 гг., когда внутренние потребности в германии были обеспечены, СССР впервые начал экспортировать диоксид германия, а в 1970 г. начался также экспорт поликристаллического зонноочищенного германия.
17. До конца 1930-х годов германий не использовался в промышленности. Элемент не обладает такой прочностью как вольфрам или титан, он не служит неисчерпаемым источником энергии как плутоний или уран, электропроводность материала также далеко не самая высокая, да и в промышленной технике главным металлом является железо. Несмотря на это, германий является одной из важнейших составляющих технического прогресса нашего общества, т.к. он еще раньше, даже чем кремний стал использоваться как полупроводниковый материал. Сегодня основными потребителями германия являются: 35 % волоконная оптика; 30 % тепловизорная оптика; 15 % химические катализаторы; 15 % электроника; небольшие количества германия потребляет металлургия. Также германий широко применяется в ядерной физике в качестве материала для детекторов гамма-излучения.
18. Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков. Для животных германий малотоксичен. У соединений германия не обнаружено фармакологическое действие.
Допустимая концентрация германия и его оксида в воздухе — 2 мг/м³, то есть такая же, как и для асбестовой пыли.
19. Германий можно отнести к редким микроэлементам. Он присутствует во большом количестве различных продуктов, но в мизерных дозах. Суточная доза потребления органического германия установлено в размере 8-10 мг. Оценка 125-ти пищевых продуктов показала, что ежедневно с пищей в организм поступает около 1,5 мг германия.
Содержание микроэлемента в 1 г сырых продуктов составляет около 0.1 – 1.0 мкг. Германий содержится в молоке, томатном соке, лососине, бобах. Но для того, чтобы удовлетворить суточную потребность в германии, следует выпивать ежедневно по 10 литров томатного сока или употреблять в пищу около 5 килограмм лососины. На территории России около 80-90% населения имеет недостаток германия, именно поэтому были разработаны специальные препараты.
20. Германий препятствует образованию злокачественных опухолей, не дает развиваться метастазам. Органические соединения данного химического элемента способствуют выработке интерферона, защитной белковой молекулы, которая вырабатывается организмом в качестве защитной реакции на появление инородных тел.
Ещё по теме:
Ваш Промблогер №1 Игорь (ZAVODFOTO)!Подписывайтесь на мой канал, я Вам ещё много чего интересного покажу:https://zen.yandex.ru/zavodfoto
На данный момент я уже лично посетил более 400 предприятий, а вот и ссылки на все мои промрепортажи:
Источник: dzen.ru
Германий
Историческая справка
Существование германия («экасилиция») предсказал в начале 1870-х гг. Д. И. Менделеев , он также описал некоторые свойства этого элемента. В 1886 г. К. Винклер выделил из минерала аргиродита новый элемент, который назвал в честь своей родины.
Свойства
Конфигурация внешней электронной оболочки атома германия 4s 2 4p 2 ; в соединениях обычно проявляет степень окисления +4, редко +1, +2, +3 и –4; электроотрицательность по Полингу 2,01; атомный радиус 125 пм, радиус иона Ge 4+ 67 пм ( координационное число 6).
При нормальных условиях германий – светло-серое вещество с металлическим блеском, хрупкое и твёрдое. Существует в виде нескольких полиморфных модификаций; для наиболее устойчивой кристаллической модификации Ge I с кубической решёткой типа алмаза tпл938,3 °C, tкип2820 °C, плотность 5330 кг/м 3 (25 °C). Германий обладает полупроводниковыми свойствами; ширина запрещённой зоны 0,66 эВ (300 К). Прозрачен для ИК-излучения с длиной волны выше 2 мкм.
Германий устойчив в атмосферном воздухе, при сильном нагревании реагирует с кислородом (образуются оксиды GeO2и GeO) и серой (сульфиды GeS и GeS2). При взаимодействии германий с галогенами в зависимости от условий проведения реакции получаются тетрагалогениды (например, тетрахлорид GeCl4) и дигалогениды (например, дииодид GeI2). Германий реагирует с азотной кислотой , горячими растворами щелочей (реакция протекает быстро в присутствии окислителей, например пероксида водорода ). Диоксид GeO2известен в аморфной и двух кристаллических модификациях. Оксиды GeO2и GeО обладают амфотерными свойствами и реагируют с растворами кислот и щелочей. Взаимодействие оксидов германия со щелочами приводит к образованию германатов . Германий образует неустойчивые токсичные газообразные германоводороды, для которых существуют гомологические ряды GenH2n+2, GenH2nи др. (n=1–10). Со многими металлами германий образует германиды, например германид ванадия V3Ge, обладающий сверхпроводящими свойствами, и германид марганца Mn5Ge3, который является ферромагнетиком . Германий образует германийорганические соединения .

Образец германия. Образец германия.
Получение
Применение
Монокристаллический германий используют для изготовления диодов , транзисторов , фотодиодов , термо- и фоторезисторов , детекторов ионизирующих излучений и др. Диоксид GeO2применяют как материал волоконной оптики , а также при изготовлении стёкол , прозрачных для ИК-излучения.
Бердоносов Сергей Серафимович . Первая публикация: Большая российская энциклопедия, 2006.
в 14:25 (GMT+3) Обратная связь
Информация
Области знаний: Общие вопросы химии Символ: Ge Атомный номер: 32 Группа элементов: Неметаллы Относительная атомная масса: 72,64 а. е. м. Радиус атома: 125 пм Электроотрицательность: 2,01 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность при н. у.: 5,33 г/см³ Температура плавления: 938,3 °C Температура кипения: 2820 °C
Источник: bigenc.ru
Германий

Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2,который восстанавливают водородом при 600 °C до простого вещества: GeO2+2H2=Ge+2H2O.
Физические свойства [ ]

Кристаллическая решётка германия кубическая гранецентрированная по типу алмаза, параметр а = 5,660 Å. Германий как и кремний отличается ценными оптическими характеристиками — способность пропускать ИК-лучи. Важно, обладая низкой дисперсией, высокой прозрачностью и коэффициентом преломления n=1,7 (кремний n=3,4) в композициях шихты с кремнием в разных соотнешениях позволяют изготакливать линзы с нужным показателем преломления.(линзы анастигматов и зумов изготавливают в первую очередь с подбором характериситк по показетелю преломления). Линзы, (объективы) прозрачных для (пропускающих) ИК-лучей при изготовлении применяют в качестве основных оптических материалов как кремний, германий.
Механические свойства [ ]
- Скорость звука (t=20÷25°C) в различных напрвлениях ·1000 м/с. [2]
- L100: 4,92
- S100: 3,55
- L110: 5,41
- S110: 2,75
- L111: 5,56
- S111: 3,04
Электронные свойства [ ]
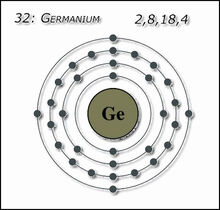
Германий является типичным непрямозонным полупроводником.
Изотопы [ ]
В природе встречается пять изотопов: 70 Ge (20,55% масс.), 72 Ge (27,37%), 73 Ge (7,67), 74 Ge (36,74%), 76 Ge (7,67%). Первые четыре стабильны, пятый ( 76 Ge) испытывает двойной бета-распад с периодом полураспада 1,58×10 21 лет. Кроме этого существует два «долгоживущих» искусственных: 68 Ge (время полураспада 270,8 дня) и 71 Ge (время полураспада 11,26 дня).
Химические свойства [ ]
В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия.
Соединения германия [ ]
Основная статья: Неорганические [ ]
Органические [ ]
- Применение [ ]
Металлургия [ ]
Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо- Ядерная энергетика [ ]
Германий широко применяется в ядерной энергетике в качестве материала для детекторов гамма-излучения.
Электроника и радиотехника [ ]
В радиотехнике, германиевые транзисторы и детекторные [8] (в отечественной радиотехнике известная как блокинг-генератор) позволяет питать трёхвольтовый светодиод от 0,6 светодиодах. В настоящее время германиевые диоды и транзисторы полностью вытеснены кремниевыми и не выпускаются ни в одной стране мира. Найти их можно только в старых радиоаппаратах либо из запасов радиолюбителей тех лет. Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо- [9] и для производства других примесей или химсоединений германия.
Медицина [ ]
- обеспечение перенос кислорода в тканях организма;
- повышение иммунного статуса организма;
- проявление противоопухолевой активности.
В России как оычно биологическое действие германия изучалось давно, но создание первого российского препарата «Гермавит» стало возможным только в 2000 г., когда финансы в развитие науки и, в частности, медицины стали вкладывать российские бизнесмены, понимающие, что здоровье нации требует самого пристального внимания, а его укрепление без должного финансирования — это разговоры, не решающие важнейшей социальной задачи нашего времени.
Оптическое стекло [ ]
Основная статья: Стекло
Основная статья: Оптическое стекло
Германий в виде диоксида GeO2находит широкое применение в изготовлении оптических устройств как линз, объективов и др., применяемых в оптической промышленности.
Свойства оптического стекла из GeO2:
- Коэффициент преломления n=1.7;
- Дополнительно высокая прозрачность к ИК-лучам света;
- Низкая дисперсия;
- Высокая твёрдость.
Это делают его полезным как оптический материал для изготовления широкоугольных объективов, применения линз в оптическом микроскопе.
Смесь кремниевого диоксида и диоксида германия («кварц-germania») используется как оптический материал для оптоволокон и оптических волноводов.
Правильная дозировка примесей диоксида германия с элементами кварца, кремниевыми составляющими и др. при приготовлении шихты при стекловарении позволяет точно контролировать и регулировать величину коэффициента преломления линз. Например, очки из кварца-германия имеют более низкую вязкость и более высокий преломляющий коэффициент, нежели чем очки из чистого кварца.
В оптоволоконном производстве Германий сейчас заменяет титан как примесь кварца для волокна из кварца, устраняя потребность в последующей термообработке, которая делает волокна ломкими. [10]
Прочие области применения [ ]
Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо- [11] и для производства других примесей или химсоединений германия.
Качере Бровина («генератор Бровина-Теслы») [12] лучше работает на германиевых транзисторах.
Цены [ ]
Средние цены на германий в 2007 году /по материалам infogeo.ru/metalls
- Германий металлический $1200/кг
- Германий диоксид (двуокись) $840/кг
Изотопы [ ]
Основная статья: Биологическая роль [ ]
Биологические свойства органического германия:
- обеспечение перенос кислорода в тканях организма;
- повышение иммунного статуса организма;
- проявление противоопухолевой активности. [13]
Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Для животных германий малотоксичен. Допустимая концентрация германия и его оксида в воздухе — 2 мг/м 3 , т.е. такая же, как и для асбестовой пыли.
Соединения двухвалентного германия значительно более токсичны [14] .
См.также [ ]
- Названия химических элементов на различных языках
- Кремний
- Углерод
Литература [ ]
- Тананаев И. В., Шпирт М. Я. Химия германия. М., «Химия», 1967. 451 с.
Ссылки [ ]
- ↑БСЭ
- ↑ Физические величины: справочник/ А. П. Бабичев Н. А. Бабушкина, А. М. Бартковский и др. под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991. — 1232 с — ↑ Физические величины: справочник/ А. П. Бабичев Н. А. Бабушкина, А. М. Бартковский и др. под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991. — 1232 с — ↑ Баранский П. И., Клочев В. П., Потыкевич И. В. Полупроводниковая электроника. Свойства материалов: Справочник. Киев: Наукова думка, 1975. 704с
- ↑ Зи С. Физика полупроводниковых приборов. М.:Мир, 1984. 455с
- ↑ Зи С. Физика полупроводниковых приборов. М.:Мир, 1984. 455с
- ↑ Зи С. Физика полупроводниковых приборов. М.:Мир, 1984. 455с
- ↑Схема «Juole Thief» на YouTube
- ↑ Thiele, Ulrich K. (2001). «The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation». International Journal of Polymeric Materials 50 (3): 387 – 394. doi:10.1080/00914030108035115.
- ↑ Chapter Iii: Optical Fiber For Communications
- ↑ Thiele, Ulrich K. (2001). «The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation». International Journal of Polymeric Materials 50 (3): 387 – 394. doi:10.1080/00914030108035115.
- ↑http://rutube.ru/tracks/1503118.html?v=f0656e31d26aa1fb6631fa006e6db8ee
- ↑http://www.medlinks.ru/article.php?sid=7233
- ↑ Назаренко В.А. Аналитическая химия германия. М., Наука, 1973. 264 с.
- Германий на Webelements
- Германий в Популярной библиотеке химических элементов
Источник: science.fandom.com