Лиофобная коллоидная система состоит из частиц, составляющих дисперсную фазу – мицелл и дисперсионной среды – интермицеллярной жидкости. Для представления структур коллоидных мицелл применяют мицеллярные формулы.
Рассмотрим порядок написания таких формул на примере коллоидной частицы хлорида серебра, полученного реакцией обмена:
Структура мицеллы AgCl будет определяться концентрацией компонентов AgNO3 и KCl, т.е. тем, какой компонент взят в избытке. При этом может быть в избытке AgNO3 (1 случай) или KCl (случай 2), или концентрации AgNO3 и KCl равны (случай 3).
Рассмотрим случай 1:
а) записывают формулу основного вещества – ультрамикрокристалла AgCl, состоящего из «m» молекул AgCl в квадратных скобках m[AgCl];
б) определяют, исходя из избытка компонента, потенциалопределяющие ионы, которые согласно правилу ионной адсорбции (правилу Пескова-Фаянса) должны быть родственными с твердой поверхностью, т.е. с ультрамикрокристаллом. В нашем случае это ионы «nAg + »;
Коллоидные растворы. Дисперсные системы
в) ультрамикрокристалл вместе с потенциалопределяющими ионами образует ядро мицеллы m[AgCl]nAg + ;
г) за ядром записывают противоионы адсорбционного слоя, т.е. ионы NO3ˉ, их число будет (n – x). Ядро и противоионы адсорбционного слоя образуют гранулу мицеллы, которая заключается в фигурные скобки и несет на себе заряд, отвечающий заряду потенциалопределяющих ионов; за гранулой записывают противоионы диффузного слоя. В целом эта структура носит название мицеллы.

3ˉ> х + хNO3ˉ

ядро

гранула
Во 2 случае при избытке KCl формула мицеллы будет иметь вид:
В случае 3 система находится в изоэлектрическом состоянии и гранула не имеет заряда. Формула мицеллы имеет вид:
Представить формулу мицеллы почвенного коллоида гидрозоля кремниевой кислоты, если гранула при электрофорезе перемещается к аноду.
Основное вещество, образующее ультрамикрокристалл, это H2SiO3(SiO2·nH2O). Гранула перемещается к аноду, следовательно, она несет отрицательный заряд. Молекулы H2SiO3 частично диссоциируют на ионы: H2SiO3 ↔ 2Н + + SiO3 2ˉ , из которых SiO3 2ˉ будут потенциалопределяющими, а противоионами будут Н + . Формула мицеллы будет иметь вид:
Составить формулу мицеллы и обозначить ее составные части, если она получена реакцией обмена между 20 мл раствора Ba(NO3)2, молярная концентрация эквивалента которого С(1/2 Ba(NO3)2) = 0,001 моль/л и 20 мл раствора Nа2SO4, С(1/2 Nа2SO4) = 0,02 моль/л.
Рассчитаем число моль-эквивалентов компонентов Ba(NO3)2 и Nа2SO4 для того, чтобы определить, какой из них взят в избытке:
n Ba(NO3)2 = 20 · 0,001 = 0,02 ммоль;
n Nа2SO4 = 20 · 0,02 = 0,4 ммоль(избыток).
Уравнение реакции Ba(NO3)2 + Nа2SO4 = ВаSO4↓ + 2 NаNO3показывает, что труднорастворимое вещество и составляет основное вещество мицеллы, формула которой такова:
5.4. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразования
m[ВаSO4]n SO4 2 ˉ2(n – x)Nа + > 2х- 2хNа + .
Устойчивость коллоидных систем. Коагуляция и ее закономерности.
Агрегативная устойчивость – способность дисперсной системы сохранять неизменными размеры частиц дисперсной фазы. Однако большинство дисперсных систем обладают избытком поверхностной энергии, следовательно, в них могут самопроизвольно идти процессы укрупнения частиц. Такие системы называют агрегативно неустойчивыми.
Коагуляция – процесс потери агрегативной устойчивости коллоидных систем за счет слипания частиц и их укрупнения. Коагуляция зависит от изменения температуры, механических воздействий, концентрации системы, действия электролитов. Коагуляция вызывает увеличение мутности раствора, изменение окраски раствора, увеличение осмотического давления, возрастание вязкости.
Порог коагуляции (или критическая концентрация мицеллообразования) – наименьшая концентрация электролита γ, при которой начинается коагуляция:

γ = ·1000, моль/л, (6.1)
где Cэ, Vэ – концентрация и объем электролита соответственно;
Влияние электролитов на устойчивость дисперсных систем изучено Г. Шульце (Германия) и У. Гарди (Англия). Они установили, что:
1. Коагуляцию вызывает либо катион, либо анион электролита. Этот ион получил название иона-коагулянта.
2. Коагулирующее действие иона-коагулянта зависит от его заряда: чем больше заряд иона-коагулянта, тем его коагулирующее действие больше, а порог коагуляции меньше.
3. Знак заряда гранулы золя противоположен знаку заряда коагулирующего иона.
Золь иодида серебра, получаемый по реакции:
при некотором избытке KJ, коагулируют растворами нитрата калия и ацетата кальция. Коагулирующее действие какого электролита сильнее?
Мицелла золя будет иметь следующее строение:
m[AgJ]nJˉ(n – x)К + > х- хК + .
По правилу Шульце-Гарди определяем ионы-коагуляторы. Исходя из знака заряда гранулы (он отрицательный), следует, что ионы-коагуляторы – катионы, т.е. Са 2+ и К + . Для сравнения коагулирующего действия сравниваем заряды катионов. Коагулирующее действие ацетата кальция Са(СН3СОО)2 будет сильнее.
Почвенный коллоидный гидрозоль кремниевой кислоты объемом 100 мл подвергается коагуляции нитратом калия (V = 10 мл, С(КNO3) = 0,01 моль/л) и хлоридом железа (V = 10 мл, С(1/3 FeCl3) = 0,01 моль/л). Представить формулу мицеллы и определить направление движения гранулы при электрофорезе.
Рассчитаем пороги коагуляции электролитов:
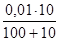
γ (КNO3) = · 1000 = 9,09 ммоль/л,
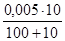
γ (FeCl3) = · 1000 = 0,05 ммоль/л.
Из сравнения зарядов анионов NO3ˉ и Clˉ пороги коагуляции, если бы они вызывали коагуляцию, были бы равны. По расчету это не так, следовательно, коагуляцию вызывают катионы К + и Fe 3+ . Значения порогов коагуляции подтверждают правило Шульце-Гарди (заряд Fe 3+ > К + , а порог коагуляции 0,05 < 9,09). По правилу Шульце-Гарди знак заряда гранулы противоположен знаку заряда коагулирующего иона, т.е. гранула гидрозоля кремниевой кислоты отрицательна. Формула мицеллы имеет вид:
Растворы высокомолекулярных соединений (ВМС)
Основной признак ВМС – высокая молекулярная масса (не менее 10000). По ряду свойств растворы ВМС сходны с коллоидными, а именно:
— малая скорость диффузии;
— небольшое осмотическое давление;
— не проходят через полупроницаемые мембраны.
Однако растворы ВМС имеют молекулярную природу и являются не золями, а истинными, гомогенными системами. Отличия от коллоидных систем заключаются в следующем:
— растворы ВМС образуются самопроизвольно и в стабилизаторе не нуждаются;
— растворению ВМС предшествует процесс набухания. Степень набухания α может быть рассчитана по формуле:
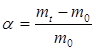
, (6.2)
где m0 – навеска полимера до набухания, г;
mt – навеска полимера после набухания к данному моменту времени, г.
При ограниченном набухании рассчитывают скорость набухания:

, (6.3)
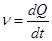
где — скорость набухания;
k – константа скорости набухания, зависящая от природы полимера, природы растворителя и температуры;
Qmax – предельное набухание;
Qt – набухание к данному моменту времени.
Расчет константы набухания проводят по уравнению:

. (6.4)
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.012 с) .
Источник: studopedia.org
Гранула и мицелла
Процесс химического образования частиц дисперсной фазы очень сложен, но упрощенно его можно описать следующим образом. Для этого рассмотрим последовательность роста и изменения частиц золя на примере хлорида серебра AgCl. Этот золь получается при медленном ириливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgN03, взятому в избытке. Если ввести сразу большую порцию раствора NaCI, то мгновенно выпадет осадок хлорида серебра и золь нс получится. Реакция протекает по уравнению

При постепенном проливании раствора NaCl к раствору AgN03 в первый момент из ионов Ag‘ и CI образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl),, начинает адсорбировать на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны кристаллической решетке ядра) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag + агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата и придающие частице заряд, называют потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристаллов AgCl. Таким образом, агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl),, вместе с потенциалопределяющими ионами Ag + составляет ядро частицы. К заряженному ядру притягиваются ионы противоположного заряда — противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата) — нитрат-ионы NO;r Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За слоем противоионов следует диффузный слой, состоящий из тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную гидратную (сольватную) оболочку.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя образует мицеллу. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы элекгронейтральна.
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося удалить их (из мицеллы) и распределить в дисперсионной среде.
Формулу мицеллы гидрозоля хлорида серебра записывают гак:

В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. 8.7. Подобный механизм мицеллобразова- ния относится к лиофобным коллоидам.

Рис. 8.7. Строение мицеллы хлорида серебра
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата w(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке, с образованием слоя потен- циалопределяющих ионов, а в качестве противоионов адсорбционного и диффузного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой

Основу мицеллы составляет нерастворимое ядро, микрокристалл или агрегат из микрокристаллов. Многозарядные ионы ведут себя сложнее.

Рассмотрим другие наиболее важные для обсуждения природных процессов примеры образования дисперсной фазы. Прильем к раствору хлорида железа FeCl3 по каплям раствор гидроксида натрия NaOH до помутнения раствора или появления хлопьев малорастворимого тригидроксида железа FeCOHV,:
В слой потенциалопределяющих ионов могут входить нс только ионы Fe 3+ , а также и образующиеся при гидролизе ионы Fe(OH) 2+ , Fe(OH)2 и др. Примерно такое же строение имеет мицелла А1(ОН)3.
При медленном ириливании раствора хлорида железа к раствору гидроксида натрия образование мицеллы протекает намного сложнее, но можно предположить, что гидроксид-ионы являются потенциалоиределяющими, а ионы натрия входят в состав адсорбционного и диффузного слоев.
Формула мицеллы кремниевой кислоты, образующейся при ириливании к раствору силиката натрия (избыток) кислоты, может быть выражена так:

Мицелла — это частица дисперсной фазы золя. Ядро состоит из нерастворимого в данном растворе вещества и может включать как один микрокристалл, так и несколько или иметь аморфную структуру. В поверхностный слой кроме ионов раствора входят также молекулы окружающей жидкости и молекулы и ионы других веществ (например, стабилизаторов). В адсорбционный слой кроме ионов одного знака входят также частично ионы другого знака (противоионы). Состав мицеллы зависит от многих факторов: концентраций веществ раствора, ионной силы раствора, природы посторонних веществ, скорости образования ядра и частицы, интенсивности перемешивания, температуры, освещения и др.
Диффузный слой окружает гранулу в виде ионного облака, плотность которого понижается по мере удаления от ядра. Диффузный слой препятствует сближению и объединению частиц. Толщина диффузного слоя зависит не только от концентрации в растворе ионов, входящих в диффузный слой, но и от общей концентрации ионов в растворе и от ионной силы раствора.
Толщина адсорбционного слоя составляет 10 10 8 см, а диффузного слоя — порядка 10 _/i см. Под воздействием внешних факторов возможно изменение толщины диффузного слоя и содержания ионов в нем, на чем основано регулирование свойств дисперсных систем. Определение заряда гранулы и его величины имеет большое значение для объяснения и предсказания поведения дисперсных систем.
Состав мицелл зависит от вида и концентрации находящихся в растворе ионов и молекул, скорости образования частицы, перемешивания и других факторов. Мицеллы с многозарядными ионами ведут себя еще сложнее.
Источник: studme.org
Мицелла: строение, схема, описание и химическая формула

Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.

Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.

Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
- Ионный обмен: NaCl + AgNO3 = AgCl↓ + NaNO3.
- Окислительно-восстановительные процессы: 2H2S + O2 = 2S↓ + 2H2O.
- Гидролиз: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S.
Условия проведения химической конденсации
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:

Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды.
Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва 2+ . Со слоем потенциалопределяющих ионов связано 2(n — x) ионов Cl — . А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.

Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO4 2- , а противоионами – Na + . В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Запись мицеллы
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:

Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:

Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли — Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Влияние концентрации на форму мицеллы
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).

Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку.
Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Источник: fb.ru