1. Введение
2. История серебрения
3. Область применений серебряных покрытий
4. Подготовка украшений перед серебрением
5. Гальванический способ серебрения
6. Химический способ серебрения
7. Другие способы серебрения
8. Заключение
9. Список литературы
Файлы: 1 файл
Министерство образования и науки российской федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
МАГНИТОГОРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ ИМ. Г.И. НОСОВА
Институт строительства, архитектуры и искусства
Кафедра общетехнических дисциплин
Реферат на тему:
Выполнила студентка 4 курса
42 группы Столярик Ю. А.
Царские ювелирные изделия 56 пробы.Красота и великолепие украшени наших бабушек/Vintage Russian Gold
Проверил: к. п. н., профессор
Магнитогорск, 2014 г.
2. История серебрения
3. Область применений серебряных покрытий
4. Подготовка украшений перед серебрением
5. Гальванический способ серебрения
6. Химический способ серебрения
7. Другие способы серебрения
9. Список литературы
Серебряные покрытия занимают первое место по популярности среди всех покрытий из драгоценных металлов. В ювелирной промышленности, являющейся одним из главных потребителей серебра, одной из основных характеристик является декоративный вид серебряных покрытий.
Можно привести десятки примеров серебрения поверхностей. Например, восстановление слоя серебра на мельхиоровых столовых приборах, серебрение самоваров и других предметов быта. Для чеканщиков серебрения вместе с химическим окрашиванием металлических поверхностей – способ увеличения художественной ценности чеканных картин.
Представьте себе отчеканенного древнего воина, у которого посеребрена кольчуга и шлем. Сам процесс химического серебрения можно провести с помощью растворов и паст. Последнее предпочтительнее при обработке больших поверхностей (например, при серебрении самоваров или деталей крупных чеканных картин).
Серебряные изделия обладает хорошими декоративными свойствами, поэтому серебрение зачастую используется в качестве декоративного покрытия, в том числе с последующим оксидированием или покрытием прозрачными лаками. Используется серебрение для ювелирных изделий и предметов декора [3].
Толщина слоя серебра в результате серебрения может варьироваться от 2 до 30 мкм. Поверхность, покрытая серебром, отличается высокой отражательной способностью, а также обеспечивает хороший электрический контакт [4].
В настоящее время (2014 г.) практически все бытовые зеркала и зеркала оптических приборов получают напылением плёнки алюминия на стекло или пластмассы (CD-диски, металлизированные полиэфирные плёнки и др.) в вакууме, этот процесс не совсем корректно также иногда называют «серебрением» [3].
СЕРЕБРЕНИЕ Латуни и Меди! Покрываем СЕРЕБРОМ Циферблат и Ювелирные Изделия!
Технология изготовления стеклянных зеркал впервые была изобретена и широко использовалась в Европе начиная с 16–го века. Тогда при производстве зеркал применялась амальгама олова. Получающиеся зеркала имели не очень высокий коэффициент отражения света и их производство было очень вредным, рабочие подвергались хроническому отравлению ртутью из-за вдыхания её паров.
В начале 19–го века был изобретён химический метод осаждения плёнки серебра на стеклянные поверхности. Сущность этого метода заключается в восстановлении водорастворимог о соединения серебра (обычно нитрата серебра в водном растворе аммиака) до металла каким-либо органическим восстановителем, например, формальдегидом или г люкозой (реакция серебряного зеркала). Для улучшения сцепления плёнки серебра со стеклом, поверхность стекла перед нанесением серебра обрабатывают тетрахлоридом олова. Химический способ серебрения очень быстро вытеснил амальгамный метод изготовления зеркал [5].
Преимущества химического серебрения – простота и доступность метода, – не требуются дорогие и громоздкие вакуумные установки . Недостатки – в воздухе плёнка серебра постепенно тускнеет из-за образования на её поверхности слоя сульфида серебра при взаимодействии со следами сероводорода, всегда присутствующего в ничтожных концентрациях в воздухе с слоем металлического серебра зеркала, что постепенно снижает коэффициент отражения. Для снижения потускнения зеркал слой серебра в бытовых зеркалах, где плёнка серебра нанесена с другой стороны стеклянной пластины, покрывают защитным лаком. Такая защита не может применяться на зеркалах оптических инструментов, например, зеркалах телескопов- рефлекторов, поэтому, до развития технологии вакуумного напыления пленок алюминия, зеркала телескопов после нескольких лет эксплуатации серебрили заново.
Сейчас технология химического серебрения практически полностью вытеснена технологией вакуумного напыления металлов, обычно алюминия. Иногда, в ответственных и специальных применениях, вместо алюминия в процессе вакуумного напыления применяют индий, золото, другие металлы.
Хотя в процессе изготовления зеркал сейчас очень редко используется серебро, часто этот процесс продолжают называть «серебрением», более точные термины – «вакуумное алюминирование», «вакуумное термическое напыление металла» [3].
Область применений серебряных покрытий
В электротехнических целя. Наибольшим спросом пользуется серебрение меди или латуни – как правило, контактов или медных шин.
В данном случае наиболее востребованными являются такие свойства серебряных покрытий как высокая электрическая проводимость, а также высокая химическая стойкость.
В декоративных целях. Серебрение обладает хорошими декоративными свойствами и часто используется в качестве декоративного покрытия, в том числе с последующим оксидированием или покрытием прозрачными лаками.
Серебром покрывают как ювелирные украшения, так и предметы декора или практически любые потребительские товары.
В гальванопластике. Изготовление серебряных изделий методом гальванопластики нашло широкое применение не только при производстве волноводов и сложных деталей радиотехнической промышленности, но и в сувенирной отрасли [7].
Подготовка украшений перед серебрением
В процессе нанесения серебра на различные металлы одним из самых важных является вопрос подготовки поверхности изделий перед серебрением. Малейшая ошибка приводит к недостаточному «прилипанию» слоя серебра на изделия, а иногда и вовсе к отслоению только что нанесённого покрытия. Наиболее эффективно эта проблема решается при помощи электролитов предварительного серебрения. Серебро является мягким металлом и легко подвергается истиранию. Для снижения износостойкости серебра применяются электролиты позволяющие осаждать различные сплавы, например с сурьмой или палладием, повышающие стойкость серебряного покрытия к истиранию.
Серебро значительно дешевле золота и поэтому с целью недопущения протирания покрытия при носке можно наносить сравнительно более толстые покрытия. Возможно введение в состав серебра легирующих добавок, например сурьмы, с целью увеличения твёрдости и износостойкости.
Известна способность серебра к потемнению под воздействием следов сероводорода с образованием на поверхности тёмных слоев. Для борьбы с этим явлением применяется палладирование и р одирование. Но это изменяет внешний вид изделия, так как эти металлы имеют иной, отличный от серебра цвет. Есть ещё возможность произвести хроматирование и нанести хроматный слой, но он имеет малую механическую устойчивость и может быть полезен только пока изделие не контактирует с руками или лежит на прилавке и ждет покупки, а при начале эксплуатации защитный слой за месяц стирается [6].
Подготовка украшения для серебрения начинается с обезжиривания в органическом растворе, который состоит из четыреххлористого углерода или бензина. Время обезжиривания колеблется от 3 до 20 минут, в зависимости от размеров изделия и концентрации раствора. Обезжиривание позволяет удалить минеральные жиры, которые могут присутствовать на украшении.
Затем, для удаления с поверхности жирной пленки, украшение подвергается еще и электрохимической обработке в электролите. Для этого используется едкий натр (20-30 г/л), кальцинированная сода (20-30 г/л), тринатрийфосфат (50-60 г/л), жидкое стекло (5-10 г/л). Температура электролита должна составлять порядка 80°С, плотность тока 3- 10 А/дм2. Обработка длится от 2 до 15 минут.
Если украшение имеет паянные оловянистые припои, то его химическая обработка проводится в подогретом электролите того же самого состава. После чего изделие необходимо промыть в горячей (80-90 °С) и холодной проточной воде.
Декапируют (очищают) изделие в водном растворе цианистого калия, который готовится из расчета 30-40 г/л цианистого калия, его температура должна составлять 18-25°С, продолжительность обработки достигает 30 секунд. Для предотвращения контактного выделения серебра на изделиях при погружении их в рабочую ванну, их амальгируют или подвергают предварительному серебрению. Амальгамирование происходит в растворе цианистого калия, который готовится из расчета 60-70 г/л цианистого калия. Туда же добавляется оксид ртути, примерно 6-8 г/л. Изделие обрабатывается примерно 5 секунд при температуре 15-25°С http://anytech.narod.ru/ag-el. htm.
Гальванический способ серебрения
Серебрение, нанесение на поверхность изделий слоя серебра (толщиной обычно от долей мкм до 30 мкм) для защиты от коррозии в агрессивных средах, повышения электропроводности, отражательной способности, антифрикционных свойств, снижения переходного электросопротивления, а также в декоративных целях; покрытие из серебра может с тужить в качестве подслоя при осаждении других благородных металлов. Серебрение осуществляют главным образом гальваническим способом с использованием цианистых электролитов, обеспечивающих высокое качество покрытий; бесцианистые электролиты в виде других комплексных солей серебра применяются лишь в исключительных случаях.
Гальванотехника – это область прикладной электрохимии, охватывающая процессы электролитического осаждения металлов на поверхность металлических и неметаллических изделий. Рассмотри на конкретном примере принцип гальванического процесса (рис. 1).
Рисунок 1. Схема процесса гальванического серебрения
Для серебрения латунной ложки её помещают в ванну с раствором соли серебра и подключают к отрицательному полюсу источника постоянного тока. В эту же ванну опускают серебряную пластину приблизительно такой же, как у ложки, площади и присоединяют её к положительному полюсу источника тока.
При протекании тока через электролит положительные ионы серебра движутся к отрицательному полюсу, т. е. к латунной ложке, получают на её поверхности недостающие электроны и осаждаются уже в виде нейтральных атомов. Одновременно на катоде (серебряной пластине) новые атомы серебра превращаются в ионы и переходят в раствор.
В гальванотехнических процессах особо важную роль играет анод, основное назначение которого – восполнять в электролите ионы, разряжающиеся на покрываемых изделиях. Анод не должен содержать примесей, отрицательно влияющих на внешний вид и структуру покрытий. Все процессы как гальванопластики, так и гальваностегии протекают в гальванических ваннах. Материалом ванны в зависимости от её размеров и степени агрессивности электролита могут служить: керамика, эмалированный чугун, футерованная свинцом сталь, органическое стекло и др. Ёмкость ванн колеблется от долей мі (для золочения) до 10 мі и более. Гальванической ванной называют также состав находящегося в ней электролита [8].
Для предварительного серебрения используется электролит, в состав которого входит цианистое серебро (1,5-4 г/л) и цианистый калий (90 г/л). Электролиз протекает при температуре раствора 18-25°С и плотности тока 1-8 А/дм2 в течение 1-4 минут. Осаждение серебра производится в цианистых электролитах, которые благодаря своим высоким технологическим свойствам имеют крайне широкое практическое применение.
Все цианистые методы серебрения происходят при анодах из чистого серебра в электролитах, в состав которых входят: цианистое серебро (50-60 г/л), цианистый калий (40-50 г/л), углекислый калий (40- 50 г/л). Состав может быть и таким: цианистый калий (35-45 г/л), хлористое серебро (30-35 г/л), углекислый калий (40-50 г/л). Температура электролита должна составлять 18-25°С, плотность тока от 0,1 до 0,5 А/дм2.
Если необходимо получить блестящее серебряное покрытие, то в состав электролита может быть введена блескообразующая добавка — тиосульфат натрия или сероуглерод. У цианистого метода серебрения есть и один существенный недостаток: его высокая токсичность. Именно поэтому были разработаны электролиты, которые не содержат в себе цианистого калия.
Вот примеры двух нецианистых составов электролита. Первый выглядит так: хлористое серебро (40 г/л), железистосинеродистый калий (200 г/л), поташ (20 г/л). Температура этого электролита должна составлять от 25 до 60°С, а плотность тока — 1-1,5 А/дм2.
Второй состав такой: азотнокислое серебро (60-70 г/л), трилон Б (70-100 г/л), едкий натр (15-18 г/л), азотнокислый аммоний (32-40 г/л), гидроокись аммония (до рН 9,5-10,5). Его температура — 18-25°С, плотность тока — 0,3-0,8 А/дм2.
После покрытия серебром и промывки изделия, его подвергают кранцовке латунными щетками с раствором кальцинированной соды из расчета 5-10 г/л. Эта операция производится для того, чтобы создать уплотнения серебристого слоя и выявить дефекты покрытия типа отслоений, оголенных участков и т. д. После кранцовки снова происходит промывка в горячей (до 90°С) и холодной проточной воде, с многократным погружением в ванну. Каждая операция занимает от 3 до 5 секунд. Сушат изделия в специальных сушильных шкафах при температуре 70-110°С [2].
Химический способ серебрения
Способ химического покрытия одного металла другим дает достаточно прочное покрытие, хотя еще далеко не такое прочное, как плакирование, покрытие через огонь или гальваническое. Основан этот способ на легкости, с которой серебро восстанавливается из растворов его солей в присутствии других металлов. Если в раствор соли серебра погрузить, например, цинк или медь, то соли эти постепенно разлагаются и выделяют соответственно металлическое серебро, которое постепенно осаждаются на цинк или медь и покрывает их. Поэтому серебрение достигается при этом способе простым погружением данного металла в раствор серебра.
Источник: www.yaneuch.ru
Серебрение ювелирных изделий

Серебрение ювелирных изделий – это не только возможность сделать предметы более эстетичными, но и способ придания им дополнительных качеств. Благодаря покрытию серебром, обеспечивается большая коррозионная стойкость вещи, ее электропроводимость, способность отражать.
Чем хороша гальваника
В современном производстве для обработки украшений и иных предметов используется гальванообработка. Такая технология представляет собой электрохимический тип нанесения покрытий на различный материал. Цель данного процесса – придание декоративных и защитных свойств обрабатываемому предмету, который может быть изготовлен как из благородных металлов, так и из латуни или бронзы.
Это один из самых надежных видов серебрения. Слой покрытия достигает в толщину около 10-20 микрометров, что позволяет произвести несколько полировок изделия. С помощью них улучшается внешний вид – мастера работают над такими параметрами, как:
Серебрение позволяет и существенно увеличить долговечность вещи за счет антикоррозийных качеств. К тому же такое защитное покрытие не только убережет предмет от потемнения и окисления, но и придаст ему яркость благодаря полирующему эффекту.
Серебрение ювелирных изделий в Москве
Серебрение – услуга достаточно редкая, поскольку она требует определенного оборудования и, конечно, знаний мастеров. После обработки предмет должен выглядеть натурально, его окрас не должен быть пятнистым, неравномерным.
Поэтому мы много внимания уделяем контролю качества посеребренных вещей – проверяется толщина слоя, состояние поверхности, выискиваются неровности и подтеки, участки с отсутствием блеска и т.д. Таким образом, каждое готовое творение обработано идеально, с ювелирной точностью.
Долговечность серебряного покрытия зависит от частоты использования украшения или другой вещи. В среднем такого защитного декорирования хватает от пары месяцев до нескольких лет. При этом цена гальванической обработки зависит от:
- ее сложности;
- степени повреждения предмета;
- некоторых других факторов.
Серебрение | Механизм и метод гальванического процесса. Структура и свойства серебряных покрытий.
Серебро — мягкий, пластичный и ковкий драгоценный металл снежно-белого цвета. Стандартный электродный потенциал серебра по разным источникам равен 0,799-0,81 В, а его электрохимический эквивалент составляет 4,025 г/(А*ч).
Серебро имеет атомную массу 107,88, плотность 10,49 кг/м 3 и температуру плавления 960,5°С. Теплопроводность серебра в пределах от 0 до 100°С равна 1 кал/(с*см*°С), удельное сопротивление 0,016 Ом*мм. Из всех металлов оно обладает наилучшей тепло- и электропроводимостью.
вердость самородного серебра равна 26 кгс/мм 2 . Микротвердость гальванически осажденных серебряных покрытий возрастает до 590-1370 МПа, а при наличии специальных добавок, вводимых в электролит серебрения, микротвердость возрастает еще в 1,5 — 2 раза.
Насколько серебро химически стойко?
Серебро растворяется в концентрированной азотной кислоте, царской водке, горячей 85% серной кислоте. Серебро неустойчиво в растворах аммиака. Кислород окисляет серебро только при давлении 1,5 МПа и температуре 300° С. Серебро быстро тускнеет в промышленной атмосфере в присутствии одновременно сернистых соединений, кислорода и влаги, покрываясь пленкой сульфидов коричневого и темно-серого цвета. Особенно активно в этом отношении гальванически осажденное серебро. Также серебро может тускнеть в присутствии органических серосодержащих материалов, если длительное время будет находиться вместе с ними в непроветриваемом помещении.
Таблица – Характеристики покрытия серебром
Ср1; Ср3; Ср6; Ср9; Ср12; Ср15; Ср18; Ср21; Ср24; Ср27; Ср30 и тд; — стандартное серебрение
Ср3.крц; Ср6.крц; Ср9.крц; Ср12.крц; Ср15.крц; Ср18.крц; Ср21.крц; Ср24.крц; Ср27.крц; Ср30.крц и тд; — серебрение с крацеванием
silver coating — англ. обозначение
3-50мкм (оптимально, возможна и большая толщина)
883-1370 МПа, которая в течение времени может уменьшаться до 558 МПа
Удельное электрическое сопротивление при 18 ° C
Допустимая рабочая температура
Заметное изменение цвета поверхности серебра начинается с толщины сульфидов от 40 нм. При этом максимальная толщина сульфидной пленки составляет 0,3 мкм. Сами по себе пленки сульфида серебра термостойки до 885° С, не растворятся в кислотах и аммиаке, но неустойчивы в 5-10% цианидах.
Химическая активность серебряных покрытий возрастает на шероховатой поверхности.
Серебро устойчиво в соляной кислоте, щелочах, сухом сероводороде. По коррозионной стойкости оно приближается к благородным металлам, не окисляясь на воздухе при обычных условиях.
Во всех соединениях серебро одновалентно, хотя на сегодняшний день этот факт подвергается сомнению — под воздействием озона образуются оксиды двухвалентного серебра. С сероводородом в присутствии влаги и кислорода воздуха серебро образует нерастворимый в воде сульфид серебра. Пленка изменяет свой цвет от радужного через коричневый к черному. Она не разлагается до 885°С и растворяется только в азотной кислоте и аммиаке.
Все соли серебра чувствительны к свету и распадаются под его воздействием с образованием металлического серебра. Поэтому их хранят в непрозрачной таре, установленной в лабораторном шкафу с закрытыми дверцами, а приготовление электролитов ведут в ваннах с крышками или в затемненном помещении.

В чем особенности покрытий серебром?
Покрытия серебром являются катодными по отношению ко всем конструкционным материалам и не защищают их поверхность в условиях электрохимической коррозии.
В промышленности серебрение применяется:
- для создания поверхностных слоев высокой электропроводимости;
- для получения антифрикционного покрытия в подшипниках качения и скольжения, в т.ч. в вакууме, инертных средах, маслах;
- для обеспечения хорошей электропроводности в электрических контактах;
- при изготовлении отражателей, т.к. коэффициент отражения белого света для чистого серебра равен 95%;
- для защитно-декоративной отделки бытовых предметов и ювелирных изделий.
К негативным особенностям серебряных покрытий можно отнести:
- склонность к образованию наплывов на покрытии и свариванию контактов;
- плохая переносимость запрессовки в полимеры;
- возможность иглообразования;
- миграция по диэлектрику;
- диффузия на основной металл или на внешний слой покрытия.
Особенно следует рассмотреть вопрос переходного сопротивления электроконтактов с серебряным покрытием. Как упоминалось ранее, на серебряных покрытиях может образовываться сульфидная пленка. Эта пленка обладает ионной и фотоэлектрической проводимостью. Т.е. чем больше она освещена, тем меньшее ее сопротивление.
Такая особенность электропроводимости сульфидов серебра приводит к серьезной нестабильности переходного сопротивления посеребренных электроконтактов в условиях эксплуатации. Если же на контакт приложена малая контактная нагрузка и через него пропускается низкий ток, то проводимость контакта может нарушиться полностью.
На сегодняшний день серебрение из водных растворов производят химически и электрохимически. В связи с тем, что потенциал серебра (+0.8В) намного положительнее потенциала других металлов, невозможно получить прочно сцепленные мелкокристаллические покрытия из растворов простых солей серебра без добавок. На катоде происходит процесс цементации металла с контактным осаждением серебра. Поэтому электролиты на основе простых солей серебра не нашли применения в промышленности.
В свою очередь, распространение получили электролиты на основе комплексных соединений серебра. Комплексообразование позволяет сдвинуть потенциал серебра в отрицательную область, увеличить поляризацию катода, что измельчает кристаллы осадка, увеличить рассеивающую способность. Одновременно с этим комплексообразование снижает предельные плотности тока.
Первым комплексным электролитом был цианистый электролит серебрения. Он отличается наилучшими качествами получаемых покрытий, но является чрезвычайно токсичным. Поэтому одновременно с созданием цианистого электролита начались поиски электролита, не содержащего циан или, хотя бы, не содержащего его в свободном виде.
2. Механизм серебрения из цианистого электролита.
Цианистый электролит серебрения является на сегодняшний день самым изученным и самым лучшим по качеству получаемых из него осадков.
В цианистом растворе в основном образуются комплексы -ди и -три цианаргентаты: [Ag(CN)2] — и [Ag(CN)3] 2 — . В растворе также могут образовываться в незначительном количестве простые гидратированные ионы серебра. Таким образом основными компонентами этого электролита являются цианистый комплекс серебра, цианид щелочного металла и его карбонат, который непосредственно образуется в растворе при реакции цианида с углекислым газом воздуха.
Равновесия в цианидном растворе:
Существует мнение, что при осаждении серебра в прикатодной области образуется коллоидный осадок AgCN по схеме:
Это подтверждается тем, что в покрытии находят цианид серебра.
М. Филгистих и др., измеряя силу тока обмена серебра в зависимости от концентрации свободного цианида пришли к выводу, что при различном содержании свободного цианида разряд ионов серебра будет идти по разным механизмам. При концентрации ионов цианида ниже 6,5 г/л может происходить разряд ионов серебра из AgCN по схеме:
При концентрации цианида выше (13,5 г/л) разряд ионов серебра будет происходить по схеме:
т.е разряд ионов серебра идет непосредственно из комплексного иона. К этому мнению приходят многие исследователи. Об этом же говорят данные потенциометрических измерений, где стационарный потенциал серебра изменяется в зависимости от содержания свободного цианида калия, причем в области низких концентраций изменяется значительно сильнее. Это еще раз подтверждает, что при большом содержании свободного цианида разряд ионов серебра идет непосредственно из комплексного иона.
Рассмотрим поляризационную кривую разряда серебра из цианидной ванны.
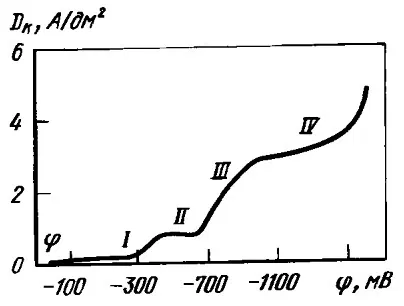
Рисунок 1 — Поляризационная кривая катодного восстановления серебра в цианидном электролите, содержащем: 40 г/л Ag (в пересчете на металл), 15 г/л свободного KCN. Температура 18-22° С
На кривой до предельного диффузионного тока можно выделить три участка, причем катодный осадок на каждом получается разным:
• Участок I. Потенциалы от -0,25 до -0,45 В. При этом емкость двойного электрического слоя имеет мала, осадки гладкие.
• Участок II. Потенциалы от -0,45 до -0,70 В. На кривой имеется перегиб, зернистость осадков повышается.
Участки I и II отвечают элементарному акту разряда, в котором участвуют анионы [Ag(CN)2] — . Перегиб при потенциале -0,45 В обусловлен малой величиной коэффициента переноса и изменением условий разряда ионов при сдвиге потенциалов в сторону более отрицательных значений, при которых возможна десорбция ионов (CN) — с поверхности электрода и ускорение разряда на этих местах ионов [Ag(CN)2] — .
• Участок III. Потенциалы выше -0,70 В. Осадки становятся шероховатыми. Выделяется водород. Могут образовываться анионы [Ag(CN)2]- по химической реакции:
• Участок IV. Преимущественно выделяется водород.
3. Электролиты серебрения.
3.1 Цианистые электролиты матового серебрения.
В таблице 1 и 2 приведены составы электролитов матового цианистого серебрения.
Таблица 1 – Составы электролитов матового серебрения.
(г/л) и режим электролиза
Источник: zctc.ru