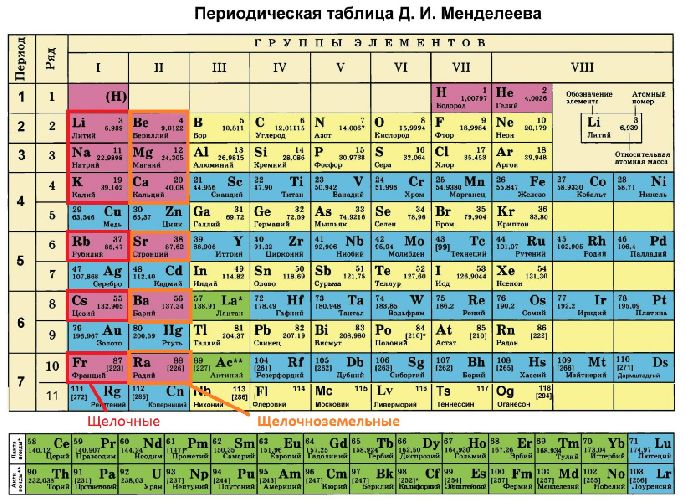
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева.
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaC O 3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Химия 9 класс (Урок№24 — Щелочноземельные металлы. Важнейшие соединения и их применение.)
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Источник: www.yaklass.ru
Щелочные и щелочноземельные металлы

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr);
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:
2Mg + ZrO2 → Zr + 2MgO

Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий.
Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Источник: obrazovaka.ru
Щёлочноземельные металлы — основные свойства, характеристика и список элементов
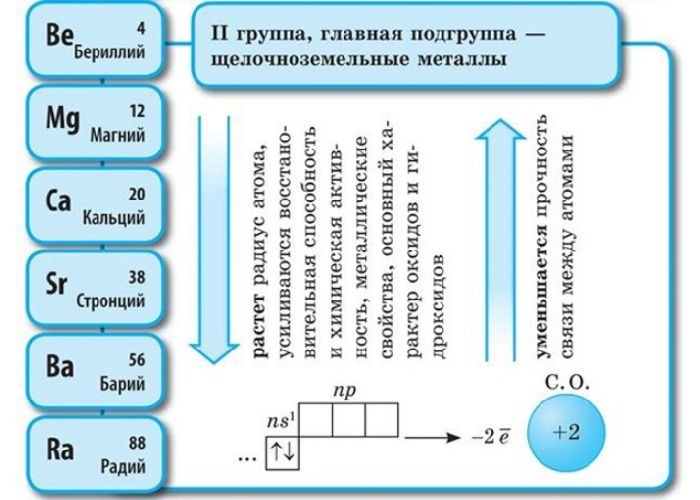
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно. Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева

- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS 2 :

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
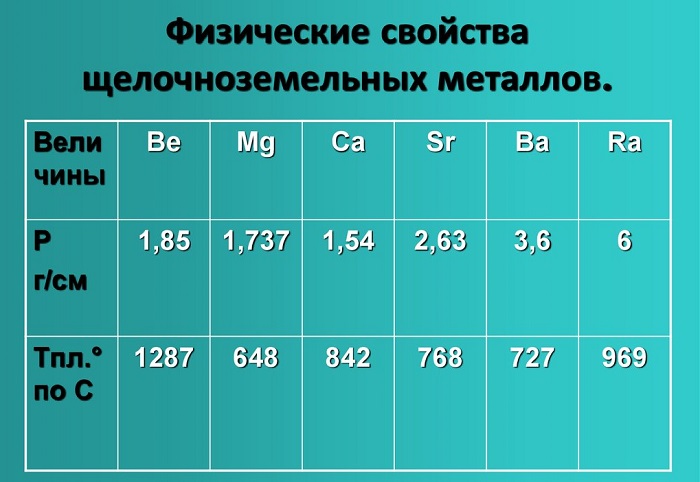
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
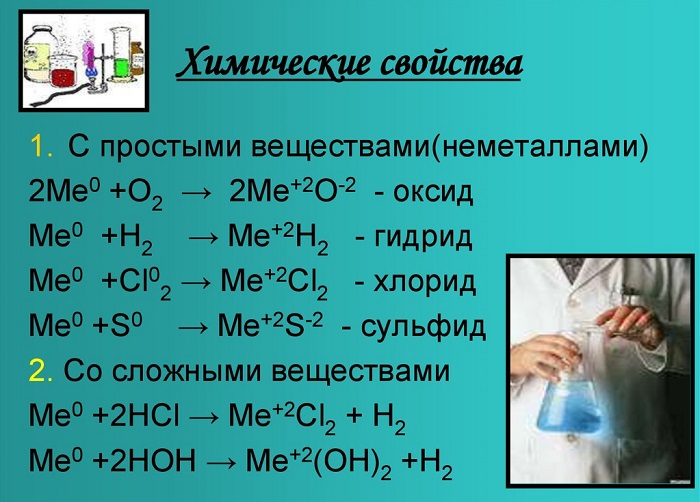
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
С кислородом образуют реакцию горения и оксид:
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2 — хлорид бериллия;
Ca + Br2 = CaBr2 — бромид кальция;
Sr + H2 = SrH2 — гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Sr — насыщенный красный;
Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Источник: nauka.club