Сурьма (химический символ — Sb; лат. Stibium) — это химический элемент 15-й группы пятого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный номер 51. Простое вещество сурьма — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения.
1. Сурьма известна с глубокой древности. В странах Востока она использовалась примерно за 3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в XIX в. до н. э. порошок сурьмяного блеска (природный Sb2S3) под названием mesten или stem применялся для чернения бровей. В Древней Греции он был известен как στίμμι и στίβι, отсюда лат. stibium . Около XII-XIV вв. н. э. появилось название antimonium.
Подробное описание свойств и способов получения сурьмы и её соединений впервые дано алхимиком Василием Валентином (Германия) в 1604 году. В 1789 году А. Лавуазье включил сурьму в список химических элементов под названием antimoine (современный английский antimony, испанский и итальянский antimonio, немецкий Antimon).
Сурьма: древнейшая подводка для глаз
2. Русское слово «сурьма» произошло от турецкого и крымско-татарского sürmä. Им обозначался порошок свинцового блеска PbS, также служивший для чернения бровей (по другим данным, «сурьма» — от персидского «сурме» — металл).
3. Сурьма в свободном состоянии образует серебристо-белые кристаллы с металлическим блеском, плотность — 6,68 г/см³.
4. Напоминая внешним видом металл, кристаллическая сурьма обладает большей хрупкостью и меньшей тепло- и электропроводностью.
5. В отличие от большинства других металлов, при застывании сурьма расширяется.
6. Примесь сурьмы понижает точки плавления и кристаллизации свинца, а сам сплав при отвердении несколько расширяется в объёме.
7. Металлическая сурьма малоактивна и устойчива на открытом воздухе при нормальных температурах. Начинает окислятся при +630 ⁰С, в результате чего образуется соединение Sb2O3 — оксид сурьмы. Полуметалл не вступает в реакции с водородом, азотом, кремнием и бором, остается устойчивым к воде, а в расплавленном виде незначительно растворяет углерод.
9. В природе известны два стабильных изотопа 121Sb (изотопная распространенность 57,25 %) и 123Sb (42,75 %). Из искусственно полученных радиоактивных изотопов важнейшие 122Sb (с периодом полураспада Т½ = 2,8 сут), 124Sb (Т½ = 60,2 сут) и 125Sb (Т½ = 2,7 года). Единственный долгоживущий радионуклид — 125Sb с периодом полураспада 2,76 года, все остальные изотопы и изомеры сурьмы имеют период полураспада, не превышающий двух месяцев.
10. Месторождения сурьмы известны в ЮАР, Алжире, Азербайджане, Таджикистане, Болгарии, России, Финляндии, Казахстане, Сербии, Китае, Киргизии.
11. Самым крупным производителем этого металла считается Китай, второе место у нас, на третьем — Мьянма. Далее идут Канада, Таджикистан и Боливия. Всего в мире ежегодно производится около 200 000 тонн сурьмы.
12. В связи с высокой хрупкостью металлическая сурьма применяется редко, но, так как она увеличивает твердость других металлов (например, олова и свинца) и не окисляется при обычных условиях, металлурги часто вводят ее в состав различных сплавов. Общее число сплавов, содержащих пятьдесят первый элемент, приближается к двумстам.
Сурьма — ПОЛУМЕТАЛЛ, Имеющий ВЗРЫВНУЮ Форму!
Является компонентом свинцовых сплавов, увеличивающим их твёрдость и механическую прочность. Вместе с оловом и медью сурьма образует металлический сплав — баббит, обладающий антифрикционными свойствами и использующийся в подшипниках скольжения. Также Sb добавляется к металлам, предназначенным для тонких отливок. Соединения сурьмы в форме оксидов, сульфидов, антимоната натрия и трихлорида сурьмы, применяются в производстве огнеупорных соединений, керамических эмалей, стекла, красок и керамических изделий. Сурьма всё больше применяется в полупроводниковой промышленности при производстве диодов, инфракрасных детекторов, устройств с эффектом Холла.
13. Содержание сурьмы в организме человека составляет 10−6 % по массе. Выделяется металл из организма достаточно медленно главным образом с мочой (80 %), в незначительном количестве — с фекалиями. Смертельная доза для взрослого человека — 100 мг, для детей — 49 мг.
14. Один из современнейших методов «использования» сурьмы поступил на вооружение криминалистов. Дело в том, что летящая пуля оставляет за собой вихревой поток — «след», в котором имеются мизерные доли ряда элементов — свинца, сурьмы, бария, меди. Оседая, они оставляют на любой поверхности невидимый «отпечаток».
Однако невидимыми эти частицы были лишь до недавнего времени, современные научные разработки позволяют определить наличие частиц, а, следовательно, и направление полета пули. Происходит это следующим образом: на исследуемую поверхность накладывают полоски влажной фильтровальной бумаги, затем их помещают в ядерный реактор и подвергают бомбардировке нейтронами. В результате «обстрела» часть атомов, перешедших на бумагу (в том числе атомы сурьмы), превращается в радиоактивные изотопы, а степень их активности позволяет судить о долевом содержании этих элементов в пробах и таким образом определить траекторию и длину полета пули, характеристику самой пули, оружия и боеприпасов.
15. Многие полупроводниковые материалы, содержащие сурьму, были получены в условиях невесомости на борту советской орбитальной научной станции «Салют-6» и американской станции «Скайлэб».
Ещё по теме:
Ваш Промблогер №1 Игорь (ZAVODFOTO)!Подписывайтесь на мой канал, я Вам ещё много чего интересного покажу:https://zen.yandex.ru/zavodfoto
На данный момент я уже лично посетил более 400 предприятий, а вот и ссылки на все мои промрепортажи:
Источник: dzen.ru
Сурьма
Сурьма́(лат. Stibium), Sb, химический элемент V группы короткой формы (15-й группы длинной формы) периодической системы , атомный номер 51, атомная масса 121,76. Природная сурьма – смесь стабильных изотопов 121 Sb (57,21 %) и 123 Sb (42,79 %); среди искусственно полученных радиоизотопов наиболее долгоживущий 125 Sb ( период полураспада Т1/22,76 года, β-излучатель).
Историческая справка
Сурьма известна с глубокой древности; так, в библейские времена порошок сурьмяного блеска (природный минерал антимонит ) применялся в качестве косметического средства, в странах Востока за 3 тыс. лет до н. э. изготавливали сосуды из литой сурьмы. Латинское название сурьмы stibium (от греч. στίβι) встречается у Плиния Старшего . В конце 18 в. в Западной Европе для обозначения сурьмы стало применяться средневековое латинское название antimonium, которое предположительно произошло от греческого ἄνϑεμον – цветок, по виду сростков игольчатых кристаллов сурьмяного блеска. Подробное описание свойств и способов получения сурьмы (которую считали разновидностью металлов) и её соединений дано в книге алхимика Василия Валентина «Триумфальная колесница антимония» (1604). Русское название «сурьма» произошло от турецкого sürme (порошок сурьмяного блеска для чернения бровей), по другим данным – от персидского سرمه (металл).
Распространённость в природе

Содержание сурьмы в земной коре 5·10 –5 % по массе, в морской воде менее 5·10 –4 мг/дм 3 . Известно около 120 минералов – антимонит Sb2S3, самородная сурьма и др. Сурьму также извлекают при комплексной переработке полиметаллических руд . Сурьма. Фото: DEA / R. APPIANI / Universal Images Group / Science Society Picture Library
Свойства
Конфигурация внешней электронной оболочки атома сурьмы 5s 2 5p 3 ; степени окисления +3 и +5, редко –3; энергии последовательной ионизации 834, 1794, 2443, 4260, 5400 кДж/моль; электроотрицательность по Полингу 2,05; атомный радиус 182 пм, ионные радиусы (пм, в скобках указаны координационные числа): Sb 3+ 76 (6), Sb 5+ 60 (6). Среди аллотропных модификаций наиболее устойчива при комнатной температуре серая «металлическая» ромбоэдрическая α-Sb (SbI). Известны кристаллические модификации, существующие при высоких давлениях, и неустойчивые аморфные модификации (жёлтая, чёрная и серебристо-белая взрывчатая). Металлическая α-Sb – серебристо-белая с синеватым оттенком, плотность 6684 кг/м 3 (25 °С), tпл630,7 °С, tкип1753 °С; температура перехода в сверхпроводящее состояние 2,7 К; диамагнитна ; твёрдость по Бринеллю 260 МПа; при комнатной температуре хрупка, выше 310 °С становится пластичной.
Сурьма химически малоактивна. Устойчива на воздухе, выше 600 °С окисляется с образованием оксида Sb2O3. Не реагирует с N2, С, Si, В. Активно реагирует с галогенами , кроме F2, горит в атмосфере Сl2. Реагирует с S, Sе, Те, Р. При сплавлении с большинством металлов образует бинарные соединения – антимониды . Не реагирует с HCl и HF, разбавленной H2SO4.
Окисляется концентрированной Н2SО4до Sb2(SО4)3, концентрированной HNO3до Sb2O5·nH2O. Не реагирует со щелочами и NH3в водном растворе. Действием НСl на антимониды Mg или Zn получают гидрид (стибин) SbН3– бесцветный высокотоксичный газ. Соединения Sb(III) и Sb(V) в водной среде подвергаются гидролизу . Соединения, образующиеся при гидролизе Sb(III), содержат катионы оксосурьмы SbO + и дигидроксосурьмы Sb(OН)2+ . Оксид Sb2O3и гидроксид Sb2O3·nH2O амфотерны , оксид Sb2O5и его гидрат Sb2O5·nH2O имеют кислотный характер.
Получение
Сырьём для производства сурьмы служат обогащённые с использованием гравитационных и флотационных методов сурьмяные руды . Для получения сурьмы чаще используют пирометаллургические процессы – осадительную плавку с железом или (для частично окисленных руд или руд, содержащих драгоценные металлы) окислительный обжиг с возгонкой Sb2О3, который далее подвергают восстановительной плавке. Гидрометаллургический способ переработки включает выщелачивание раствором Na2S с NaOH с последующим электролизом.
Рафинирование сурьмы огневым способом включает удаление Fe и Сu действием Sb2S3или S, щелочное рафинирование (очистку от As и S), очистку от Na действием SiO2. Для извлечения Аu, Ag и Рb проводится электролитическое рафинирование. Сурьму высокой чистоты получают переводя Sb в SbСl3или SbН3, которые подвергают перегонке. Применяют также электролитическое рафинирование и зонную плавку . Объём мирового производства сурьмы около 116 тыс. т/год (2016).
Применение
Сурьма – компонент сплавов на основе Рb и Sn (для аккумуляторных пластин, типографских шрифтов, подшипников и др.), на основе Cu и Zn, Sn (для художественного литья ). Сурьму используют для получения материалов с полупроводниковыми свойствами; оксиды – для получения оптического стекла , эмалей, керамики , как наполнитель термостойких пластмасс, антипирен для тканей, люминофор и др.; сульфиды – как компонент пиротехнических составов , пигменты, вулканизующие агенты.
Сурьма и её соединения токсичны , вызывают раздражение слизистых оболочек верхних дыхательных путей, глаз , кожи .
Аликберова Людмила Юрьевна . Первая публикация: Большая российская энциклопедия, 2016.
в 12:06 (GMT+3) Обратная связь
Информация

Области знаний: Общие вопросы химии Символ: Sb Атомный номер: 51 Группа элементов: Переходные металлы Относительная атомная масса: 121,76 а. е. м. Радиус атома: 182 пм Электроотрицательность: 2,05 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность при н. у.: 6,684 г/см³ Температура плавления: 630,7 °C Температура кипения: 1753 °C
Источник: bigenc.ru
Сурьма — чрезвычайно важное для промышленности вещество

Сурьма — простое химическое вещество, элемент таблицы Менделеева Sb под номером 51. Химики относят его к полуметаллам, металлоидам, то есть к веществам, проявляющим свойства как металлов, так и неметаллов.
Сурьма встречается в природе в самородном виде, но чаще в составе минералов (их известно более сотни); в составе свинцовых, медных и серебряных руд. Промышленное значение имеет только один минерал — антимонит (сульфид сурьмы).
Виды и особенности
Сурьма имеет 4 металлические аллотропные модификации, и 3 аморфные: желтая сурьма, черная, взрывчатая. Металлическая сурьма, она же серая сурьма — похожее на металл серебристое вещество с синеватым отливом, твердое, но хрупкое, его легко растолочь в порошок. Металлическая сурьма очень высокой чистоты пластична. Вещество устойчиво в нормальных условиях, слабо проводит ток и тепло, имеет полупроводниковые свойства. Обладает редким качеством для металла — расширяется при охлаждении, благодаря чему используется для изготовления типографских литер.
Желтая сурьма при нагревании или ярком освещении превращается в черную сурьму с полупроводниковыми свойствами. Взрывчатая сурьма взрывается при трении. При определенных условиях черная и взрывчатая сурьма переходят в металлическую.
Сурьма растворяет многие металлы (образует с ними интерметаллические соединения). В химических реакциях проявляет валентность III и V. Для окисления кислородом требуется нагрев до 600 °С. Вступает в реакции с концентрированной азотной и серной кислотами, с «царской водкой», с галогенами и хлором.
Сурьма, особенно Sb III, а также ее соединения, ядовита, хотя как микроэлемент присутствует в организме человека и животных. В организме хим реактив может накапливаться, вызывая угнетение функции щитовидной железы и половой функции. На производствах, при работе с рудами и выплавке сплавов необходимо использовать индивидуальные средства защиты. Пары и пыль сурьмы вызывают поражение органов дыхания, носовое кровотечение, раздражение кожи и глазные заболевания. Попадание сурьмы через пищевой тракт менее опасно, так как она гидролизуется в процессе пищеварения и выводится из организма.
Применение
 — Сурьма входит в состав почти 200 сплавов. Добавление в сплав сурьмы увеличивает его твердость. Особенно часто применяются сплавы со свинцом, оловом, медью и висмутом для получения легкоплавких, но твердых, износо- и коррозиеустойчивых сплавов для производства подшипников, типографских шрифтов, труб для перекачки агрессивных жидкостей (твердый свинец), пуль и шрапнели.
— Сурьма входит в состав почти 200 сплавов. Добавление в сплав сурьмы увеличивает его твердость. Особенно часто применяются сплавы со свинцом, оловом, медью и висмутом для получения легкоплавких, но твердых, износо- и коррозиеустойчивых сплавов для производства подшипников, типографских шрифтов, труб для перекачки агрессивных жидкостей (твердый свинец), пуль и шрапнели.
— Основная часть производимой сурьмы идет на производство твердого свинца (сплав может содержать до 15% Sb) для выпуска пластин аккумуляторов и батарей. Из этого сплава также изготавливают электроды, оболочки кабелей, защитные экраны от излучения.
— Сплавы сурьмы с германием, индием, галлием и алюминием — высококачественные полупроводники. Теллурид сурьмы входит в состав термоэлектрических сплавов.
— Оксид сурьмы (III) — самое востребованное промышленностью соединение сурьмы. Оно отличается высокой термостойкостью, поэтому входит в состав жаростойких красок и эмалей, стекол, керамики, тканей, антипиренов. Краска на его основе используется для окраски кораблей, в том числе их подводной части. Триоксид сурьмы используется для получения Sb высокой чистоты для металлургии и производства полупроводников.
— Сульфиды сурьмы III и V используются в пиротехнике, в производстве 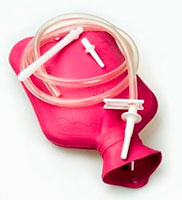 трассирующих пуль, в составе спичечных головок, для вулканизации каучука, в составе особо эластичной и термостойкой резины для медицинских изделий (резина красных оттенков).
трассирующих пуль, в составе спичечных головок, для вулканизации каучука, в составе особо эластичной и термостойкой резины для медицинских изделий (резина красных оттенков).
— Треххлористая сурьма применяется в химической промышленности для получения сурьмы высокой чистоты, в органическом синтезе, для получения жидкого неводного растворителя. Используется в аналитической химии; в текстильной промышленности в качестве протравы.
— Сурьма входит в состав многих красок и пигментов для стекольной, фарфоровой и керамической индустрии, в состав масляных красок для живописи. Мелкодисперсионный порошок чистой сурьмы является основой краски «железная чернь».
— Кроме того, сурьма применяется в люминесцентных лампах; в лекарственных препаратах; как источник γ-излучения и нейтронов, в бессвинцовом припое.
Магазин химических реактивов, лабораторного оборудования и средств защиты предлагает хим реактивы в широком ассортименте, среди которого имеется Сурьма (III) окись ч и Сурьма треххлористая хч.
Источник: pcgroup.ru