Хватает ли германия вашему организму: в чем польза микроэлемента, как выявить нехватку или переизбыток

В человеческом организме содержится огромное количество микро- и макроэлементов, без которых полноценное функционирование всех органов и систем было бы просто невозможным. О некоторых из них люди слышат постоянно, а о существовании других вовсе не подозревают, но все они играют свою роль в хорошем самочувствии. К последней группе относится и германий, содержащийся в теле человека в органическом виде. Что это за элемент, за какие процессы отвечает и какой его уровень считается нормой — читайте далее.
- Описание и характеристика
- Функции и роль в организме
- В чем содержится германий: продукты источники
- Суточная потребность и нормы
- Дефицит и переизбыток
Описание и характеристика
—>В общем понимании германий является одним из химических элементов, представленных в известной таблице Менделеева (относится к четвертой группе). В природе он представлен в виде твердого, серо-белого вещества с металлическим отблеском, но в человеческом теле содержится в органической форме.
Германий. Польза и действие на организм.

Надо сказать, что его нельзя назвать очень редким, поскольку он обнаруживается в железных и сульфидных рудах и силикатах, хоть собственных минералов германий практически не образует. Содержание химического элемента в коре Земли превышает концентрацию серебра, сурьмы и висмута в несколько раз, а в отдельных минералах его количество доходит до 10 кг на тонну. Воды мирового океана содержат в себе около 6•10-5 мг/л германия.
Многие растения, произрастающие на разных континентах, способны абсорбировать небольшое количество данного химического элемента и его соединений из грунта, после чего они могут попасть и в организм человека. В органическом виде все такие составляющие принимают непосредственное участие в различных обменных и восстановительных процессах, о чем пойдет речь далее.
Знаете ли вы? Впервые данный химический элемент был замечен в 1886 году, а узнали о нем благодаря стараниям немецкого ученного-химика К. Винклера. Правда, до этого момента о его существовании говорил и Менделеев (в 1869 году), который сначала условно назвал его «экасилицием».
Функции и роль в организме
Еще совсем недавно ученные считали, что германий совершенно бесполезен для человека и в принципе не выполняет совершенно никакой функции в теле живых организмов. Тем не менее, на сегодняшний день, точно известно, что отдельные органические соединения данного химического элемента могут успешно использоваться даже в роли лекарственных составов, хотя на счет их эффективности говорить пока рано.

Опыты, проводимые на лабораторных грызунах, показали, что даже небольшое количество германия способно увеличить продолжительность жизни животных на 25-30%, а это уже само по себе хорошая причина задуматься о его пользе и для человека. Уже проведенные исследования роли органического германия в человеческом организме позволяют выделить следующие биологические функции этого химического элемента:
- предотвращение кислородного голодания организма путем перенесения кислорода к тканям (снижается риск так называемой «кровяной гипоксии», проявляющейся при снижении количества гемоглобина в эритроцитах);
- стимуляция развития защитных функций организма путем подавления процессов распространения микробных клеток и активации специфических клеток иммунитета;
- активное противогрибковое, противовирусное и антибактериальное воздействие за счет продуцирования интерферона, защищающего организм от вредоносных микроорганизмов;
- мощное антиоксидантное воздействие, выражающееся в блокировке свободных радикалов;
- задержка развития опухолевых новообразований и предупреждение образования метастаз (в данном случае германий нейтрализует действие отрицательно заряженных частиц);
- выступает регулятором клапанных систем пищеварения, венозной системы и перистальтики;
- за счет остановки движения электронов в нервных клетках, соединения германия способствуют снижению разнообразных болевых проявлений.
Все проводимые эксперименты, предусматривающие определение скорости распределения германия в человеческом организме после его перорального употребления, показали, что спустя 1,5 часа после приема больше всего данного элемента содержится в желудке, тонком кишечнике, селезенке, костном мозге, ну и, конечно же, в крови. То есть, высокий уровень германия в органах пищеварительной системы доказывает его пролонгированное действие при всасывании в кровоток.
Важно! Не стоит самостоятельно проверять на себе действие указанного химического элемента, ведь неправильный расчет дозировки вполне может привести к серьезному отравлению.
В чем содержится германий: продукты источники

Любой микроэлемент в нашем организме выполняет определенную функцию, поэтому для хорошего самочувствия и поддержания тонуса так важно обеспечить оптимальный уровень тех или иных составляющих. Это касается и германия. Пополнить его запасы, можно ежедневно употребляя чеснок (именно здесь его содержится больше всего), пшеничные отруби, бобовые культуры, белые грибы, томаты, рыбу и морепродукты (в частности, кальмаров, креветок и мидий), морскую капусту, молоко и даже женьшень, черемшу и алоэ. Усилить же действие германия на организм можно с помощью селена. Многие из указанных продуктов без проблем найдутся в доме у каждой хозяйки, поэтому никаких трудностей возникать не должно.
Суточная потребность и нормы
Не секрет, что переизбыток даже полезных компонентов может навредить ничуть не меньше чем их недостача, поэтому, прежде, чем переходить к восполнению утраченного количества германия, важно знать о его допустимой суточной норме. Обычно это значение колеблется в пределах от 0,4 до 1,5 мг и зависит от возраста человека и имеющегося дефицита микроэлемента.
Человеческий организм хорошо справляется с абсорбцией германия (поглощение указанного химического элемента составляет 95%) и сравнительно равномерно распределяет его по тканям и органам (неважно идет речь о внеклеточном или внутриклеточном пространстве). Вывод германия наружу происходит вместе с мочой (выходит до 90%).
Важно! Органические соединения данного химического элемента характеризуются очень высокими антиоксидантными свойствами, причем их уровень выше чем даже у витамина С, Е и коэнзима Q.
Дефицит и переизбыток
Как мы уже упоминали выше, любая крайность не к добру. То есть, как недостача, так и превышение количества германия в организме способно отрицательно сказаться на его функциональных особенностях. Так, при дефиците микроэлемента (является результатом его ограниченного потребления вместе с пищей или нарушения обменных процессов в организме) возможно развитие остеопороза и деминерализации костной ткани, а также в несколько раз повышается возможность онкологических состояний.
Чрезмерное количество германия оказывает отравляющее воздействие на организм, причем особо опасными считаются соединения двухлетнего элемента. В большинстве случаев его избыток можно объяснить вдыханием чистых паров в производственных условиях (ПДК в воздухе может составлять 2 мг/куб.м). При непосредственном контакте с хлоридом германия не исключены местные раздражения кожи, а его попадание внутрь организма часто чревато поражениями печени и почек.
Знаете ли вы? В медицинских целях описанным элементом впервые заинтересовались японцы, а настоящим прорывом в этом направлении стало исследование доктора Асаи, обнаружившего широкий спектр биологического действия германия.

Как видим, описанный микроэлемент действительно нужен нашему организму, пусть его роль пока и не до конца изучена. Поэтому, чтобы поддерживать оптимальный баланс просто кушайте побольше перечисленных продуктов и постарайтесь не находиться во вредных производственных условиях.
Источник: lifegid.com
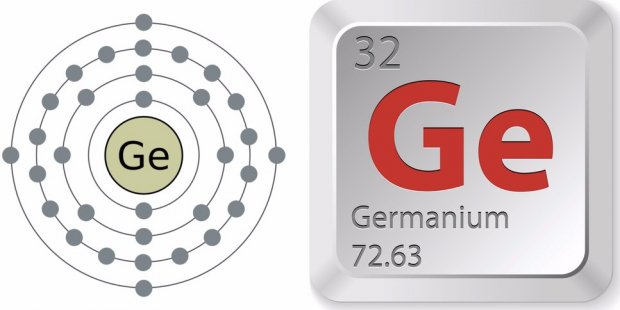
Германий

Элемент был предсказан Д. И. Менделеевым (как эка-кремний) и открыт в 1885 году немецким химиком Клеменсом Винклером при анализе минерала аргиродита Ag8GeS6. Происхождение названия- назван в честь Германии, родины Винклера.
Нахождение в природе
Получение
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества:
Физические свойства
![]()

Кристаллическая структура германия.
Кристаллическая решетка германия кубическая гранецентрированная типа алмаза, параметр а = 5,660 Å .
Механические свойства
- Модуль упругости E, ГПа — 82
- Скорость звука (t=20÷25°C) в различных направлениях ·1000 м/с.
- L100 : 4,92
- S100 : 3,55
- L110 : 5,41
- S110 : 2,75
- L111 : 5,56
- S111 : 3,04
Электронные свойства
Германий является типичным непрямозонным полупроводником.
- Статическая диэлектрическая проницаемость ε = 16,0
- Ширина запрещённой зоны (300 К) Eg = 0,67 эВ
- Собственная концентрация ni=2,33×10 13 см −3
- Эффективная масса
- электронов, продольная: mII=1,58m0, mII=1,64m0
- электронов, поперечная: m┴=0,0815m0 , m┴=0,082m0
- дырок, тяжелых: mhh=0,379m0
- дырок, легких: mhl=0,042m0
Легированный галлием германий в тонкой плёнке можно привести в сверхпроводящее состояние.
Изотопы
В природе встречается пять изотопов: 70 Ge (20,55 % масс.), 72 Ge (27,37 %), 73 Ge (7,67), 74 Ge (36,74 %), 76 Ge (7,67 %). Первые четыре стабильны, пятый ( 76 Ge) испытывает двойной бета-распад с периодом полураспада 1,58×10 21 лет. Кроме этого существует два «долгоживущих» искусственных: 68 Ge (время полураспада 270,8 дня) и 71 Ge (время полураспада 11,26 дня).
Химические свойства
В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия.
Соединения германия
Неорганические
Органические
Применение
Средние цены на германий в 2007 году /по материалам infogeo.ru/metalls
- Германий металлический $1200/кг
- Германий диоксид (двуокись) $840/кг
- Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К).
- Совершенно исключительное стратегическое значение имеет металлический германий сверхвысокой чистоты в производстве линз, и призм инфракрасной оптики.
- В радиотехнике, германиевые транзисторы и детекторныедиоды обладают характеристиками, отличными от кремниевых, ввиду меньшего напряжения отпирания pn-перехода в германии — 0.4В против 0.6В у кремниевых приборов. В своё время германиевые полупроводниковые приборы использовались повсеместно в радиоприёмниках и других конструкциях. Например, схема JOULE (в отечественной радиотехнике известная как блокинг-генератор) позволяет питать трёхвольтовый светодиод от 0,6 В, если в ней применён кремниевый транзистор, и начиная всего с 0,125 В, если германиевый. HI-End усилители на германиевых транзисторах обладают качеством звука, сопоставимым с усилителями на радиолампах, так как германиевые транзисторы мягче переключатся в схемах усилителя класса «AB», имеют более линейную переходную характеристику (чем сопоставимые кремниевые транзисторы тех же лет выпуска), и не пропускают гармоники дальше пятой (тогда как кремниевые — до 11-той — из-за чего звук становится «жестким» на высоких частотах). В классификации радиоэлектроники по советскому ГОСТу кремниевые полупроводниковые элементы обозначались, начиная с буквы К или с цифры 2, а германиевые с буквы Г или цифры 1, например: ГТ313, 1Т308 — германиевые высокочастотные маломощные транзисторы. Существует старая система обозначений, например, П210,213,214,217, и некоторые транзисторы «МПxx» — также германиевые. Ещё более высоким частотным потенциалом (имеется ввиду подвижность носителей заряда в полупроводниках, а не скорость работы готового полупропроводникового прибора) обладает арсенид галлия, применяемый в светодиодах. В настоящее время кремниевые диоды и транзисторы полностью вытеснили германиевые, и они не выпускаются ни в одной стране мира. Найти их можно только в старых радиоаппаратах либо из запасов радиолюбителей тех лет.
- Качер Бровина («генератор Бровина-Теслы») [источник?] лучше работает на германиевых транзисторах.
- Германий широко применяется в ядерной физике в качестве материала для детекторов гамма-излучения.
Биологическая роль
Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Для животных германий малотоксичен. У соединений германия не обнаружено фармакологическое действие. Допустимая концентрация германия и его оксида в воздухе — 2 мг/м³, то есть такая же, как и для асбестовой пыли.
Соединения двухвалентного германия значительно более токсичны.
Дополнительная информация
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 | 3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 | 11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 | 19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 | 37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 | 55 Cs Цезий |
56 Ba Барий |
* | 72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 | 87 Fr Франций |
88 Ra Радий |
** | (104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * | 57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** | 89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Источник: himsnab-spb.ru
Химический элемент германий (Ge) — состав, характеристика и основные свойства

Химия охватывает практически все аспекты жизни человека. Знания в этой области помогают справляться с разными жизненными ситуациями. Кроме того, школьный предмет даёт возможность некоторым реализовать себя в той или иной профессии, связанной с такой наукой. Для начала учеников знакомят с таблицей Менделеева. Многие вещества интересны своей историей и характеристиками, например, химический элемент германий.

История происхождения
В 1869 году русский химик Д. И. Менделеев заявил, что в природе должно существовать несколько элементов, которые всё ещё не найдены людьми. Его идея была связана с Периодической таблицей, по которой между некоторыми веществами находились пробелы. Один из элементов он назвал экасилиций. Менделеев считал, что по свойствам это вещество похоже на кремний.

В 1886 году в Фрейбергской академии наук открыли новый минерал, который назвали аргиродит. Профессор К. Винклер тщательно изучил его и нашёл в его составе неизвестный элемент. Вскоре он раскрыл его свойства и несколько соединений. Винклер пришёл к выводу, что это и есть то самое вещество, названное Менделеевым экасилиций. Сначала химик хотел назвать его нептунием, но это наименование дали другому предполагаемому веществу, поэтому элемент получил название Germanium в честь родины Винклера.
До второй половины XX века германий почти не применялся в промышленности. Только во время Второй мировой войны элемент стали использовать в диодах и других электронных устройствах.
Местонахождение и получение
- германит;
- плюмбогерманит;
- конфильдит;
- рениерит;
- стоттит;
- аргиродит.

В основном германий добывают из горных пород и различных минералов таких, как железные руды, сульфидные руды цветных металлов, базальт, диабаз, магнетит, рутил, хромит, гранит. В больших объёмах вещество содержится в некоторых сфалеритах. Примеси германия присутствуют почти во всех силикатах и некоторых месторождениях каменного угля и нефти.
Химический элемент распространён практически по всей планете. Однако промышленных месторождений этого металла нет ни в одной стране. Небольшое количество элемента, содержащегося в его минералах, не может покрыть потребность современной промышленности в этом редком, но важном веществе.
Германий можно получить несколькими методами. Основной способ заключается в применении сульфида металла, который перерабатывают до получения оксида GeO2 и затем освобождают элемент с добавлением водорода. В промышленной области материал выходит в побочных продуктах после переработки руд цветных металлов или золы от сжигания угля.
Физические особенности

Германий относится к 14-й группе 4 периода в таблице Менделеева. Его порядковый номер — 32, обозначение — Ge. В виде простого вещества германий выглядит как хрупкий полуметалл стального или серебристого оттенка. Материал характеризуется металлическим блеском. Элемент относится к непрямозонным полупроводникам.
Валентность металла в разных соединениях может быть II или IV; электронная формула германия (конфигурация) — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 . Следует узнать и о строении атома элемента. Он включает 32 протона и 41 нейтрон. По четырём орбитам движутся 32 электрона.
В нормальном состоянии атом элемента характеризуется двумя s-парными и двумя p-парными отрицательно заряженными частицами, поэтому вещество может образовывать две химические связи. В возбуждённом состоянии один из s-электронов покидает свою орбиталь и переходит на свободное место на p-подуровне. Поскольку образуется 4 неспаренных электрона, германий способен образовывать 4 связи по обменному механизму.
Основные физические свойства элемента:
- температура плавления — 938,2 °C;
- температура кипения — 2850 °C;
- плотность — 5,33 г/см³;
- молярный объём — 13,6 см³/моль;
- атомная масса — 72,6 а. е. м.;
- молярная теплоёмкость — 23,32 Дж/К·моль.
При нормальных условиях кристаллическая решётка элемента алмазная, или кубическая. У полуметалла есть необычное физическое свойство: германий считается одним из редких аномальных веществ, у которых при плавлении увеличивается показатель плотности. Кроме того, при повышении температуры возрастает почти в 13 раз удельная проводимость германия, однако при достижении 1100 °C она падает.
Химическая природа
В соединениях металл проявляет степень окисления +4, +2 или -4. Если рассматривать химические свойства германия, вещество напоминает кремний. При нормальных условиях он устойчив к воздействию воздуха, воды, щелочей и кислот. Германий способен растворяться в царской водке и в щелочном растворе пероксида водорода.
На воздухе при 500−700 °C металл окисляется до оксидов. Производные кислоты элемента представлены твёрдыми веществами, которые характеризуются высокими температурами плавления. Их можно получить путём сплавления оксидов германия.

При реакции с галогенами металл образует тетрагалогениды. Легче процесс проходит с фтором и хлором. Тетрахлорид получают при хлорировании германия в твёрдом состоянии или при реакции его оксида (GeO2) с концентрированной соляной кислотой. При гидролизе дигалогенидов элемента получается гидроксид. Монооксид можно получить при нагревании металла с его диоксидом.
Взаимодействуя с серой при температуре 1000 °C, германий образует дисульфид, который представлен твёрдым веществом белого цвета. При нагревании до 1100 °C металл незначительно реагирует с водородом. В результате получается малоустойчивое соединение гермин. При воздействии на германий аммиака образуется нитрид. С углеродом элемент не взаимодействует.
Также вещество способно образовывать металлорганические (например, тетраэтилгерман) и комплексные соединения с гидроксилсодержащими органическими молекулами (многоосновные кислоты, многоатомные спирты).
Сферы использования

Поскольку германий выступает полупроводником, он широко применяется в электронике и технике при создании микросхем и транзисторов. Сплавы металла необходимы при изготовлении датчиков и детекторов, а его диоксид применяется для производства стёкол, пропускающих инфракрасное излучение. Элемент используют в радарных установках в качестве сопротивления.
Германий используют при создании призм и линз инфракрасной оптики. Без материала не обходятся оптоволоконные системы и полупроводниковые диоды. Элемент применяется при измерении низких температур и обнаружении инфракрасного излучения. Диоды и триоды на основе вещества используются в телевизорах, радиоприёмниках и счётно-решающих средствах.
Влияние на здоровье человека
Германий в незначительном объёме обнаружен в организме человека. Пока учёные не смогли установить, в каком количестве должен присутствовать этот элемент в составе тканей и крови. Металл практически полностью усваивается человеческим организмом. Излишки микроэлемента выводятся через почки. Также не выявлено, какие вещества могут улучшить или ухудшить его поглощаемость.
Специалистам удалось открыть в металле некоторые лечебные свойства. Германий оказывает положительное воздействие на здоровье человека:
- Вещество транспортирует кислород к тканям.
- Элемент замещает свойства пониженного гемоглобина.
- Германий укрепляет иммунную систему, подавляет размножение вредных бактерий и стимулирует выработку противомикробных клеток.
- Металл выступает антиоксидантом, предотвращая образование опухолей.
- Вещество способно подавлять болезненные ощущения.
Но у германия есть не только плюсы. Среди минусов следует отметить, что большие дозировки этого вещества представляют опасность для организма человека и могут вызвать отравление.
Обычно такие последствия вызывает вдыхание паров чистого металла и его оксидов на производственных мероприятиях. После перорального приёма больших дозировок германия может наблюдаться раздражение кожного покрова или нарушение работы почек и печени. Очистить организм от избытка элемента необходимо с помощью симптоматического лечения с сорбентами. Из-за недостатка германия возможно развитие остеопороза.
Поддерживать необходимый уровень элемента в организме помогут следующие продукты:

- бобовые;
- молоко;
- грибы;
- лосось;
- чеснок;
- корень женьшеня;
- томатный сок.
В Японии производят добавки с германием для поддержания здоровья. Поскольку это вещество ещё недостаточно изучено, средство пока не получило массового распространения. В начале XXI века в России начали выпускать БАД «Гермавит». Добавку выписывают для укрепления иммунной и костной систем, а также для защиты от кислородного голодания.
Занимательные факты
Любой химический элемент отличается определёнными особенностями и свойствами, которые не характерны для других веществ. О германии имеется немало интересных фактов:
- Хотя элемент относится к группе металлов, по хрупкости его можно сравнить со стеклом. Если его уронить, он может разбиться.
- Германий может быть не только серебристого оттенка. Его цвет зависит от метода обработки. В некоторых случаях металл имеет стальной окрас, а иногда получается практически чёрным.
- Элемент обнаружен на поверхности солнца и в упавших с космоса метеоритах.
- Практически все свойства и характеристики вещества, которые предсказал Менделеев, оказались на удивление точными.
- Около 500 тонн элемента, что составляет половину разведанных запасов металла, скрыто в недрах США. Почти 400 тонн обнаружено в Китае.
- Элемент способен проводить ток не только в стандартном виде, но и в твёрдых растворах.
- Цена слитка германия и золота практически одинаковая.
- Плёнка из германия и ниобия, имеющая толщину несколько тысяч атомов, может сохранять сверхпроводимость даже при температуре 23,2 °К и ниже.
- Ни одно из полученных элементоорганических соединений этого металла не ядовито.

Ежегодно специалисты открывают новые свойства веществ, которые могут повлиять на дальнейшее развитие технологий. Возможно, что в скором будущем германию найдут широкое применение не только в промышленности, но и в области медицины.
Источник: nauka.club
Германий, свойства атома, химические и физические свойства

Германий, свойства атома, химические и физические свойства.
Поделиться в:




72,630(8) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2
Германий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 32. Расположен в 14-й группе (по старой классификации — главной подгруппе четвертой группы), четвертом периоде периодической системы.
Физические свойства германия
Атом и молекула германия. Формула германия. Строение германия:
Германий (лат. Germanium) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ge и атомным номером 32. Расположен в 14-й группе (по старой классификации – главной подгруппе четвертой группы), четвертом периоде периодической системы.
Германий – металл. Относится к группе редких, рассеянных, цветных металлов . Является полуметаллом.
Германий обозначается символом Ge.
Как простое вещество германий при нормальных условиях представляет собой полуметалл серо-белого цвета с металлическим блеском.
Молекула германия одноатомна.
Химическая формула германия Ge.
Электронная конфигурация атома германия 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 . Потенциал ионизации (первый электрон) атома германия равен 762,18 кДж/моль (7,899435(12) эВ).
Строение атома германия. Атом германия состоит из положительно заряженного ядра (+32), вокруг которого по четырем атомным оболочкам движутся 32 электрона. При этом 28 электронов находятся на внутреннем уровне, а 4 электрона – на внешнем. Поскольку германий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s- и р- орбиталями. На внешнем энергетическом уровне атома германия на s-орбитали находятся два спаренных электрона и на p-орбитали – два неспаренных электрона. В свою очередь ядро атома германия состоит из 32 протонов и 41 нейтрона.
Радиус атома германия (вычисленный) составляет 125 пм.
Атомная масса атома германия составляет 72,630(8) а. е. м.
Германий, подобно кремнию, является полупроводником.
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai