31 декабря 2021
· Обновлено 25 октября 2022
Что такое качественная реакция
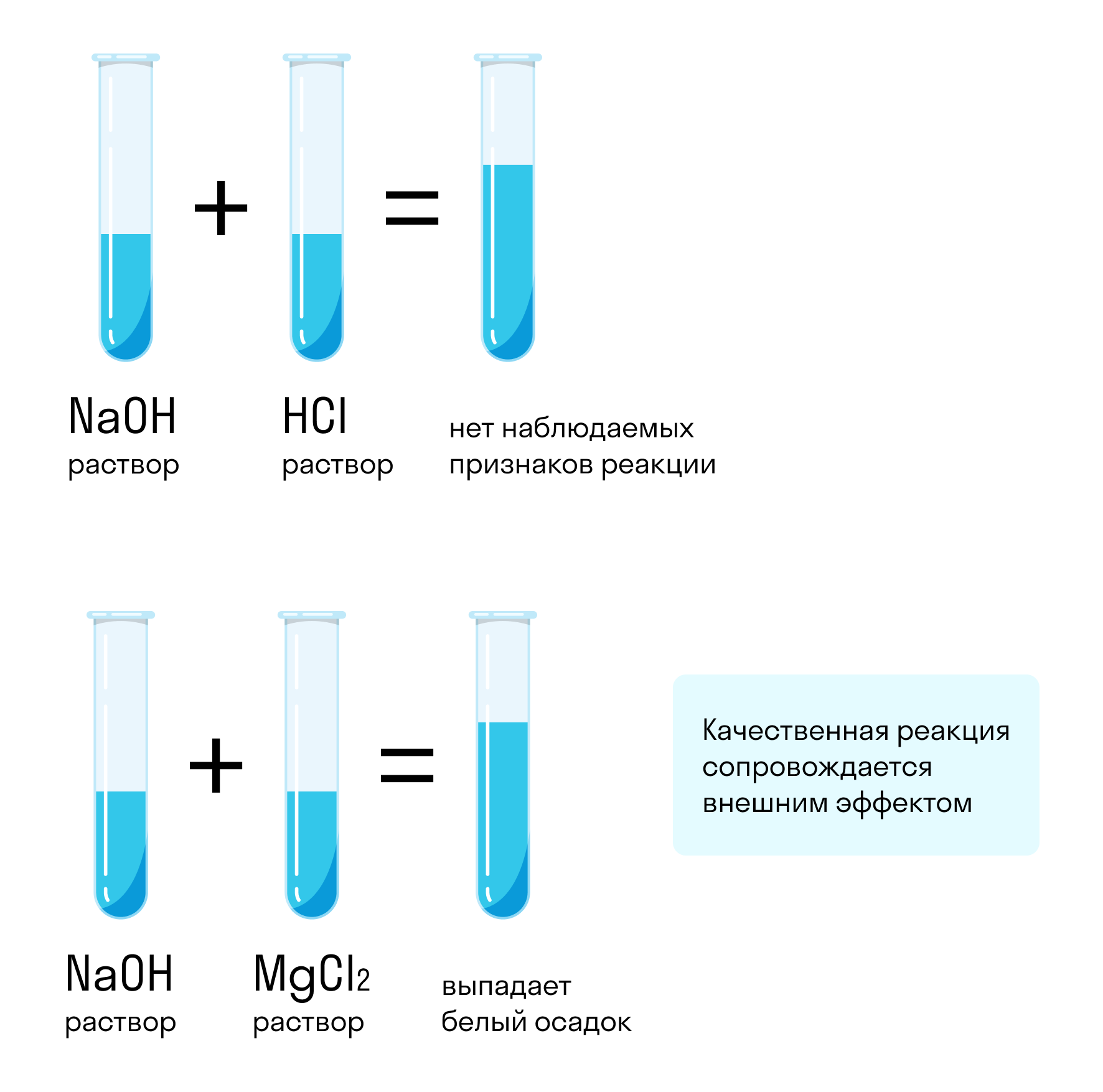
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Что такое МЕТАЛЛИЧЕСКАЯ связь в Химии? #shorts #youtubeshorts
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
![]()
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Получить подарок!
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
- сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
- мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
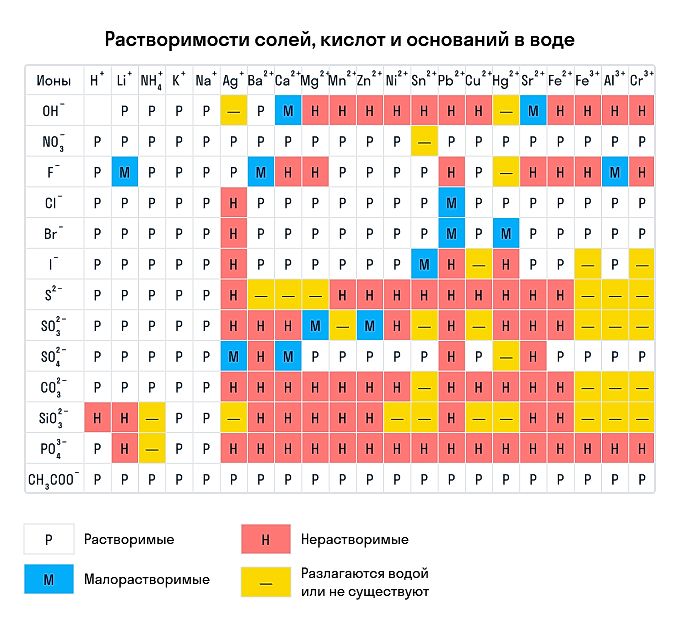
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
- абсолютно все нитраты;
- большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
- соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
- почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
- любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
- любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
- любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
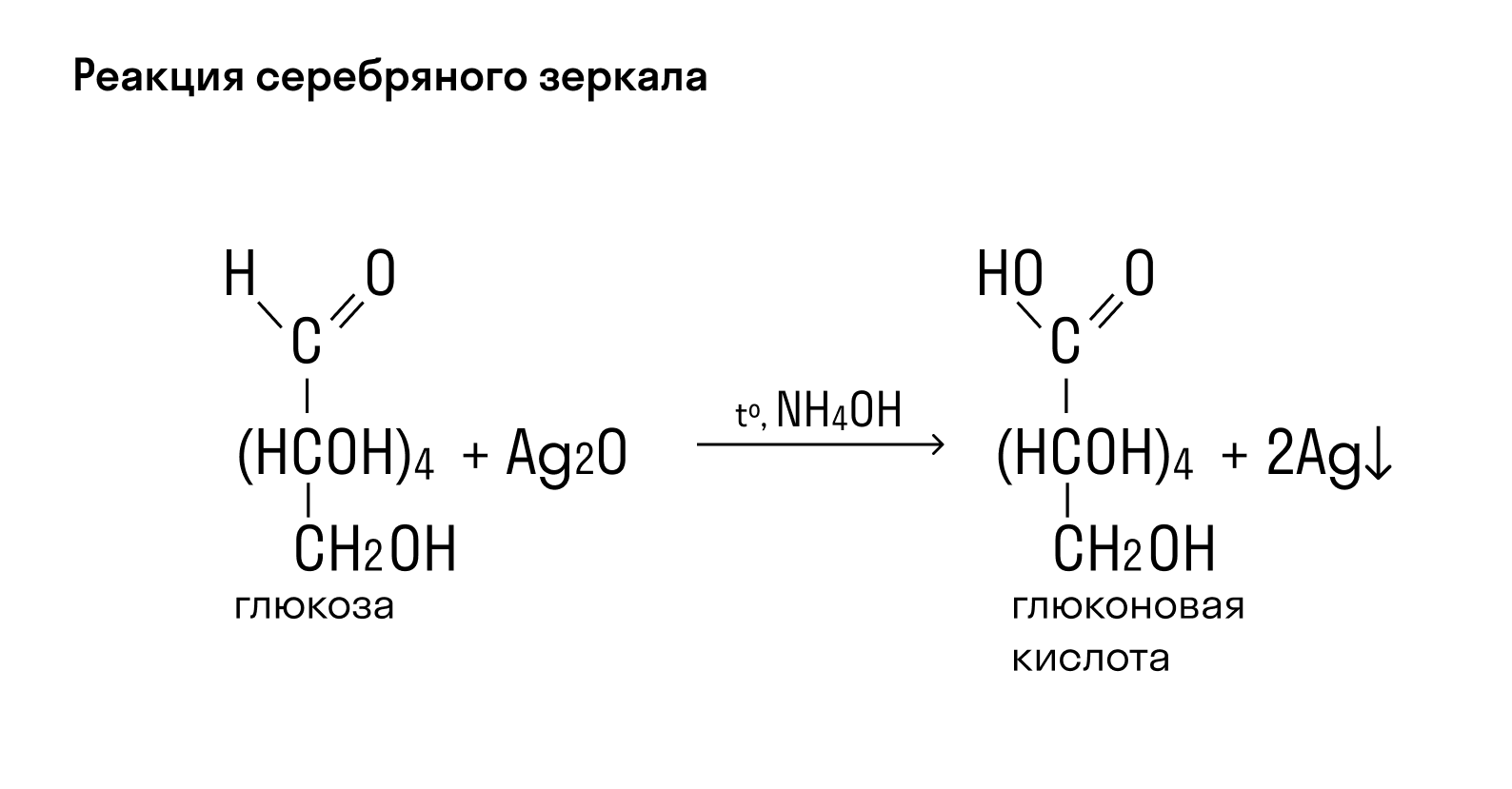
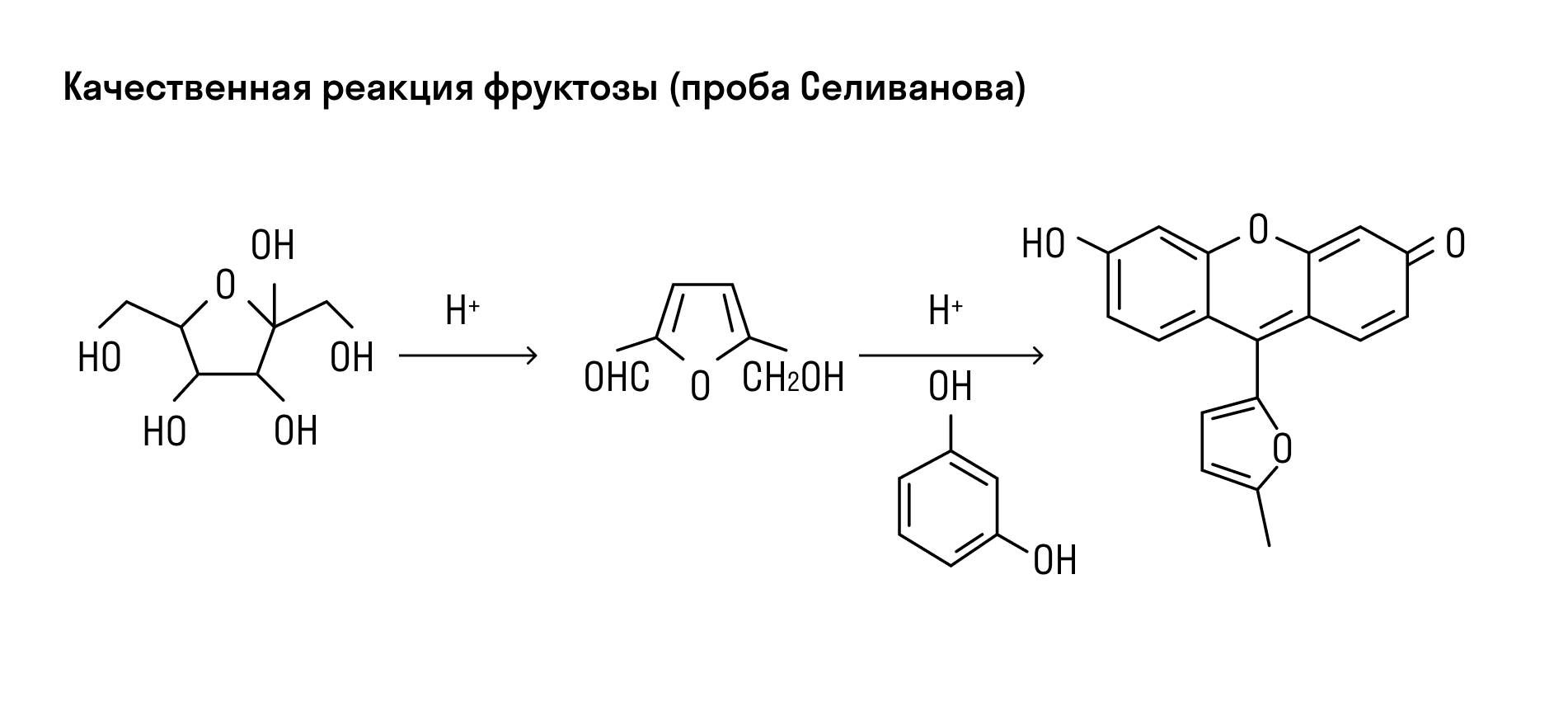
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Источник: skysmart.ru
ХИМИЧЕСКИЕ СВОЙСТВА СЕРЕБРА

По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла.
В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов.
При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий.
Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок :
Ag → Ag⁺ + е, φ0 = + 0,799В
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl.
Проверь хорошо ли Вы знаете науки
Ты получил <> снаружи >
Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
Соединения серебра
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag2О
Черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag⁺. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
2AgOH = Ag2O + Н2О.
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185—190°С Ag2О разлагается на элементы. Перекись водорода легко восстанавливается Ag2О уже при комнатной температуре:
В водном растворе аммиака Ag2О растворяется с образованием комплексного соединения:
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра
Малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид AgI выпадают в осадок при введении в раствор, содержащий ионы Ag⁺ (например, раствор AgNO3), ионов Сl⁻, Вr⁻ и I⁻. Их произведения растворимости составляют соответственно 1,8 • 10⁻¹º (AgCI), 5,3 • 10⁻¹³ (AgBr) и 8,3 •10⁻¹⁷ (AgI).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °с.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN⁻, S2O²3⁻, SO²3⁻ Cl⁻, NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN⁻ = Ag (CN)F + Сl⁻;
AgCl + 2S2C²3⁻ = Ag (S2O2)³2⁻ + Сl⁻;
AgCl + 2NH4OH = Ag(NH3)2+ + Сl⁻ + 2H2O.
Вследствие образования комплексов с ионами Сl³⁻ хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + Сl⁻ = AgCl⁻ 2.
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7•10³⁻моль/л (0,72 г/л Ag) против 1,3•10⁻⁵ в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в ре-зультате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) .хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид AgI
Наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN⁻ и S2O²3⁻ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI⁻2.
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувст-вительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgI
К галогенидам серебра очень близок по своим свойствам цианид AgCN.
Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag⁺, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3•10⁻¹⁶) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Нитрат серебра
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNО3 получают действием азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNО3 + NO + 2H2О.
Нитрат серебpa представляет собой бесцветные негигроскопичные кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgNО3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100 °С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4
Может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2Н2O.
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660°С. При температуре выше 1000°С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25°С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3• 10⁻⁵º). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха;
4Ag + 2H2S + O2 = 2Ag2S + 2Н2O
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN⁻ ⇄ 2Ag(CN)⁻2 + S²⁻
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN⁻ и удаление ионов S²⁻ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S + О2 = 2Ag + SО2
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN⁻ + О2 + 2Н2О = 4Ag(CN)7 + 4ОН⁻
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III),образуя комплексные катионы Ag[CS(NH2)2]⁺2
Статья на тему химические свойства серебра
Похожие страницы:
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit).
Ионные уравнения В обыкновенных химических уравнениях не учитывается диссоциация молекул на ионы, поэтому для выражения сущности реакций, происходящих при взаимодействии.
МИНЕРАЛЫ СЕРЕБРА Как и золото, серебро встречается в природе в самородном состоянии. Однако значительно чаще оно находится в рудах в.
АФФИНАЖ СЕРЕБРА Комплекс мероприятий по очищению загрязнённого материала от посторонних примесей , для дальнейшего получения серебра высокой чистоты . Они.
КАКИЕ БЫВАЮТ СОЛИ СЕРЕБРА Амид серебра (AgNH2) Антимонид серебра(I) (Ag3Sb) Арсенат серебра(I) (Ag3AsO4) Арсенид серебра(I) (Ag3As).
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com
Серебро: химические и физические свойства, сфера применения
Серебро, свойства атома, химические и физические свойства.
107,8682(2) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1
Серебро — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 47. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), пятом периоде периодической системы.
Атом и молекула серебра. Формула серебра. Строение атома серебра
Цена на серебро
Изотопы и модификации серебра
Свойства серебра (таблица): температура, плотность, давление и пр.
Физические свойства серебра
Химические свойства серебра. Взаимодействие серебра. Химические реакции с серебром
Таблица химических элементов Д.И. Менделеева










Применение серебра
Уже с давних времен серебро использовали при изготовлении зеркал, в настоящее время его заменяют алюминием для удешевления производства. Низкое электрическое сопротивление серебра находит применение в электротехнике и электронике, тут из него изготавливают разнообразные контакты и разъемы.
В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности. Интересно применение иодида серебра. С его помощью можно управлять погодой.
Распыляя ничтожные количества иодида серебра с самолета, добиваются образования водяных капель, т.е. проще говоря вызывается дождь. При необходимости можно выполнить и противоположную задачу, когда дождь совершенно не нужен, например, при проведении какого-то очень важного мероприятия. Для этого иодид серебра распыляют за десятки километров до места события, тогда дождь прольется там, а в нужном месте будет сухая погода. Серебро широко применяется в медицине. Его используют как зубные протезы, в производстве лекарств (колларгол, протаргол, ляпис и др.) и медицинских инструментов.

Серебряный столовый сервиз



Атом и молекула серебра. Формула серебра. Строение атома серебра:
Серебро (лат. Argentum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ag и атомным номером 47. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), пятом периоде периодической системы.
Серебро – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Как простое вещество серебро при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула серебра одноатомна.
Химическая формула серебра Ag.
Электронная конфигурация атома серебра 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1. Потенциал ионизации (первый электрон) атома серебра равен 731 кДж/моль (7,576234(25) эВ).
Строение атома серебра. Атом серебра состоит из положительно заряженного ядра (+47), вокруг которого по пяти оболочкам движутся 47 электронов. При этом 46 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку серебро расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома серебра на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона.
Серебро относится к элементам d-семейства.
Радиус атома серебра (вычисленный) составляет 165 пм.
Атомная масса атома серебра составляет 107,8682(2) а. е. м.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Сера, свойства атома, химические и физические свойства



Серебро в природе
Квантовые числа Ag
Квантовые числа определяются последним электроном в конфигурации, для атома Ag эти числа имеют значение N = 4, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):


Интересные факты
Уникальным остается то явление, что серебро никогда не встречается в местах, где осуществляется добыча золота. Как и золото не найти в месторождениях серебра. Этот факт до сих пор вызывает удивление, но объяснения ему ученые так и не нашли. Кроме этого, внимание привлекают и два других момента, свойственных серебру:
- Отрицательное воздействие на организм. Несмотря на многие целебные свойства, которые с древних времен приписывают серебру, его концентрация в слишком больших количествах может оказать губительное влияние на человеческий организм. Посредством проведения разных экспериментов ученые доказали, что превышение максимально допустимого количества ионов серебра может снизить иммунитет живых организмов, изменить нормальное естественное течение и функционирований работы нервной и сердечно-сосудистой систем. Наибольшее отрицательное воздействие серебро оказывает на работу печени, почек и щитовидной железы. Интересно! Нередки случаи отравления людей препаратами, в состав которых входит серебро. Основные признаки интоксикации – неожиданные психические расстройства. Приступы удавалось купировать благодаря легкому выведению серебра из организма.
- Потемнение серебряных изделий. Украшения из серебра, продающиеся в ювелирных магазинах, в составе сплавов, из которых они делаются, содержат медь. Влажный воздух, пот, вода и другие структуры вызывают процессы окисления меди. Это проявляется в потемнении серебряного изделия за счет образовавшегося на его поверхности сульфида серебра, становящегося толще, если не принять своевременные меры по его удалению.
Кроме внешних факторов, потемнение серебра может быть спровоцировано внутренними изменениями в организме. В большей степени это отражается на тех, кто привык носить серебро ежедневно.
Кроме того, что серебро продолжает оставаться на пике моды среди ювелирных украшений, а также используется в различных сферах человеческой деятельности, оно еще является неплохим способом инвестирования. Совокупность этих свойств и определяют ценность благородного металла в современном мире.
Вас может заинтересовать: Какова динамика цен и курс серебра в российских банках?
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник статьи: https://k-tree.ru/tools/chemistry/periodic.php?element=Ag
Добыча
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, в Крит и Грецию.
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд.
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т ) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире.
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген .
Во II—XIII веках действовало множество рудников по всей Европе , которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце , Тироле (главный центр добычи — Швац ), Рудных горах , позднее в Силезии , Трансильвании , Карпатах и Швеции . С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек. Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах . Главным источником становится Мексика , где в 1521 — 1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо [прояснить
] и 6 «
прочных реалов
» (последний в 1732 году равнялся 85 мараведи ).
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения ( Нерчинский горный округ ). В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
В 2008 добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
- На 2008 год лидером добычи серебра в России является , добывшая в 2008 году 535 т .
- В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Мировая добыча серебра (1990-2017)(1990-2007 — данные U.S. Geological Survey, 2008-2017 — данные The Silver Institute):
Мировые запасы серебра оцениваются в 505 тыс. т (на 1986 год), подтверждённые — 360 тыс. т
Этимология и история
По-латыни серебро называется argentum. Несложно догадаться, какой химический элемент имеет обозначение Ag.
Серебро известно с древних времен. Отвалы шлака, найденные в Малой Азии и на островах Эгейского моря, указывают на то, что оно отделялось от свинца уже в IV тысячелетии до н. э. Исторически серебро использовалось для изготовления украшений и посуды. Кроме того, оно применялось в торговле и было основой многих денежных систем. Его ценность как драгоценного металла долго считалась второй после золота. А в Древнем Египте и в Средневековой Европе оно часто ценилось выше.
В Библии серебро упоминается уже в Книге Бытия. Согласно Новому Завету, Иуда Искариот получил плату в размере 30 сребреников от религиозных лидеров в Иерусалиме, чтобы предать римлянам Иисуса Христа.
Алхимики связывали этот металл с Луной, морем и различными лунными богинями, и даже называли его «луна». Один из алхимических символов данного химического элемента – полумесяц с вогнутой частью слева.
Металлическую ртуть когда-то считали видом серебра, хотя эти вещества химически не связаны. Латинское название ртути Hydrargyrum буквально означает «водянистое серебро».

Валентность Ag
Атомы серебра в соединениях проявляют валентность III, II, I.
Валентность серебра характеризует способность атома Ag к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Источник: bijou-os.ru