Медь(лат. Cuprum), Cu, химический элемент I группы короткой формы (11-й группы длинной формы) периодической системы ; атомный номер 29, атомная масса 63,546 а. е. м.; относится к переходным металлам . В природе два стабильных изотопа : 63 Cu (69,17 %) и 65 Cu (30,83 %); искусственно получены радиоизотопы с массовыми числами 52–80.
С древности до начала широкого использования железа медь и её сплавы играли важную роль в развитии материальн ой культуры человечества ( медный век , бронзовый век ). Раннему знакомству человека с медью способствовало то, что этот металл встречается в природе в свободном состоянии в виде самородков , иногда значительных размеров, которые имеют большее распространение в природе по сравнению с самородками других металлов (в том числе золота ). Кроме того, благодаря способности легко восстанавливаться из оксидов и карбонатов, медь была, вероятно, первым металлом, который человек научился восстанавливать из кислородных соединений, содержащихся в рудах. По-видимому, в разных районах мира исторически имели место два пути освоения меди: в одних случаях человек впервые знакомился с самородной медью, в других – получал медь плавкой окисленных руд. Оценки периода начала использования меди сильно различаются: по последним данным, на Ближнем Востоке, на территории Анатолии, в начале 7-го тыс. до н. э. использовалась металлургическая медь. Латинское название меди произошло от названия о. Кипр , где уже в 3 в. до н. э. существовали медные рудники, с которых римляне вывозили руду.
Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 класс

Топор-тесло, медь. 4 тыс. до н. э. Майкопский курган. Топор-тесло, медь. 4 тыс. до н. э. Майкопский курган.
Распространённость в природе

Сросток тетраэдрических кристаллов халькопирита на кварцевой щётке (штат Сакатекас, Мексика). Экспонат из коллекции Национального музея естественной истории (Вашингтон, США). Смитсоновский институт. Сросток тетраэдрических кристаллов халькопирита на кварцевой щётке (штат Сакатекас, Мексика). Экспонат из коллекции Национального музея естественной истории (Вашингтон, США).
Смитсоновский институт.
Свойства

Конфигурация внешней электронной оболочки атома меди 3d 10 4s 1 ; в соединениях проявляет степени окисления +1 и +2 (наиболее типична), редко +3; электроотрицательность по Полингу 1,9; энергии ионизации Cu 0→Cu + →Cu 2+ →Cu 3+ соответственно равны 745,5, 1957,9 и 3555,0 кДж/моль; атомный радиус 135 пм (эмпирический). Ионные радиусы в пм (в скобках указаны координационные числа ): Cu + 74 (4); 91 (6); C u 2+ 71 (4); 87 (6); Cu 3+ 68 (6).
Решение цепочек превращений по химии
В компактном виде медь – ковкий и пластичный металл розовато-красного цвета с характерным металлическим блеском, при просвечивании в тонких слоях – зеленовато-голубого цвета. Кристаллическая решётка гранецентрированная кубическая; tпл1084,62 °C; tкип2567 °C, плотность 8920 кг/м 3 (20 °С).
Наиболее важные используемые свойства меди: высокая теплопроводность – 400 Вт/(м·К), малое удельное электрическое сопротивление – 1,7·10 –8 Ом·м (при 20 °С). Температурный коэффициент линейного расширения 16,5·10 –6 К –1 . Медь диамагнитна , удельная магнитная восприимчивость –0,086·10 –9 м 3 /кг.
Твёрдость по Бринеллю 450–1100 МПа, предел прочности при растяжении около 200 МПа, относительное удлинение 60 %, модуль упругости 110–130 ГПа. Небольшие примеси Bi и Pb вызывают красноломкость меди; S и кислорода – хладноломкость; примеси P, As, Al, Fe уменьшают электрическую проводимость меди; растворённый в меди водород существенно ухудшает её механические свойства. Образец меди.
Фото: Zelenskaya / Shutterstock Образец меди. Фото: Zelenskaya / Shutterstock Медь химически малоактивна. Компактный металл при температурах ниже 185 °С с сухим воздухом и кислородом не взаимодействует; в присутствии паров воды, CO2и SO2на поверхности меди образуется зеленоватый налёт (патина) основных солей – карбонатов CuCO3·Cu(OH)2и сульфатов CuSO4·3Cu(OH)2.
При нагревании меди на воздухе идёт поверхностное окисление: при температуре ниже 375 °С образуется CuO, в интервале 375–1100 °С – двухслойная окалина (в поверхностном слое находится CuO, во внутреннем – Cu2O). В присутствии влаги хлор взаимодействует с медью уже при комнатной температуре, образуя дихлорид CuCl2, хорошо растворимый в воде.
Медь взаимодействует с другими галогенами (образуя галогениды CuHal2и CuHal, где Hal – F, Cl, Br, I), с серой и с селеном , горит в парах серы. С водородом, азотом и углеродом медь не реагирует даже при высоких температурах. Растворимость водорода в твёрдой меди незначительна (0,06 мг в 100 г меди при 400 °С). При пропускании NH3над раскалённой медью образуется CuN3.
При высокой температуре медь подвергается воздействию оксидов азота : NO, N2O (с образованием Cu2O) и NO2(с образованием CuO). Карбиды Cu2C3и CuC2получают действием ацетилена на аммиачные растворы солей меди.
С большинством металлов медь образует твёрдые растворы или интерметаллиды . Медь вытесняется из солей более электроотрицательными элементами (в промышленности используют железо ) и не растворяется в неокисляющих кислотах. В азотной кислоте медь растворяется, образуя Cu(NO3)2и оксиды азота, в горячей концентрированной H2SO4– c образованием CuSO4и SO2. Соли Cu(I) бесцветны, практически нерастворимы в воде, легко окисляются, склонны к диспропорционированию 2 C u + → C u 2 + + C u 0 2Cu^ → Cu^ + Cu^ 2 C u + → C u 2 + + C u 0 . Соли Cu(II) хорошо растворяются в воде, в разбавленных кислотах полностью диссоциированы . Гидратированные ионы Cu 2+ окрашены в голубой цвет. Соли Cu(I) и Cu(II) с рядом молекул и ионов образуют многочисленные устойчивые комплексные соединения , например (NH4)[CuBr3], K3[Cu(CN)4], K2[CuCl4]. Путём образования комплексных соединений можно перевести в раствор многие нерастворимые соли Cu. Медь входит в состав различных медьорганических соединений .
Биологическая роль
Получение
Бо́льшу ю часть металлической меди получают из сульфидных руд, которые, как правило, содержат 0,5–1,2 % меди. Размолотую руду подвергают флотационному обогащению; полученный концентрат содержит до 15 % меди.
Основным методом извлечения меди из концентратов является пирометаллургический , в котором после обогащения концентрат подвергают окислительному обжигу при 1400 °С: C u F e S 2 + O 2 = C u 2 S + 2 F e S + S O 2 CuFeS_ + O_ = Cu_S + 2FeS + SO_ C u F e S 2 + O 2 = C u 2 S + 2 F e S + S O 2 ; 2 F e S + 3 O 2 = 2 F e O + 2 S O 2 2FeS + 3O_ = 2FeO + 2SO_ 2 F e S + 3 O 2 = 2 F e O + 2 S O 2 . При обжиге удаляют избыточное количество S в форме газов, содержащих 5–8 % SO2и используемых для производства H2SO4. Обжиг проводят в печах в кипящем слое с применением дутья , обогащённого O2(24–26 % O2), без затрат углеродистого топлива.
Затем обожжённый концентрат подвергают плавке (в печах отражательного типа) на штейн, при этом в расплав для связывания оксида железа добавляют кремнезём : F e O + S i O 2 = F e S i O 3 FeO+SiO_=FeSiO_ F e O + S i O 2 = F e S i O 3 . Образующийся шлак – FeSiO3– всплывает, и его удаляют из печи непрерывно. Оставшийся на дне штейн (сплав Cu2S, FeS и сульфидов других металлов, обогащённый Cu2S) подвергают кислородной плавке в конвертере ; при этом оставшийся сульфид железа FeS окисляется до оксида и в результате добавления кремнезёма выводится из процесса в виде FeSiO3.
Сульфид меди Cu2S частично окисляется до оксида Cu2O. В конвертере (без дутья) происходит взаимодействие Cu2O и Cu2S, оставшихся в расплаве: 2 C u 2 O + C u 2 S = 6 C u + S O 2 2Cu_O + Cu_ S= 6Cu + SO_ 2 C u 2 O + C u 2 S = 6 C u + S O 2 . Получаемая «черновая» медь содержит 90–95 % основного компонента и подлежит дальнейшей очистке методом огневого рафинирования путём окисления примесей различных металлов.
Из получаемой «красной» меди (95–98 % основного компонента) отливают аноды , используемые для электролитического рафинирования меди. В качестве электролита используют водный раствор медного купороса CuSO4; катодом служат тонкие листы из чистой меди.
В процессе электролиза высокочистая «электролитическая» медь (99,99 %) осаждается на катодах, примеси собираются в виде анодного шлама , который содержит ценные примеси – металлические Ag, Au, Pt, а также значительные количества халькогенидов меди Cu2S, Cu2Se, Cu2Te, подлежащих промышленной переработке. Наряду с пирометаллургическим методом получения меди, большое значение имеют гидрометаллургические методы (особенно для бедных окисленных и самородных руд), основанные на избирательном растворении медьсодержащего сырья в разбавленных растворах H2SO4или NH3с последующим выделением меди из раствора (электролитическим способом или осаждением железом). Большое значение имеет переработка вторичного сырья, из которого в ряде стран получают более 30 % производимой меди. Мировое производство меди 25,3 млн т/год (2020).
Применение
Использование меди в промышленности связано в первую очередь с её высокими тепло- и электропроводностью, пластичностью. До 50 % меди применяется в электротехнике (изготовление проводов, кабелей, шин, контактов и других токопроводящих частей электрических установок).
Все примеси понижают электропроводность меди, поэтому в электротехнике используют металл, содержащий не менее 99,99 % основного компонента. Высокие теплопроводность и антикоррозионные свойства позволяют изготавливать из меди детали теплообменников , криогенных установок , вакуумных аппаратов и др.
Более 30 % меди применяют в виде сплавов, важнейшие из которых – бронзы , латуни , мельхиор . В виде фольги медь применяют в радиоэлектронике. Около 10–12 % меди (главным образом в виде солей) используется для приготовления красок , инсектофунгицидов, микроудобрений , катализаторов окислительных процессов, в медицине ( антисептические и вяжущие средства), а также в кожевенной и меховой промышленности, в производстве искусственного шёлка. Медь и её сплавы используются для изготовления монет, украшений, утвари, кованых, литых и других художественных изделий. Зимина Галина Владимировна . Первая публикация: Большая российская энциклопедия, 2011.
в 17:12 (GMT+3) Обратная связь
Информация

Области знаний: Общие вопросы химии Символ: Cu Атомный номер: 29 Группа элементов: Переходные металлы Относительная атомная масса: 63,546 а. е. м. Радиус атома: 135 пм Электроотрицательность: 1,9 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность: 8,92 г/см³ (при 20 °С) Температура плавления: 1084,62 °C Температура кипения: 2567 °C
Источник: bigenc.ru
1. Медь: строение атома, получение, физические и химические свойства
Медь — химический элемент № (29). Она расположена в побочной подгруппе (I) группы, в четвёртом периоде.
В атоме меди полностью заполнен третий электронный слой, а на внешнем слое находится (1) (s)-электрон: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1 .
Электронно-графическая схема атома меди выглядит следующим образом.

На наружном уровне в атоме меди всего один электрон, но в образовании химических связей участвуют также электроны с предвнешнего уровня. Поэтому медь образует соединения со степенями окисления (+1) и (+2).
Нахождение в природе и получение
По содержанию в природе медь занимает (23) место среди всех элементов. Она встречается в самородном виде и в виде соединений. Важнейшие медные руды: халькозин (медный блеск) Cu 2 S , халькопирит (медный колчедан) CuFeS 2 и малахит ( CuOH ) 2 CO 3 .



Рис. (1). Медный блеск
Рис. (2). Медный колчедан
Рис. (3).
Малахит
Для получения меди используют пирометаллургические, гидрометаллургическиеи электрометаллургическиеспособы.
1) Сульфидные руды подвергаются обжигу, а карбонатные — термическому разложению. Образовавшиеся оксиды меди восстанавливают при высокой температуре:
CuO + H 2 = t Cu + H 2 O .
2) Природные соединения обрабатываются серной кислотой, их превращают в сульфат меди((II)):
( CuOH ) 2 CO 3 + 2 H 2 SO 4 = 2 Cu SO 4 + 3 H 2 O + CO 2 ↑ .
Медь восстанавливают из полученного раствора с помощью железа или электролизом:
Fe + CuSO 4 = Cu ↓ + FeSO 4 ;
2 CuSO 4 + 2 H 2 O = эл . ток 2 Cu ↓ + O 2 ↑ + 2 H 2 SO 4 .
Физические свойства меди
Чистая медь — пластичный светло-розовый металл, который легко прокатывается в листы и вытягивается в проволоку. Медь имеет высокую электро- и теплопроводность (уступает только серебру), используется в электротехнике для изготовления проводов, кабелей и других токопроводящих изделий.

Рис. (4). Медный кабель
Медь относится к тяжёлым металлам, её плотность составляет (8,92) г/см³. Плавится медь при температуре (1083,4°C).
Химические свойства
В ряду активности медь располагается после водорода, относится к малоактивным металлам.
В сухом воздухе медь почти не изменяется, а во влажном реагирует с кислородом, водой и углекислым газом, поэтому постепенно покрывается зелёным налётом основного карбоната:
2 Cu + O 2 + H 2 O + CO 2 = ( CuOH ) 2 CO 3 .
Медь не реагирует с водородом, азотом, фосфором, углём и кремнием, но вступает в реакции с более активными неметаллами.
Реагенты
Характеристика реакций
Уравнения реакций
Cu + Cl 2 = CuCl 2 ;
Cu + Br 2 = CuBr 2
2 Cu + O 2 = t 2 CuO ;
4 Cu + O 2 = t 2 Cu 2 O
Сера, селен
2 Cu + S = t Cu 2 S ;
Cu + Se = t CuSe
Медь не реагирует с водой и не вытесняет водород из кислот, но взаимодействует с азотной и серной концентрированной кислотами. Она может вытеснять из растворов солей менее активные металлы (серебро, ртуть, золото, платину).
Источник: www.yaklass.ru
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

- Fe(CrO2)2- хромистый железняк, хромит
- (Mg, Fe)Cr2O4- магнохромит
- (Fe, Mg)(Cr, Al)2O4- алюмохромит

В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3- происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии.

С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3→ Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3+ 2NaOH → (t°) 2NaCrO2+ H2O (прокаливание, хромит натрия)
Cr2O3+ HCl = CrCl3+ H2O (сохраняем степень окисления Cr +3 )

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
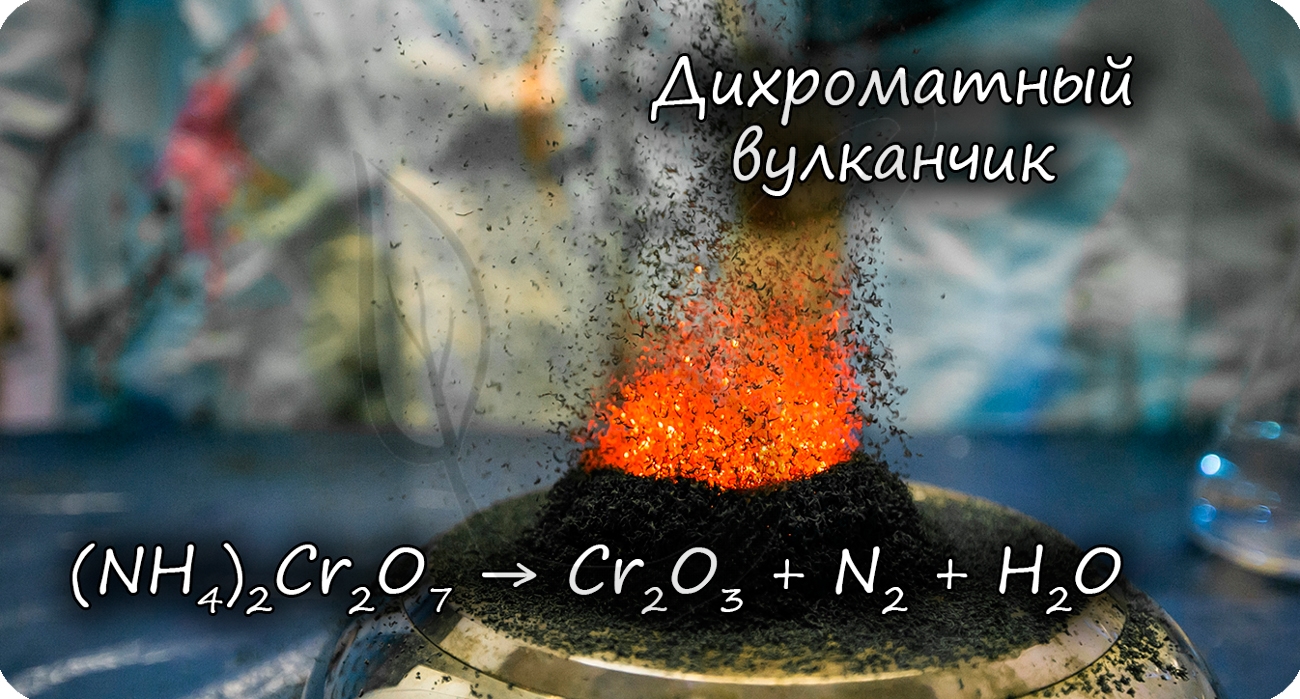
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

- Fe2O3- красный железняк, гематит
- Fe3O4- магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2- пирит, серый или железный колчедан
- FeCO3- сидерит

Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.

Fe + S = FeS (t > 700°C)
Fe + S = FeS2(t 2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3+ KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.

И еще одна качественная реакция на ионы Fe 3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3в щелочи.

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

- CuFeS2- медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2- малахит

Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4+ H2O = Cu + O2+ H2SO4(медь — на катоде, кислород — на аноде)
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2= (t) 2Cu2O (при недостатке кислорода)
2Cu + O2= (t) 2CuO (в избытке кислорода)

Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
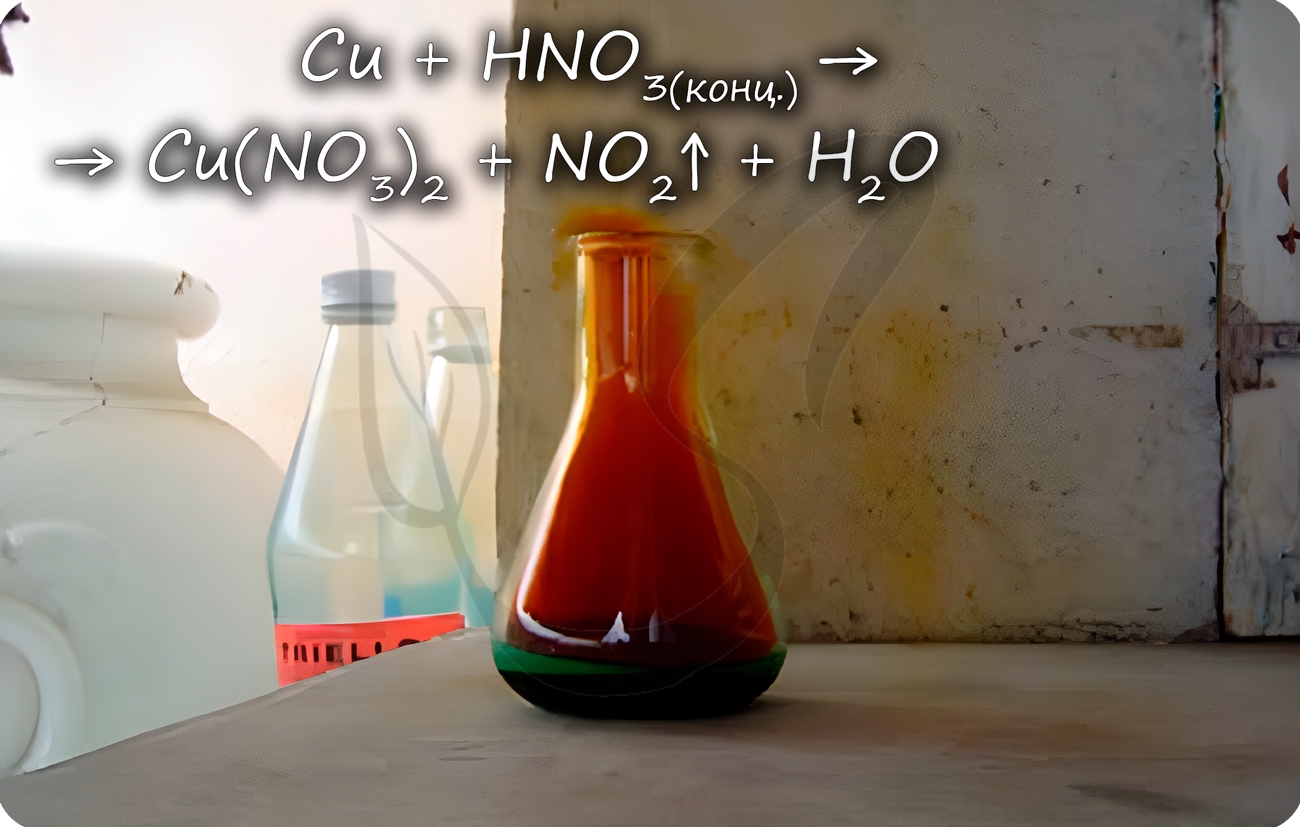
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3к 3 объемам HCl.
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2= (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
CuO + CO = Cu + CO2
Гидроксид меди (II) — Cu(OH)2- получают в реакциях обмена между растворимыми солями меди и щелочью.

При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Хром, железо и медь
Источник: studarium.ru