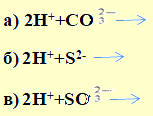«Нитрат серебра (AgNO₃) – хорошо растворимое в воде бесцветное твёрдое кристаллическое вещество. Его можно получить взаимодействием серебра или оксида серебра (Ag₂O) с азотной кислотой (HNO₃). В результате реакции с серебром также выделяется бурый газ – NO₂, который легко реагирует со щелочами, например, с гидроксидом калия или натрия (KOH и NaOH), образуя соли.
Нитрат серебра используется в аналитической химии, т.к. является реактивом на соляную кислоту (HCl) и её соли – хлориды: катион серебра (Ag⁺), взаимодействуя с хлоридионом (Cl⁻), образует белый творожистый осадок хлорида серебра (AgCl). AgNO₃ применяется в фотографии, при изготовлении зеркал, чернил и красителей, в медицине».
1) Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ, из тех, о которых говорится в приведённом выше тексте.

Реакция ХЛОРИДА ЦИНКА и ХРОМАТА НАТРИЯ. Реакция ХРОМАТА ЦИНКА. Опыты по химии.
2) Составьте молекулярное уравнение реакции получения нитрата серебра из серебра, которая упоминалась в тексте. Возможно ли получение нитрата серебра взаимодействием серебра с нитратом цинка?
3) Составьте молекулярное уравнение упомянутой в тексте реакции между нитратом серебра и соляной кислотой.
Составьте сокращённое ионное уравнение этой реакции.
Источник: www.bolshoyvopros.ru
Цинк и нитрат серебра тип реакции
Привет Лёва Середнячок

записать уравнение в ионной форме
ZnCl2+AgNO3=
5 (2 оценки)
magma19821981 5 лет назад
Светило науки — 175 ответов — 261 помощь
ZnCl2+2AgNO3=Zn(NO3)2+2AgCl Полное ионное: Zn(2+) + 2Cl(-) + 2Ag(+) + 2NO3(-) = Zn(2+) + 2NO3(-) + 2AgCl Сокращённое ионное: 2Ag(+) + 2Cl(-) = 2AgCl
5 (1 оценка)

Heyheyheyheyhey1 5 лет назад
Светило науки — 202 ответа — 0 раз оказано помощи
ZnCl2+2AgNO3=Zn(NO3)2+2AgCl
Zn^2+ + 2Cl^- +2Ag^+ + 2NO3^-=Zn^2+ q
+ 2NO3^- +2AgCl
2Cl^- +2Ag^+=2AgCl
Источник: vashurok.com
Вопросы к параграфу 9 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман

Качественные реакции — реакции, при которых определяют наличие того или иного иона. Эти реакции выявляют определённый (качественный) признак: изменение цвета, образование запаха, выпадение осадка и т.д.
Опыты по химии. Растворение цинка в кислотах и щелочах
2. Даны растворы, содержащие ионы Ag+, SO(2-/4), Н+, I-. Используя Приложение 1 (с. 202—203), определите, с помощью каких реактивов можно определить эти растворы. Напишите уравнения соответствующих реакций.
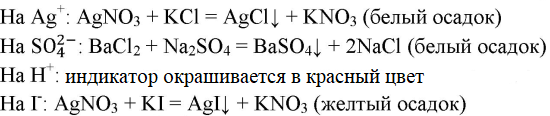
3. Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди(II) и гидроксида калия; в) сульфата цинка, хлорида магния и фосфата натрия; г) хлорида железа(III) и сульфата магния. При сливании каких растворов реакции обмена пойдут до конца и почему? Составьте уравнения этих реакций в молекулярном, полном и сокращённом ионном виде.

4. Даны схемы реакций:
Составьте уравнения соответствующих реакций в молекулярном виде.
5. В раствор, содержащий 40 г сульфата меди(II), поместили железные опилки. Какие вещества образуются в результате реакции и какова их масса?

6. К 20 г раствора, содержащего 5% сульфата меди(II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
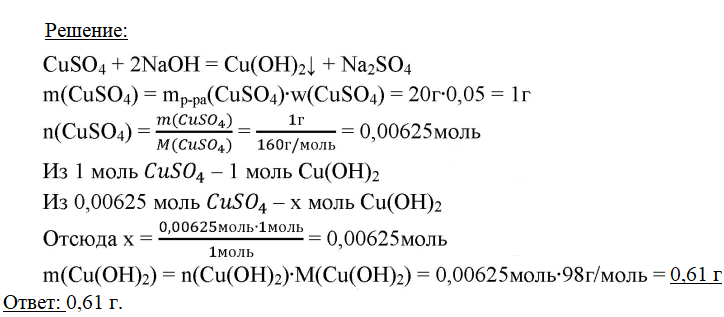
Тестовые задания
1. Реакция ионного обмена возможна между растворами веществ
1) Na2CO3 и HNO3
2) CuCl2 и NaNO3
3) КСl и NaNO,
4) Са(ОН)2 и KNO3
1) Na2CO3 и HNO3
2. При добавлении раствора хлорида калия к раствору нитрата серебра
1) выпадает осадок
2) выделяется газ
3) выпадает осадок и выделяется газ
4) видимых изменений не происходит
1) выпадает осадок
К2СO3 + HNO3→KNO3 + H2O + СO2, соответствует сокращённое ионное уравнение
1) Н+ + ОН = Н2O
2) СO3 + 2Н+ = Н2O + CO2
3) НО + СO2 = 2Н+ + СO3
4) К2СО3 = 2К+ + СО3
2) СO3 + 2Н+ = Н2O + CO2
Источник: gdzwow.com