Коллоидные раствора или золи – это микрогетерогенные системы, в которых дисперсная фаза в виде частиц (размером порядка 10 -9 – 10 -7 м ) нерастворимого твердого вещества равномерно распределена в жидкой дисперсионной среде.
Частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из ионов и молекул дисперсионной среды называются мицеллами.
Золи подразделяются на лиофильные и лиофобные (в случае водной дисперсионной среды – на гидрофильные и гидрофобные). В лиофильных золях частицы дисперсной фазы сильно взаимодействуют со средой (например, образуют водородные связи), или же межмолекулярное взаимодействие по обе стороны поверхности раздела «дисперсная фаза – дисперсионная среда» различается незначительно. Поэтому удельная свободная поверхностная энергия чрезвычайно мала, и межфазная граница может быть размыта. Такие золи образуются самопроизвольно и при сохранении условий их образования могут существовать сколь угодно долго. Примером лиофильных золей могут служить мицеллярные растворы поверхностно-активных веществ (ПАВ).
Строение и функции клетки в целом. Интерфаза, митоз и мейоз. Structure and function of the cell
В лиофобных коллоидах межмолекулярное взаимодействие в дисперсионной среде и дисперсной фазе существенно различно, удельная свободная поверхностная энергия велика, граница раздела фаз выражена достаточно четко. Избыток свободной поверхностной энергии обусловливает стремление частиц перейти в энергетически более выгодное состояние с меньшей поверхностью. Происходит укрупнение частиц. Чтобы лиофобные коллоиды были устойчивы, необходимо присутствие стабилизатора. Такие золи самопроизвольно не образуются, для их получения требуется затрата энергии.
Лиофобные золи можно получить следующими способами:
1) диспергирование (измельчение вещества); 2) конденсация (объединение молекул или атомов); 3) пептизация (разъединение слипшихся частиц).
Диспергирование можно осуществить механическим раздроблением вещества в специальных коллоидных мельницах, в результате применения ультразвука, методом электрического распыления. Два последних метода диспергирования проводят в дисперсионной среде в присутствии стабилизатора.
Конденсационные методы включают в себя: 1) физическую конденсацию (испарение вещества с последующей конденсацией в более крупные частицы); 2) химическую конденсацию (проведение реакции образования труднорастворимого вещества в разбавленном растворе, что обеспечивает малую скорость роста агрегатов, а, следовательно, и малые их размеры (10 –9 – 10 –7 м), в присутствии одного из компонентов реакции, выполняющего функцию стабилизатора коллоидных частиц); 3) метод замены растворителя (раствор вещества постепенно при перемешивании прибавляется к жидкости, в которой это вещество нерастворимо).
При пептизации ионы пептизатора адсорбируются на поверхности слипшихся частиц, заряжая их одноименно. В результате частицы начинают отталкиваться друг от друга, постепенно распределяясь по всему объему дисперсионной среды.
К лиофобным золям относятся почвенные коллоиды, природные воды, с коллоидно-химическими процессами связано производство вяжущих неорганических веществ, керамики, стекла. Сложные коллоидные системы содержат в своем составе животные и растительные организмы. Многие лекарственные вещества, средства борьбы с вредителями и сорняками применяются в коллоидном состоянии.
Коллоидная химия. Лекция 2. Физико — химия дисперсных систем
Рассмотрим строение мицеллы лиофобного золя на примере образования коллоидного раствора иодида серебра при сливании разбавленных растворов нитрата серебра и иодида калия, причем KI взят в избытке и выполняет функцию стабилизатора. Иодид серебра образуется в результате обменной реакции:
Микрокристалл малорастворимого иодида серебра, состоящие из m частиц AgI, называется агрегатом. На поверхности агрегата могут избирательно адсорбироваться ионы из раствора, причем в первую очередь адсорбируются те из них, которые присутствуют в избытке и родственны составу агрегата (правило Панета-Фаянса). В нашем примере – это анионы йода.
Их называют потенциалопределяющими ионами. Допустим их n. Агрегат вместе с потенциалопределяющими ионами является частицей твердой фазы и называется ядром.
За счет электростатического притяжения анионы йода будут удерживать возле себя катионы калия, которые также присутствуют в избытке. Эти катионы называются противоионами. Противоионы, наиболее близко расположенные к ядру, находятся в слое жидкости, смачивающей его поверхность, и испытывают не только электростатическое, но и ван-дер-ваальсово притяжение ядра.
Поэтому эти ионы наиболее прочно связаны с ядром. Они называются противоионами адсорбционной сферы. Однако их количество недостаточно для полной нейтрализации суммарного заряда потенциалопределяющих ионов. Образование, состоящее из ядра и адсорбционной сферы противоионов, носит название коллоидной частицы или гранулы. Она несет заряд, равный алгебраической сумме зарядов ионов адсорбционной сферы.
Остальные противоионы, слабее связанные с ядром, под действием теплового движения располагаются в жидкой фазе диффузно, то есть размыто. Они образуют диффузную сферу, нейтрализуя заряд коллоидной частицы.
Гранула в совокупности с диффузной сферой образуют мицеллу. Мицелла электронейтральна. Схематично строение мицеллы рассматриваемого золя приведено на рисунке 2.8.1.
При движении дисперсной фазы относительно дисперсионной среды граница скольжения проходит вблизи раздела между адсорбционным и диффузным слоем противоионов. То есть гранула движется как целое, а диффузный слой противоионов непрерывно переформировывается во время движения.
< [AgI]m, n I – , (n-x) K + > x – x K +
агрегат потенциал- противоионы противоионы
определяющие адсорбционной диффузной
ионы сферы сферы
коллоидная частица (гранула)
Рисунок 2.8.1 – Схема строения мицеллы золя AgI при избытке KI
Устойчивость гидрофобного золя не всегда обусловливается введением стабилизатора. Двойной электрический слой может образовываться и за счет ионогенных продуктов взаимодействия поверхности ядра с дисперсионной средой (например, золь гидратированного оксида кремния (IV)).
Процесс слипания коллоидных частиц (потеря золем агрегативной устойчивости) называется коагуляцией. Процессу коагуляции золя способствуют вибрация, нагревание, замораживание, пропускание электрического тока, длительное стояние (старение золя), прибавление электролита.
Коагуляцию вызывают ионы электролита, несущие заряд, противоположный по знаку заряду коллоидной частицы. В соответствии с правилом Шульце–Гарди, коагулирующее действие электролита сильно возрастает с ростом заряда иона-коагулятора.
Минимальная концентрация электролита (может выражаться в моль/л, ммоль/л, кмоль/м 3 ), вызывающая явную коагуляцию золя, называется порогом коагуляции. Порог коагуляции СК, выраженный в моль/л, может быть рассчитан по формуле:

, (2.8.1)
где С(1/zX) – молярная концентрация эквивалента электролита Х, моль/л;
VЭЛ.. и VЗ – объемы электролита и золя соответственно, л.
Теоретические расчеты показывают, что порог коагуляции золя электролитом СК обратно пропорционален заряду иона-коагулянта Z в шестой степени:
где К — постоянная для данного золя величина.
Если принять порог коагуляции трехзарядного иона за единицу, то для соотношения порогов коагуляции ионов с различными зарядами можно записать приближенно:
В реальных системах могут наблюдаться отклонения от приведенных цифр, но порядки величин сохраняется.
При сливании коллоидных растворов с противоположными зарядами частиц, может происходить взаимная коагуляция.
Различают медленную и быструю коагуляцию. При медленной коагуляции не каждое столкновение между частицами приводит к их слипанию. Этот вид коагуляции на первых стадиях может не проявляться визуально. При быстрой коагуляции эффективным является каждое столкновение между частицами.
Теорию кинетики быстрой коагуляции монодисперсных систем разработал Смолуховский. Он представил процесс уменьшения общего числа частиц во времени аналогичным реакции второго порядка, то есть скорость уменьшения числа частиц n за время t определяется уравнением:

, (2.8.2)
где К – константа скорости коагуляции.
После интегрирования этого уравнения получаем следующее выражение:
 или
или  . (2.8.3)
. (2.8.3)
Если экспериментальные данные представить в виде графика зависимости  от t, то получится прямая линия. На основании графика можно определить значение К (как тангенс угла наклона прямой к оси абсцисс) и число исходных частиц n0 (отрезок, отсекаемый прямой на оси ординат, равен
от t, то получится прямая линия. На основании графика можно определить значение К (как тангенс угла наклона прямой к оси абсцисс) и число исходных частиц n0 (отрезок, отсекаемый прямой на оси ординат, равен  )
)
Уравнение Смолухоского
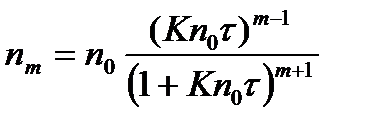
, (2.8.4)
где t — время коагуляции;
nm – число частиц, являющихся агрегатом m -ного порядка по отношению к исходным частицам;
n0 – первоначальное число частиц;
К – константа скорости коагуляции.

, (2.8.5)
где – вязкость среды.
Для первичных частиц уравнение Смолуховского приобретает следующий вид:
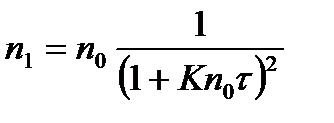
. (2.8.6)
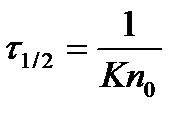
Если ввести понятие времени половинной коагуляции t1/2 (время, необходимое для уменьшения числа первоначальных частиц вдвое, ), то предыдущее уравнение перепишется следующим образом:

(2.8.7)
При определенных условиях золи могут превращаться в гели – дисперсные системы с жидкой дисперсионной средой, в которой мицеллы образуют пространственную структурную сетку. Гели представляют собой тела, способные сохранять форму. Гели могут образовываться при коагуляции золей (если концентрация частиц достаточна для построения цельного каркаса), при понижении температуры, при концентрировании мицеллярных ПАВ. Образование и распад гелей происходит в ряде технологических, природных биохимических, почвенных и геологических процессах.
Картограммы и картодиаграммы Картограммы и картодиаграммы применяются для изображения географической характеристики изучаемых явлений.

Практические расчеты на срез и смятие При изучении темы обратите внимание на основные расчетные предпосылки и условности расчета.
Функция спроса населения на данный товар Функция спроса населения на данный товар: Qd=7-Р. Функция предложения: Qs= -5+2Р,где.

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса.
Понятие массовых мероприятий, их виды Под массовыми мероприятиями следует понимать совокупность действий или явлений социальной жизни с участием большого количества граждан.
Тактика действий нарядов полиции по предупреждению и пресечению правонарушений при проведении массовых мероприятий К особенностям проведения массовых мероприятий и факторам, влияющим на охрану общественного порядка и обеспечение общественной безопасности, можно отнести значительное количество субъектов, принимающих участие в их подготовке и проведении.
Тактические действия нарядов полиции по предупреждению и пресечению групповых нарушений общественного порядка и массовых беспорядков В целях предупреждения разрастания групповых нарушений общественного порядка (далееГНОП) в массовые беспорядки подразделения (наряды) полиции осуществляют следующие мероприятия.
Объект, субъект, предмет, цели и задачи управления персоналом Социальная система организации делится на две основные подсистемы: управляющую и управляемую.
Законы Генри, Дальтона, Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови Закон Генри: Количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорциональны давлению газа.
Ганглиоблокаторы. Классификация. Механизм действия. Фармакодинамика. Применение.Побочные эфффекты Никотинчувствительные холинорецепторы (н-холинорецепторы) в основном локализованы на постсинаптических мембранах в синапсах скелетной мускулатуры.
Источник: studopedia.info
Строение мицеллы
Основной структурной единицей коллоидного раствора является мицелла. Причем частицы дисперсной фазы обладают сложной структурой, зависящей от условий получения золей и природы стабилизатора. Рассмотрим строение золя йодида серебра, полученного приливанием раствора нитрата серебра к раствору иодида калия (избыток KI — стабилизатор):
Образующиеся в результате реакции мелкие кристаллы AgI находятся в растворе, содержащем ионы К + , NO3 — , I — . Начинается процесс адсорбции ионов на кристаллах AgI.
Согласно правилу Панета–Фаянса на кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл. В данном случае в соответствии с правилом Панета–Фаянса на кристалле AgI будут адсорбироваться ионы I — .
Адсорбция ионов I — происходит за счет химических сил, приводящих к прочному присоединению их к кристаллу. При этом поверхность кристалла заряжается отрицательно. Ионы I — , сообщившие поверхности заряд, называются потенциалообразующими ионами.
Оставшиеся в растворе противоположно заряженные ионы (противоионы) электростатически притягиваются к поверхности. Слой противоионов компенсирует заряд твердой поверхности. Таким образом, на границе фаз образуется двойной электрический слой (ДЭС), который состоит из двух частей.
Первая часть – это противоионы, непосредственно примыкающие к заряженной поверхности кристалла и удерживающиеся за счет электростатических и адсорбционных сил. Эти ионы вместе с потенциалообразующими ионами составляют адсорбционную часть ДЭС (слой Гельмгольца). Противоионы адсорбционного слоя настолько прочно удерживаются поверхностью, что, не отрываясь, передвигаются вместе с твердой частицей и образуют с ней коллоидную частицу.
Вторая часть – остальные противоионы, которые совершают тепловое движение около заряженной поверхности и удерживаются вблизи нее только за счет действия электростатических сил. Эти ионы образуют диффузионную часть ДЭС (слой Гуи).
Таким образом, строение золя иодида серебра можно записать следующим образом:

m[AgI] ∙nI — ∙ (n–x)K + > x — ∙ xK +
агрегат

ядро

коллоидная частица
где m – число молекул AgI, образующих кристаллик;
n – число потенциалообразующими ионов (как правило, т>n);
x – число противоионов диффузного слоя;
(n–x) – число противоионов в адсорбированном слое. Число таких ионов калия меньше числа адсорбированных ионов йода (n), вследствие чего коллоидная частица имеет отрицательный заряд (x–).
Агрегат – частица дисперсной фазы, представляющая собой агрегат молекул ультрамикроскопических размеров.
Ядро мицеллы – часть мицеллы, состоящая из агрегата и потенциалопределяющих ионов.
Коллоидная частица – ядро вместе с частью прочно связанных с ним противоионов. В отличие от мицеллы, коллоидная частица имеет заряд (положительный или отрицательный).
Мицелла – частица дисперсной фазы вместе с окружающим ее диффузным слоем, она электрически нейтральна.
Если получать золь йодистого серебра при некотором избытке AgNO3, то частицы золя йодистого серебра приобретают (в отличие от предыдущего случая) положительный заряд:
Устойчивость коллоидных систем
Коллоидные системы являются термодинамически неустойчивыми, так как обладают избыточной поверхностной энергией, связанной с наличием большой удельной площади поверхности дисперсной фазы. Уменьшение свободной энергии может происходить за счет укрупнения частиц путем их слипания или за счет растворения.
Под устойчивостью дисперсной системы понимают способность дисперсной фазы сохранять состояние равномерного распределения в дисперсионной среде. Н. П. Песков ввел понятия об агрегативной и седиментационной (кинетической) устойчивости.
Седиментационная устойчивость — способность дисперсной системы сохранять неизменным во времени распределение частиц по объему системы, т. е. способность системы противостоять действию силы, тяжести.
Агрегативная устойчивость — способность дисперсной системы сохранять неизменной во времени степень дисперсности, т. е. размеры частиц и их индивидуальность. Агрегативная устойчивость определяет способность дисперсной системы противодействовать слипанию, слиянию частиц. При нарушении агрегативной устойчивости происходит коагуляция.
Коагуляция — процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, т.к. частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция может быть вызвана повышением температуры, добавлением электролитов, механическим воздействием, действием на данный золь другого, противоположно заряженного золя, ультрацентрифугированием, старением золя за счет протекания реакций. Искусственно вызванное выпадение осадков из атмосферы (дождей) является примером коагуляции аэрозолей воды (облака) при действии электролитов, часто AgNO3.
Основное условие уменьшения устойчивости коллоидных растворов – потеря электрического заряда, поэтому в основном методами коагулирования являются методы снятия зарядов. На практике для этой цели чаще всего воздействуют на коллоидные системы растворами электролитов. Коагуляция золей начинается при концентрациях электролитов выше некоторой критической, называемой порогом коагуляции:

,
где Ск – порог коагуляции, ммоль/дм 3 ; V –объем электролита, вызвавший коагуляцию, дм 3 ; с – концентрация электролита-коагулянта, моль/дм 3 ; Vзоля –объем золя, дм 3 .
Правило Шульце-Гарди. Чем выше заряд иона-коагулятора, тем в меньшей концентрации он способен вызвать явную коагуляцию коллоидного раствора. Знак коагулирующего иона противоположен знаку потенциалопределяющего иона. Правило Шульце-Гарди иногда называют правилом знака и валентности:
Согласно правилу Шульце-Гарди порог коагуляции золя электролитом Ск обратно пропорционален заряду коагулирующего иона Z, в шестой степени:
CK I : CK II : CK III = 1: :
:  или CK = α
или CK = α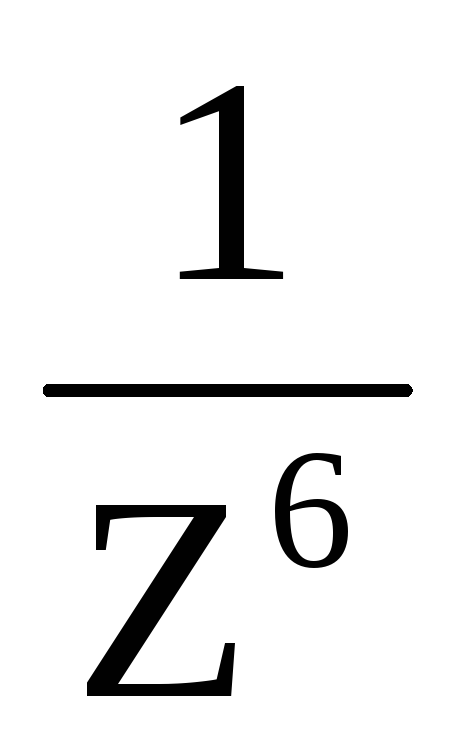
где α — постоянная для данной системы величина;
Z — заряд иона-коагулянта;
CK I , CK II , CK III — порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.
Работа 1. Получение дисперсных систем
Цель работы. Освоение методик получения золей.
Приборы и реактивы.
- Колбы стеклянные емкостью 100 и 250 см 3 .
- Мерные цилиндры емкостью 25, 50 и 100 см 3 .
- Большая пробирка.
- Пипетки емкостью 1, 2, 5, 20 см 3 .
- Электрическая плитка закрытого типа.
- Водный раствор FeCl3 (2 %-ный)..
- Водный раствор KMnO4 (1,5 %-ный).
- Водный раствор Na2S2O3 (1 %-ный).
- Концентрированный раствор NН4ОН.
- Раствор серы в ацетоне насыщенный.
- Раствор парафина в этиловом спирте насыщенный.
- Водный раствор СаСl2 (4 моль/дм 3 ).
- Водный раствор Na2CO3 (2 моль/дм 3 ).
- Дистиллированная вода.
Источник: studfile.net
Строение мицеллы лиофобного золя

Получение многих золей, например в результате реакции осаждения, связано с образованием новой твердой фазы. В подобных случаях при записи уравнения реакции выпадение вещества в осадок мы обозначаем стрелкой вниз:
Образование микрокристалликов осадка (новой фазы) связано с ассоциацией некоторого количества молекул (т) вещества в агрегат. Для образования новой фазы нужно как минимум несколько десятков молекул. Агрегат #zAgI имеет средний размер 10~ 9 — 10 _6 м. Размер частиц новой фазы зависит от условий осаждения (температура, концентрация растворов, наличие избытка одного из веществ, перемешивание).
?? Минимальное число молекул для образования самостоятельной фазы и минимальный размер агрегата обсуждались в подпараграфе 1.1.2.
Избыточная поверхностная энергия образовавшихся частиц G = oS является причиной двух типов явлений. Стремление системы к минимуму энергии может быть реализовано, во-первых, при укрупнении частиц (снижение S) — это явление коагуляции; во-вторых, уменьшение удельной поверхностной энергии а может произойти при изменении состава поверхности — адсорбции на поверхности частицы ионов из раствора.
- ? ?Об избыточной поверхностной энергии см. в подпараграфе 1.2.1.
- ? ? Основные способы снижения поверхностной энергии системы подробно описаны в параграфе 1.3.
Адсорбция ионов при образовании золя устанавливается правилом Фаянса — Папета: на поверхности твердого тела адсорбируются преимущественно те ионы, которые:
- • находятся в растворе в избытке;
- • могут достраивать кристаллическую структуру осадка.
Если при образовании золя Agl в избытке имеются ионы I — , то именно они адсорбируются на поверхности агрегата (рис. 2.9), стабилизируя систему. Количество адсорбированных ионов п зависит от размера частиц, наличия в растворе других ионов и молекул, температуры и других факторов. Поскольку адсорбированные ионы сообщили агрегату электрический заряд (потенциал), то их называют потенциалопределяющими. Погеици- алопределяющими могут быть не только одноименные осадку ионы I — , но и родственные (изоморфные), например Cl — , Br~, CNS — .
Агрегат и потенциалопределяющие ионы составляют ядро коллоидной частицы wAgl • п~ с общим зарядом п~. В случае избытка в растворе ионов Ag + ядро коллоидной частицы mAgl • ;?Ag + несет положительный заряд п+.
Заряд ядра должен быть скомпенсирован ионами противоположного знака (противоионами), присутствующими в растворе. В нашем примере (см. рис. 2.9) это ионы К*. Противоионы распределены неравномерно. Часть противоионов, находящаяся в плотном (адсорбционном) слое, связана с ядром достаточно прочно, образуя коллоидную частицу.
Коллоидная частица на рис. 2.9 выделена пунктиром, а в формульной записи строения мицеллы заключена в фигурные скобки: п~ • (п — x)K + >- v ~ • хК + —

Рис. 2.9. Распределение ионов в мицелле лиофобного золя иодида серебра
при избытке иодид-ионов
Другая часть противоионов (противоионы диффузного слоя) принадлежит дисперсионной среде.
Общее количество противоионов таково, что электрически нейтрализует заряд ядра коллоидной частицы. Распределение противоионов между адсорбционным и диффузным слоями зависит от размера иона в растворе, заряда, концентрации ионов в растворе. От того, как распределены противоионы между плотным и диффузным слоями, зависит величина заряда коллоидной частицы.
Ядро коллоидной частицы вместе с противоионами называют мицеллой. В коллоидной химии принята определенная форма записи строения мицеллы, разобранная в приведенных ниже примерах.
1. При избытке AgN03 после выпадения осадка Agl в дисперсионной среде присутствуют ионы К + , N03, Ag + .
В соответствии с правилом Фаянса — Нанета нотенциалонределяю- щими ионами будут Ag + , тогда противоионы — N03 (рис. 2.10).

Рис. 2.10. Строение мицеллы лиофобного золя иодида серебра при избытке ионов серебра
Коллоидная частица заряжена положительно.
2. При избытке KI после выпадения осадка Agl в дисперсионной среде присутствуют ионы К + , N03, I — . В соответствии с правилом Фаянса — Панета потенциалопределиющими ионами будут I — , в этом случае противоионами могут быть только ионы К + (рис. 2.11).

Рис. 2.11. Строение мицеллы лиофобного золя иодида серебра при избытке иодид-ионов
Коллоидная частица заряжена отрицательно.

3. При образовании гидроксида железа в результате кипячения FeCl3 в воде:
частица стабилизируется за счет адсорбции потенциалопределяющих ионов Fe 3+ , поскольку FeCl3 — сильный электролит, а гидролиз происходит медленно и при нагревании:

4. При щелочном гидролизе (например, в присутствии гидрокарбоната натрия) может образоваться отрицательно заряженная коллоидная частица, поскольку ионы железа в слабощелочной среде существуют в виде гидроксокомплсксов:

Мицелла электронейтральна. Часть, заключенная в формуле в фигурные скобки (собственно коллоидная частица, или гранула), составляет твердую фазу. Противоионы диффузного слоя принадлежат жидкой фазе, свободному объему раствора.
Потенциалопределяющие ионы и противоионы образуют двойной электрический слой. В результате распределения ионов в двойном слое коллоидная частица приобретает заряд.
Наличием заряда у коллоидной частицы обусловлены электрокинети- ческие явления. Во внешнем электрическом поле частица начинает двигаться к одному из электродов (электрофорез).
? ? Электрокииетическим явлениям посвящена гл. 5. Электрофорез подробно описан в параграфе 5.2.
Пример 2.1. В золе строением nAg + (n — x)N03> r+ • xN03 положительные частицы твердой фазы nAg + (n — x)N03>- r+ будут двигаться к отрицательно заряженному электроду, а в золе (mAgl • п (п — х) К’ >- г • хК +
отрицательные частицы nl~(n — х)К + > Л ‘ _ — к положительному электроду.
Визуально это проявляется в помутнении золя у одного из электродов и появлении прозрачной зоны у другого.
Граница, по которой происходит сдвиг твердой фазы относительно дисперсионной среды (граница скольжения), в формульной записи примерно соответствует фигурной скобке, а ее потенциал (электрокинетический, или ^-потенциал) отражается зарядом коллоидной частицы (заряд х+ или х~ над фигурной скобкой). Именно наличие заряда частиц поддерживает агрегативную устойчивость золя, поскольку все частицы имеют одинаковый по знаку заряд, следовательно, взаимно отталкиваются. Взаимное отталкивание частиц препятствует стремлению к слипанию, укрупнению и дальнейшему оседанию под действием силы тяжести.
? ? Агрегативная устойчивость дисперсных систем описывается теорией ДЛФО, см. параграф 4.2.
Коллоидная частица лиофобиого золя состоит из агрегата, потенциал- определяющих ионов и противоионов адсорбционного <плотного) слоя. Коллоидная частица и противоионы диффузного слоя образуют мицеллу.
Источник: studme.org