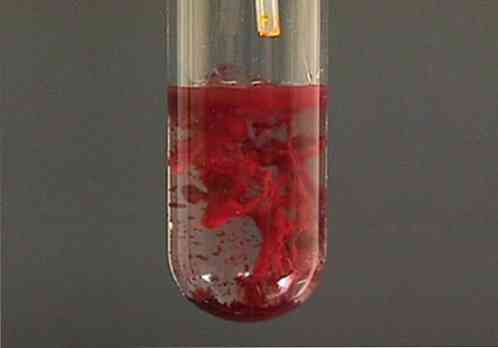
Дихрома́т серебра́ (двухромовокислое серебро, бихромат серебра) — неорганическое соединение, соль металла серебра и хромовой кислоты с формулой Ag2Cr2O7, коричнево-красные кристаллы, не растворимые в воде. В растворе имеет красный цвет.
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Литература
Получение
- Обменная реакция с растворимой солью серебра:
Физические свойства
Дихромат серебра образует коричнево-красные кристаллы.
Плохо растворим в воде.
Химические свойства
- Разлагается в горячей воде:
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1972. — Т. 2. — 871 с.
Источник: xn--h1ajim.xn--p1ai
Снимаем серебро с медицинских контактов. We remove silver from medical contacts.
Формула, синтез и применение дихромата серебра
дихромат серебра, с формулой Ag2Cr2О7, представляет собой тройную неорганическую соль, состоящую из трех химических элементов: серебра, хрома и кислорода.
Имеет константу продукта растворимости 2 х 10 -7 поэтому он нерастворим в воде при стандартных условиях температуры и давления. Его название использует номенклатуру IUPAC, установленную для солей, полученных из оксикислот.
- Симптоматическое название: оксид-оксид (диоксо) хром) оксо-диоксохром из диплата
- Fomula: Ag2Cr2О7
- цвет: Красный
- Молекулярная масса: 431,74 г / моль
- плотность: 4,77 г / см3
- КПС: 2 х 10 -7
синтез
Он может быть синтезирован из дихромата калия в присутствии нитрата серебра по реакции:

Дополнительно его можно использовать для синтеза соответствующего хромата путем нагревания твердого вещества в воде при 100 ° С..

приложений
Хотя предшественники дихромата серебра (K2Cr2О7 и H2Cr2О7) участвуют во многих других химических процессах, дихромат серебра был использован для синтеза координационных соединений с пиридиновыми лигандами типа Py.4Ag2Cr2О7.
Они оказались очень эффективными в качестве катализаторов в окислении аллильных и бензиловых спиртов с высоким процентом конверсии..
Синтез этого типа соединений включает добавление К2Cr2О7, AgNO3 и пиридин в стехиометрическом соотношении 1: 2: 4.
Использование полиэтиленимина, нанесенного на поверхность дихромата серебра, обладает высокой окислительной способностью и может быть использовано для получения производных различных бензиловых спиртов.
Серебро, зеркала, контакты. Смывка серебра.
Он также использовался для изучения кинетики восстановления ионов хрома (VI) в растворах уксусной кислоты..
Среди других применений выделяют препараты Гольджи, используемые для исследования мозговой ткани у крыс с помощью порошковой дифракции рентгеновских лучей..
Недавно была обнаружена его способность действовать в качестве фотокатализатора с использованием видимого излучения..
Однако, чтобы работать таким образом, необходимо наночастицы, поэтому используются новые методы, такие как химическая обработка ультразвуком, где с помощью ультразвука можно изменить кристаллическую структуру Ag.2Cr2О7.
Дихромат серебра использовался в некоторых количественных анализах для определения хлоридов и бромидов в органических соединениях.
На первых этапах этих анализов регулярно используют смеси дихромата калия и серебра эквимолярным способом..
ссылки
- Charchem, 2017. Получено с easychem.org.
- Фирузабади Х., Сардариан А. и Гариби Х. (1984). Тетракис (пиридин) дихромат серебра Py4Ag2Cr207 — мягкий и эффективный реагент для превращения бензильных и аллильных спиртов в их соответствующие карбонильные соединения. Синтетические сообщения, 14 (1), 89-94. Восстановлено с doi.org.
- Тамами Б., Хатам М. и Мохаджер Д. (1991). Поли (винилпиридин) поддерживает дихроматы серебра как универсальные, мягкие и эффективные окислители для различных органических соединений. Полимер, 32 (14), 2666-2670. Восстановлено с doi.org.
- Goudarzian, N., Ghahramani, P. Holm, M.J. (1971). Гольджи, дихромат калия, серебро-нитратная пропитка. Histochemie, 25 (1), 63-71. Восстановлено с doi.org.
- Соофиванд Ф., Мохандес Ф. и Салавати-Ниасари М. (2013). Наноструктуры хромата серебра и дихромата серебра: сонохимический синтез, характеристика и фотокаталитические свойства. Бюллетень исследований материалов, 48 (6), 2084-2094. Восстановлено с doi.org.
- Мазор Л. (2013). Аналитическая химия органических галогеновых соединений: Международная серия аналитической химии. Elsevier. 119-120.
Источник: ru.thpanorama.com
Дихромат серебра
Дихромат серебра — неорганическое соединение, соль металла серебра и хромовой кислоты с формулой Ag2Cr2O7, коричнево-красные кристаллы, не растворимые в воде. В растворе имеет красный цвет.
[Ag+].[Ag+].[O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O
1S/2Ag.2Cr.7O/q2*+1;;;;;;;;2*-1
FCSCTLGIPUOGOC-UHFFFAOYSA-N
Получение
- Обменная реакция с растворимой солью серебра:
Физические свойства
Дихромат серебра образует коричнево-красные кристаллы.
Плохо растворим в воде.
Химические свойства
- Разлагается в горячей воде:
Похожие материалы

Дихроматы 0
Дихромат свинца(II) — неорганическое соединение, соль свинца и дихромовой кислотыс формулой PbCr2O7, красные кристаллы, разлагается

Дихроматы 0
Дихромат ртути(II) — неорганическое соединение, соль ртути и двухромовой кислотыс формулой HgCr2O7, красные кристаллы, не

Дихроматы 0
Дихромат натрия — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия и

Дихроматы 0
Дихромат меди(II) — неорганическое соединение, соль меди и дихромовой кислоты кислоты с формулой CuCr2O7, растворяется

Дихроматы 0
Дихромат магния — магниевая соль двухромовой кислоты, имеет формулу , растворим, однако в воде

Дихроматы 0
Дихромат лития — соль лития и дихромовой кислоты с формулой Li2Cr2O7. Дихромат лития Общие Систематическоенаименование
Подкатегории
- Соединения азота
- Соединения актиния
- Соединения алюминия
- Соединения америция
- Соединения аргона
- Соединения астата
- Соединения бария
- Соединения бериллия
- Соединения берклия
- Соединения бора
- Соединения брома
- Соединения ванадия
- Соединения висмута
- Соединения вольфрама
- Соединения гадолиния
- Соединения галлия
- Соединения гафния
- Соединения германия
- Соединения гольмия
- Соединения диспрозия
- Соединения европия
- Соединения железа
- Соединения золота
- Соединения индия
- Соединения иода
- Соединения иридия
- Соединения иттербия
- Соединения иттрия
- Соединения кадмия
- Соединения калия
- Соединения кальция
- Соединения кислорода
- Соединения кобальта
- Соединения кремния
- Соединения криптона
- Соединения ксенона
- Соединения кюрия
- Соединения лантана
- Соединения лития
- Соединения лютеция
- Соединения марганца
- Соединения меди
- Соединения молибдена
- Соединения мышьяка
- Соединения натрия
- Соединения неодима
- Соединения нептуния
- Соединения никеля
- Соединения ниобия
- Соединения олова
- Соединения осмия
- Соединения палладия
- Соединения платины
- Соединения плутония
- Соединения полония
- Соединения празеодима
- Соединения прометия
- Соединения протактиния
- Соединения радия
- Соединения рения
- Соединения родия
- Соединения ртути
- Соединения рубидия
- Соединения рутения
- Соединения самария
- Соединения свинца
- Соединения селена
- Соединения серебра
- Соединения серы
- Соединения скандия
- Соединения стронция
- Соединения сурьмы
- Соединения таллия
- Соединения тантала
- Соединения теллура
- Соединения тербия
- Соединения технеция
- Соединения титана
- Соединения тория
- Соединения тулия
- Соединения углерода
- Соединения урана
- Соединения фосфора
- Соединения фтора
- Соединения хлора
- Соединения хрома
- Соединения цезия
- Соединения церия
- Соединения цинка
- Соединения циркония
- Соединения эрбия
- Все соединения
- Все предприятия
- Все элементы и определения
- ГОСТы
- Таблица Менделеева
Источник: chemicalportal.ru