Процесс химического образования частиц дисперсной фазы очень сложен, но упрощенно его можно описать следующим образом. Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке (если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится). Реакция протекает по уравнению:
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag + и Cl – образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag + агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
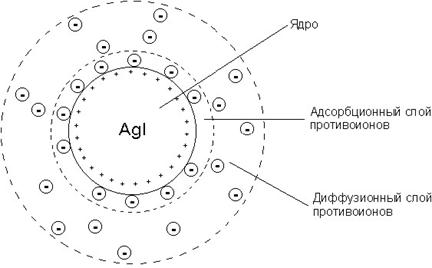
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag + составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO 3– . Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называется мицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой:
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
Строение мицеллы гидрофобного золя на примере золя гидроксида железа. Рассмотрим образование гидрофобного золя гидроксида железа при реакции гидролиза хлорного железа FeCl3. Гидролиз проводят при нагревании:.
Одновременно протекает побочная реакция образований хлорокиси железа:
Хлорокись железа в водном растворе диссоциирует:
FeОCl ® FeО + + Cl —
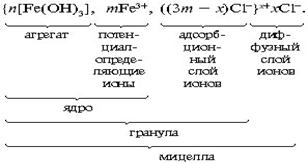
Мельчайшая коллоидная частица, мицелла, состоитиз трех основных частей: ядра мицеллы, адсорбционного и диффузионного слоев. Ядро мицеллы состоит из нескольких тысяч, а иногда даже миллиона молекул, которые образуют определенной формы кристаллическую структуру. На ядре мицеллы адсорбируются ионы или частицы, которые имеют с ядром общий элемент (правило Фаянса).
В нашем случае на ядре мицеллы адсорбируются иона FeO + или ионы Fe 3+ . Эти ионы называются потенциалопределяющими. К ним притягиваются противоионы Cl — , первый слой которых прочно примыкает к ионам FeO + , образуя совместно с ними адсорбционный слой (рис. 10.1).
По мере удаления от ядра слой противоионов становится более размытым из-за теплового движения ионов, он называется диффузионным слоем. Ядро и адсорбционный слой представляют наиболее прочную часть мицеллы и составляют вместе частицу или гранулу.
Противоионы Cl — в адсорбционном слое лишь частично компенсируют заряд потенциалопределяющих ионов, поэтому частица или гранула всегда заряжена и знак ее заряда определяется зарядом потенциалопределяющих ионов. Заряд диффузного слоя равен по величине заряду гранулы и противоположен ему по знаку, поэтому мицелла является электронейтральной частицей. Вокруг ионов диффузного слоя ориентируются дипольные молекулы воды. Однако диффузный слой является непрочным и при тепловом движении мицеллы он может отходить от нее (рис. 10.1).
Cl — FeO + FeO + Cl — адсорбционный слой
Cl — FeO + FeO + Cl —
FeO + m Fe(OH)3 FeO + Cl —
Cl — FeO + ядро FeO + диффузный слой
Cl — FeO + FeO + Cl —
Рис. 10.1. Строение мицеллы золя гидроксида железа.
Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты, может быть выражен такой формулой:
Коагуляция — процесс слипания частиц, образование более крупных агрегатов с потерей седиментационной устойчивости и последующим разделением фаз — разрушением дисперсной системы.
Коагуляция означает свертывание, затвердение или разделение коллоидного раствора на две фазы — растворитель и осадок в случае гидрофобных коллоидов или растворитель и студнеобразную массу в случае гидрофильных коллоидов. В процессе коагуляции происходит укрупнение коллоидных частиц, их слипание и выпадение в осадок. Это означает, что коллоидные системы лишены своих обычных факторов устойчивости. Поскольку у гидрофобных коллоидов главным фактором устойчивости является заряд гранулы, то его снятие происходит тоже зарядом, т.е. действием электролита. Так, например, при действии NaCl на золь гидроксида железа происходит снятие водных оболочек, они расходуются на гидратацию ионов Na + и Cl — . Кроме того, положительно заряженные гранулы притягивают ионы Cl — , происходит деформация слоев, вдавливание диффузного слоя в адсорбционный, снятие заряда гранулы.
При коагуляции имеет значение величина заряда коагулирующего иона: с повышением величины заряда коагулирующего иона скорость коагуляции возрастает. Здесь нет строгой пропорциональности. Это правило известно как правило Шульце-Гарди. Эта закономерность легко объяснима: чем выше заряд иона, тем сильнее он притягивается к заряженному ядру, т.е. тем легче проникает он внутрь адсорбционного слоя.
Слияние частиц дисперсной фазы и их укрупнение называется коагуляцией.
Укрупненные частицы под действием собственной тяжести начинают выпадать в осадок. Этот процесс медленный и носит название седиментации.
В результате коагуляции и седиментации частицы дисперсной фазы выпадают в осадок. В результате образуется истинный раствор, содержащий осадок. Дисперсная система перестаёт существовать.
Поверхностные явления присущи всем системам, имеющим поверхность раздела фаз, но сильнее всего они проявляются в дисперсных системах, которые являются гетерогенными и имеют высокоразвитую поверхность.
Источник: studopedia.su
Cоставьте уравнение диссоциации хлорида серебра AgCl.
⚡ Условие + 37% решения:
Cоставьте уравнение диссоциации хлорида серебра AgCl. Вычислите растворимость AgCl при 25 °С.
Решение: Уравнение диссоциации хлорида серебра AgCl Ag Cl Произведение концентраций ионов Ag и Cl в насыщенном водном растворе хлорида серебра – постоянная величина (произведение растворимости ПР). При 25 °С произведение растворимости хлорида серебра равно
Готовые задачи по химии которые сегодня купили:
- Возможна ли в средах (а) и (б) коррозия сплава, представляющего собой смесь мелкодисперсных кристаллов металлов X и Y?
- Написать выражение константы диссоциации для H2SO3
- В какую сторону сдвинется состояние равновесия, если увеличить концентрацию O2 для уравнения 2SO2 + O2 ↔ 2SO3
- Написать уравнение диссоциации Mg(NO3)2; NiSO4
- Написать уравнение диссоциации KHSO4; Fe(OH)Cl2
- Соотнесите лекарственное вещество и метод его количественного определения с молярной массой эквивалента Токоферода ацетат.
- Дайте заключение о качестве ретинола ацетата по количественному определению с учетом требований НД (должно быть ретинола ацетата в препарате не менее 97,0 %), если оптическая плотность раствора, полученного разведением навески 0,0302 г препарата в мерной колбе вместимостью 100 мл, с последующим разведением 1 мл полученного раствора в мерной колбе вместимостью 100 мл, измеренная при длине волны 326 нм в кювете с толщиной слоя 10 мм составила 0,458.
- Удельная электропроводность бесконечно разбавленных растворов KCl, KNO3 и AgNO3 при 25ºС равна соответственно 149,9; 145,0 и 133,4 См∙м2 ∙моль1 .
- Электролиз раствора K2SO4 проводили с медными электродами при силе тока 2,68 А в течение 1 часа.
- Написать выражение закона действующих масс для реакции Fe(т) + 2HCl → FeCl2 + H2





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com
Диссоциирует ли хлорид серебра

Напишите ТОЧНЫЕ ответы, пожалуйста. Заранее спасибо.
1.Полностью диссоциирует в водном расстворе:
А-Серная кислота Б-Хлорид серебра. В-Гидроксид железа (3)
А- Сульфат-ион Б- Ион калия В-Атом натрия
3.Формула слабого электролита:
А- FeCl3 Б- HNO3 B- NaOH
4- Формула вещества, образующего при электролитической диссоциации сульфат-ион:
А- Na2S Б- BaSO4 B- K2SO4
5- Взаимодействие гидроксида натрия и серной кислоты в водном растворе отображается ионным уравнением:
А- H + OH = H2O Б- 2H +S = H2S В- 2H + So3 = H2SO3
6. Окраска индикатора метилоранжа в растворе, полученном при взаимодействии оксида фосфора (V) с водой:
А. Жёлтая Б. Оранжевая В. Розовая.
7.С раствором соляной кислоты взаимодействует:
А. Оксид серы (VI) Б. Оксид цинка В. Ртуть
8. Разбавленная серная кислота реагирует с металлом:
А. Магнием Б. Медью В. Серебром
9. Формула оксида, вступающего с водой в химическую реакцию:
А. SiO2 Б. HgO В. K2O
10. Веществом X в уравнении реакции
X + H2SO4 = MgSO4 + 2H2O
А. Mg Б. MgO В. Mg(OH)2
Формула оксида: 1. N2O5 2. FeO 3. Fe2O3 4. N2O3
Формула гидроксида A.HNO2 Б.HNO3 В.Fe(OH)2 Г.Fe(OH)3
Источник: vashurok.com