Реакция «серебряного зеркала» характерна для каждого из двух веществ:
1) муравьиной кислоты и уксусной кислоты
2) муравьиной кислоты и формальдегида
3) пропионового альдегида и пропионовой кислоты
4) уксусного альдегида и уксусной кислоты
Ответ эксперта
Реакция «серебряного зеркала» характерна для альдегидов и муравьиной кислоты. Муравьиная кислота содержит и кислотную и альдегидную группы.
Источник: xn--b1aai8acvc.xn--p1acf
Тема 8-2. Ди – и полисахариды
Дисахариды (биозы)состоят из двух моносахаридных звеньев, соединенных, как правило, гликозидной связью. Так, например, лактоза (молочный сахар) состоит из остатков ,D–галактопиранозы и(или),D–глюкопиранозы, соединенных между собой-1,4 гликозидной связью: 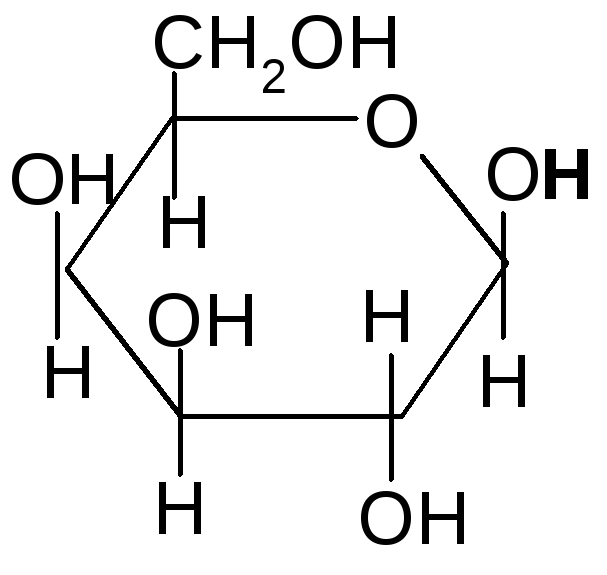
 +H2O/H +
+H2O/H + 
 + — Н2О
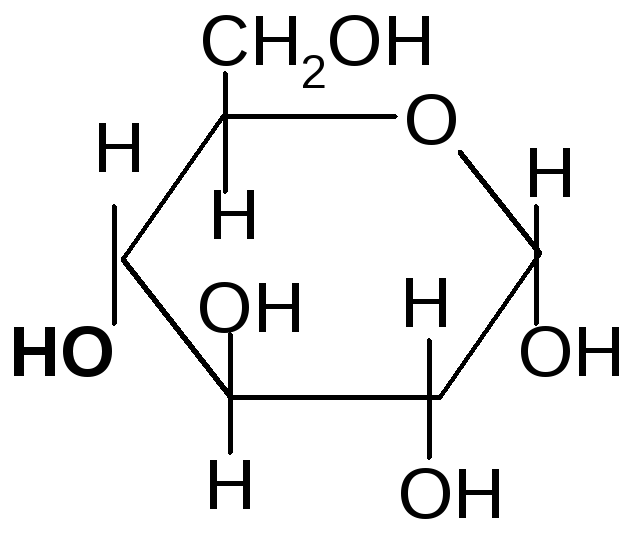
+ — Н2О  ,D–галактопираноза,D– глюкопираноза
,D–галактопираноза,D– глюкопираноза 
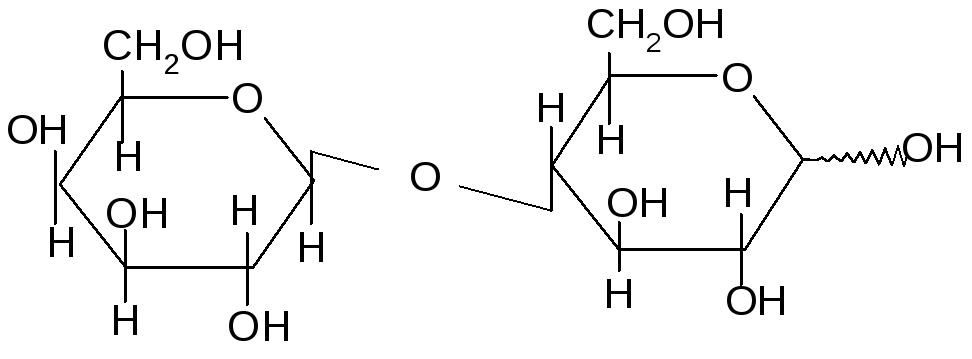
 ,D–галактопиранозил–1,4-,D–глюкопираноза Дисахариды, содержащие свободный полуацетальный гидроксил, подобно моносахаридам, способны к равновесным превращениям - и- аномеров через открытую форму. Для них характерно явление мутаротации в свежеприготовленных растворах.
,D–галактопиранозил–1,4-,D–глюкопираноза Дисахариды, содержащие свободный полуацетальный гидроксил, подобно моносахаридам, способны к равновесным превращениям - и- аномеров через открытую форму. Для них характерно явление мутаротации в свежеприготовленных растворах.
Химия ЕГЭ 2019. Характерные химические свойства и способы получения карбонилов. Теория
Цикло-цепная таутомерия дисахаридов
Рассмотрим явление цикло-цепной таутомерии на примере целлобиозы. Этот дисахарид образуется при неполном гидролизе целлюлозы. Состоит из двух ,D–глюкопиранозных остатков, соединенных между собой-1,4-гликозидной связью. Во втором остатке содержит свободную полуацетальную (гликозидную) группу; в водном растворе переходит в открытую таутомерную форму: 

 -целлобиоза
-целлобиоза 


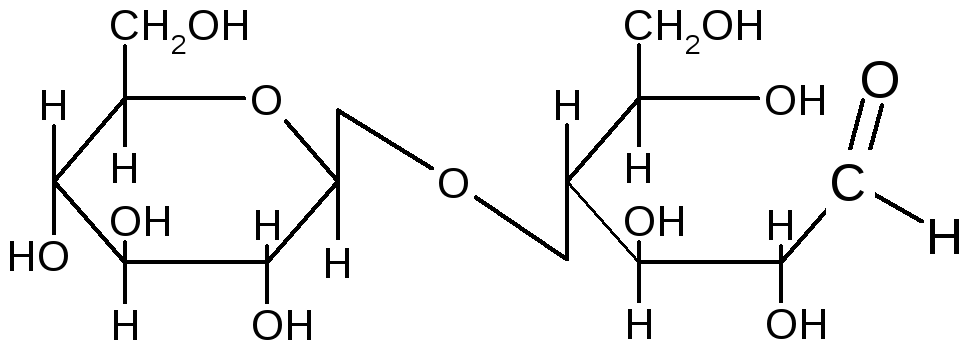
 Открытая форма целлобиозы (,D–глюкопиранозил–1,4–D–глюкоза)
Открытая форма целлобиозы (,D–глюкопиранозил–1,4–D–глюкоза) 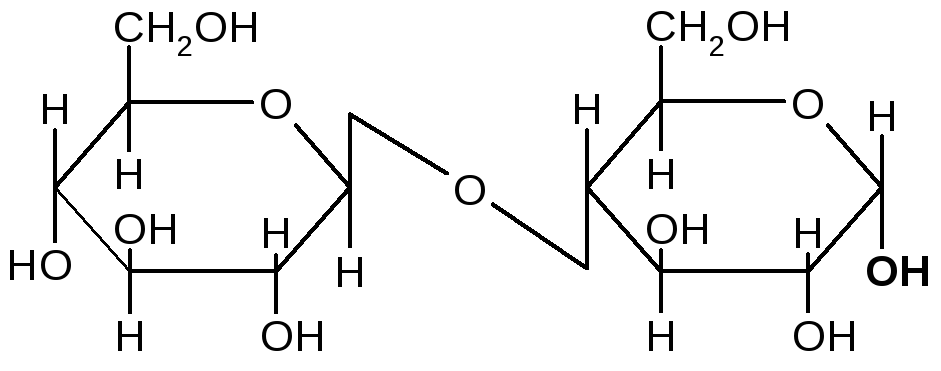

 -целлобиоза
-целлобиоза
№ 80. Органическая химия. Тема 16. Альдегиды. Часть 5. Реакции окисления
Химические свойства дисахаридов
По химическим свойствамдисахариды классифицируются навосстанавливающие (мальтоза, лактоза, целлобиоза) иневосстанавливающие (сахароза). Молекулы восстанавливающих дисахаридовпри участиисвободного полуацетального гидроксила способны к образованию открытой формы, альдегидная группа которой восстанавливает ионы металлов:Ag + ,Cu 2+ . Для доказательства восстанавливающей способности сахаров можно использовать реакции «серебряного зеркала», Троммера или реакцию с реактивом Феллинга (см. лабораторную работу).
Реакция «серебряного зеркала»:
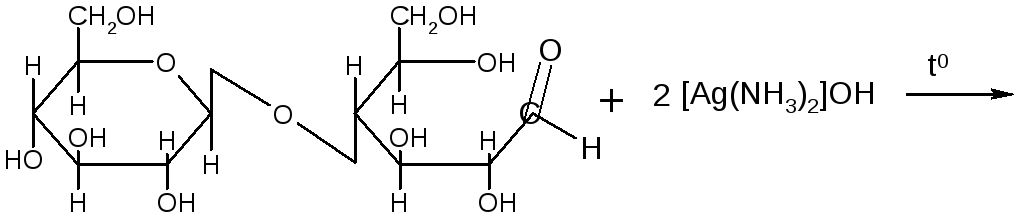 Открытая форма целлобиозы
Открытая форма целлобиозы 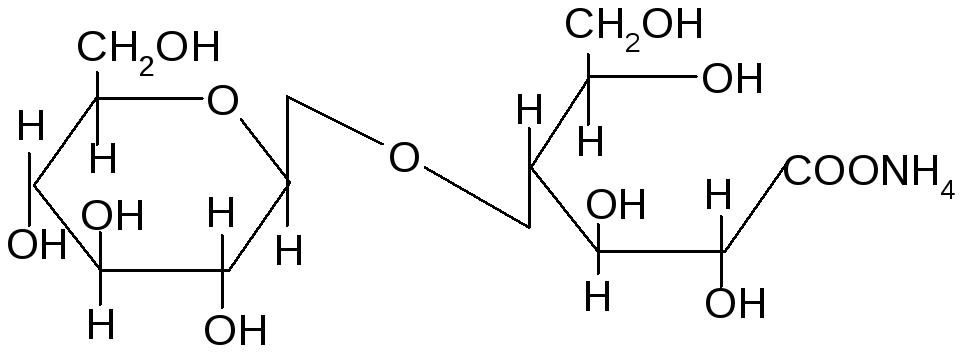
 2Ag+ 3NH3+H2O+ Целлобионовой кислоты соль аммония (,D–глюкопиранозил–1,4–D–глюконат аммония) Для невосстанавливающих дисахаридовтакие реакции неосуществимы, так как в их структуре отсутствует свободный полуацетальный гидроксил; они не способны переходить в открытую таутомерную форму; не мутаротируют в свежеприготовленных водных растворах. Н
2Ag+ 3NH3+H2O+ Целлобионовой кислоты соль аммония (,D–глюкопиранозил–1,4–D–глюконат аммония) Для невосстанавливающих дисахаридовтакие реакции неосуществимы, так как в их структуре отсутствует свободный полуацетальный гидроксил; они не способны переходить в открытую таутомерную форму; не мутаротируют в свежеприготовленных водных растворах. Н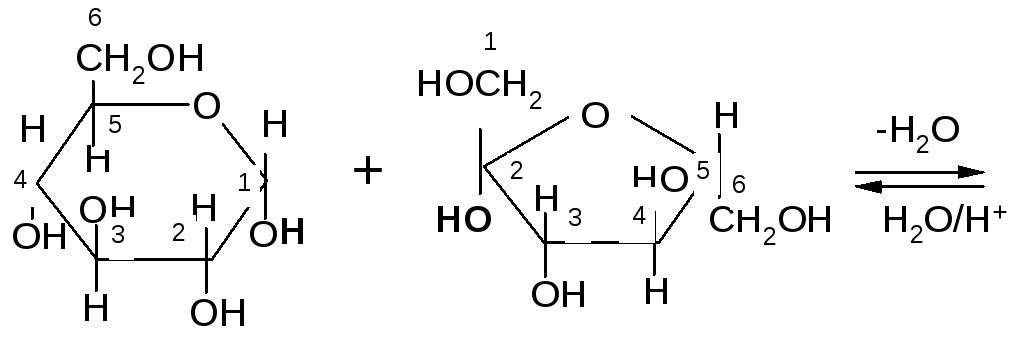 апример, сахароза – содержится в сахарном тростнике (до 20 %), сахарной свекле (16–21 %), различных фруктах, ягодах, овощах.
апример, сахароза – содержится в сахарном тростнике (до 20 %), сахарной свекле (16–21 %), различных фруктах, ягодах, овощах.
Молекула сахарозы образована из остатков,D–глюкопиранозы и,D–фруктофуранозы, соединенных между собой 1,2–гликозидо-гликозидной связью: ,D– глюкопираноза,D–фруктофураноза 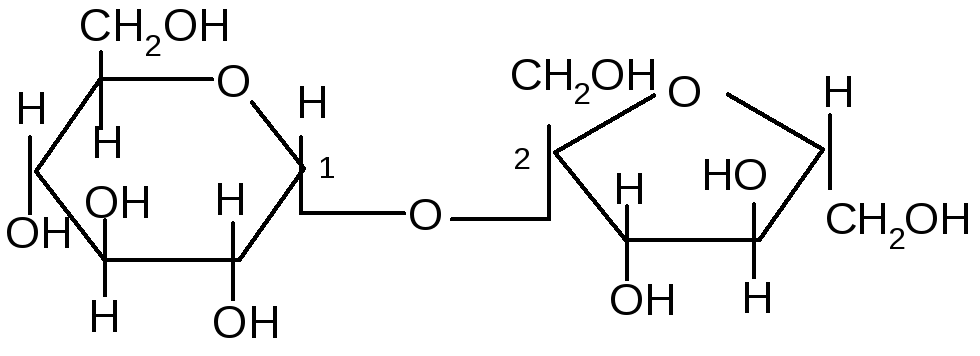

 ,D–глюкопиранозил-1,2-,D-фруктофуранозид В молекуле сахарозы оба гликозидных гидроксила моносахаридных звеньев участвуют в образовании 1,2–гликозидо-гликозидной связи. Таким образом, сахароза не способна к цикло-цепной таутомерии; растворы сахарозы не мутаротируют.
,D–глюкопиранозил-1,2-,D-фруктофуранозид В молекуле сахарозы оба гликозидных гидроксила моносахаридных звеньев участвуют в образовании 1,2–гликозидо-гликозидной связи. Таким образом, сахароза не способна к цикло-цепной таутомерии; растворы сахарозы не мутаротируют.
Сахароза – невосстанавливающий дисахарид. Как гликозид сахароза способна к кислотному гидролизус образованиемD–глюкозы иD–фруктозы (см. лабораторную работу).
В результате кислотного гидролиза удельное вращение раствора сахарозы (+66,6°) меняет свой знак на противоположный (отрицательный) из-за относительно большей величины удельного вращения фруктозы: D 20 = + 52,5° дляD-глюкозы; – 92,0° дляD–фруктозы. Смесь продуктов гидролиза сахарозы называется инвертным сахаром (от лат. inversia– переворачивание); содержится в искусственном меде. Натуральный пчелиный мед также содержит свободнуюD-глюкозу иD-фруктозу (до 37%), но состав меда несравненно более разнообразный. Мед содержит еще и мальтозу, сахарозу, белки (в том числе и ферменты), органические кислоты (яблочную, лимонную, глюконовую), витамины и микроэлементы, алкалоиды и красящие вещества.
Источник: studfile.net
41. Органическая химия Читать 0 мин.
41.349. Альдегиды, карбоновые кислоты, сложные эфиры
Альдегиды и кетоны.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
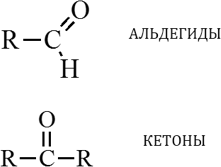
Гомологический ряд альдегидов и кетонов:
Название
Формула
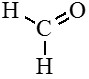
Метаналь (муравьиный альдегид, формальдегид)
Этаналь (уксусный альдегид, ацетальдегид)
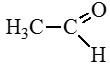
Пропаналь (пропионовый альдегид)
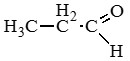
Бутаналь (масляный альдегид)
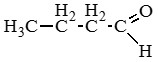
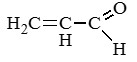
Бутен-2-аль (кротоновый альдегид)
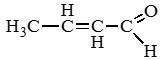
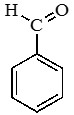
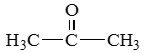
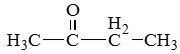
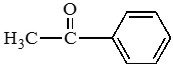
Номенклатура и изомерия:
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
Названием альдегида = название алкана + окончание –аль
Алгоритм названия альдегидов:
1. Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
2. Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
3. Назовите соединение по алгоритму для углеводородов.
4. В конце названия допишите суффикс -аль.
Изомерия:
1. Углеродного скелета
2. Межклассовая – кетоны
3. ТОЛЬКО У КЕТОНОВ: положение функциональной группы
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8-12 атома «С» — душистые вещества. Альдегиды с 1-3 атомами «С» хорошо растворяются в воду, с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаза и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства альдегидов и кетонов:
Альдегиды – один из наиболее реакционноспособных классов органических соединений, что связанно с наличием в их молекулах высокополяризованной карбонильной группы.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
2CH 3 CHO + 5O 2 = 4CO 2 + 4H 2 O
- Присоединение (по двойной связи карбонильной группы).
$HCHO longrightarrow RCHO longrightarrow RCOR’$ склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):
$HCHO + H_2 stackrel <longrightarrow>CH_3OH$
$CH_3 — CO-CH_3 +H_2 stackrel <longrightarrow>CH_3-CH(OH)-CH_3$
Из альдегидов при этом получаются первичные спирты, а из кетонов — вторичные.
$CH_3CHO + Ag_2O = 2Agdownarrow + CH_3COOH$ (реакция «серебряного зеркала» — качественная реакция)
$HCHO + 2Cu(OH)_2 = 2H_2O + Cu_2Odownarrow + HCOOH$ (образуется красный осадок — качественная реакция)
Кетоны слабыми окислителями не окисляются.
- Замещение атомов водорода в углеводородном радикале (замещение происходит в альфа-положение, т. е. замещается атом водорода у 2-го атома углерода):
CH 3 CHO + Cl 2 = CH 2 Cl-CHO + HCl
Применение важнейших представителей:
3. Для хранения анатомических препаратов
1. Получение этанола
2. Производство зеркал
4. Ацетатное волокно
5. Получение уксусной кислоты
6. Получение уксусного ангидрида
7. Получение сложного эфира – этилацетат.
Карбоновые кислоты.
Карбоновые кислоты– это производные УВ, содержащие функциональную карбоксильную группы –СООН.
По основности кислоты делятся на:
1. одноосновные (монокарбоновые)
2. двухосновные (дикарбоновые)
3. трехосновные (трикарбоновые)
Наибольшее значение имеют насыщенные монокарбоновые кислоты.
Номенклатура и изомерия:
Источник: reshutest.ru