Самостоятельная работа по физике Электрический ток в жидкостях 11 класс с ответами. Представлено 5 вариантов самостоятельных работ. В каждом варианте по 2 задания.
1 вариант
1. Какова масса меди, выделившейся за 1 ч на катоде, если сила тока через раствор медного купороса равна 5000 А? Электрохимический эквивалент меди 3,28 х 10 -7 кг/Кл.
2. Через воду пропускают электрический ток. В течение 1 ч получено 0,5 л кислорода под давлением 1,33 ⋅ 10 5 Па. Определите температуру выделившегося кислорода, если сила тока 2,6 А. Электрохимический эквивалент кислорода 8,29 ⋅ 10 -8 кг/Кл.
2 вариант
1. При какой силе тока через раствор сульфата цинка ZnSO4 на катоде за 5 ч выделится 30,6 г цинка? Электрохимический эквивалент цинка равен 3,4 ⋅ 10 -7 кг/Кл.
2. Для серебрения ложек ток пропускался через раствор соли серебра в течение 5 ч. Катодом служат 12 ложек, каждая из которых имеет площадь поверхности 50 см 2 . Какой толщины слой серебра от ложится на ложках при силе тока 1,8 А? Электрохимический эквивалент серебра равен 1,12 ⋅ 10 -6 кг/Кл, плотность серебра 10 500 кг/м 3 .
серебрение мормышек секушек гель серебра
3 вариант
1. При пропускании электрического тока через раствор медного купороса на катоде выделилось 768 мг меди за 20 мин при силе тока 2 А. Определите электрохимический эквивалент меди.
2. За какое время при электролизе воды выделится 1 г кислорода, если сила тока через электролит 2 А? Атомная масса кислорода 16 г/моль, валентность 2. Постоянная Фарадея 9,65 ⋅ 10 4 Кл/моль.
4 вариант
1. Сколько времени длилось никелирование, если на изделие осел слой никеля массой 1,8 г при силе тока 2 А? Электрохимический эквивалент никеля равен 3 ⋅ 10 -7 кг/Кл.
2. Сколько двухвалентного никеля выделится при электролизе за 5 ч при силе тока 10 А? Атомная масса никеля 58,71 г/моль. Постоянная Фарадея 9,65 ⋅ 10 4 Кл/моль.
5 вариант
1. При серебрении изделий пользовались током 5 А в течение 15 мин. Какое количество серебра израсходовано за это время? Электрохимический эквивалент серебра равен 1,12 • 10 -6 кг/Кл.
2. Через раствор серной кислоты пропустили ток силой 1 А в течение 10 ч. Определите объем выделившегося водорода при давлении 10 5 Па и температуре 0 °С. Электрохимический эквивалент водорода равен 10,36 ⋅ 10 -9 кг/Кл.
Ответы на самостоятельную работу по физике Электрический ток в жидкостях 11 класс
1 вариант
1. 5,9 кг
2. 330 К
2 вариант
1. 5 А
2. 0,058 мм
3 вариант
1. 3,2 ⋅ 10 -7 кг/Кл
2. ≈ 1 ч 40 мин
4 вариант
1. 50 мин
2. ≈ 58 г
5 вариант
1. 0,005 кг
2. ≈ 0,004 м 3
Источник: testschool.ru
4. Для серебрения 12 ложек (площадь поверхности каждой 50 см2) через раствор соли серебра пропускается ток Толщина покрытия должна составить 50 мкм В течение какого времени должно проходить серебрение, если сила тока 1,3 А? Молярная масса серебра 0,108 кг


Очень красивый набор из 12-ти чайных ложек, серебро 800 пр., «Kraus & Bilz», Германия, 1908 год.
Решение: По объединенному закону Фарадея:




Источник:

Решебник по физике за 11 класс (Касьянов В.А., 2002 год),
задача №16
к главе «Постоянный электрический ток. § 16. Электрический ток в растворах и расплавах электролитов».
Источник: 5terka.com
Для серебрения 12 ложек площадь поверхности каждой 50 см2 через раствор соли серебра

![]()



Задача №1188
Условие
1188. Для серебрения ложек ток 1,8 А пропускался через раствор соли серебра в течение 5 ч. Катодом служит 12 ложек, каждая из которых имеет площадь поверхности 50 см2 Какой толщины слой серебра отложится на ложках?
Решение
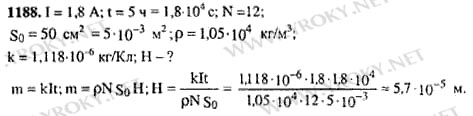

Предыдущая задача №1187
1187. Определите, какая масса алюминия отложится на катоде за 10 ч при электролизе AI2(S04)3, если сила тока равна 1 А.
Следующая задача №1189
1189. Определите число Фарадея, если известно, что при прохождении через электролитическую ванну заряда 7348 Кл масса выделившегося на катоде золота 5 г. Хими ческий эквивалент золота 66 г/моль.
Источник: helplearn.ru