Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Серебро с тумблеров П2Т-1
Для серебрения ложек через раствор соли серебра в течение времени 5 ч

![]()



Задача №1188
Условие
1188. Для серебрения ложек ток 1,8 А пропускался через раствор соли серебра в течение 5 ч. Катодом служит 12 ложек, каждая из которых имеет площадь поверхности 50 см2 Какой толщины слой серебра отложится на ложках?
Решение
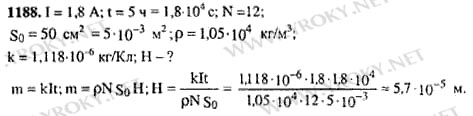

Предыдущая задача №1187
1187. Определите, какая масса алюминия отложится на катоде за 10 ч при электролизе AI2(S04)3, если сила тока равна 1 А.
Следующая задача №1189
1189. Определите число Фарадея, если известно, что при прохождении через электролитическую ванну заряда 7348 Кл масса выделившегося на катоде золота 5 г. Хими ческий эквивалент золота 66 г/моль.
Источник: helplearn.ru
Электролиз. Законы Фарадея
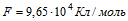
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
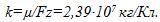
Решение:
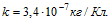
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I =2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
СЕРЕБРО из 5 РАЗЪЕМОВ БЕЗ КИСЛОТ!
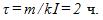
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
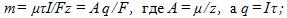
отсюда
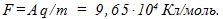
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N 0 =N А /z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
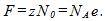
Следовательно, элементарный заряд
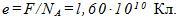
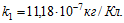
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z 2 = 3.
Решение:
По второму закону Фарадея имеем
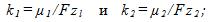
отсюда электрохимический эквивалент золота
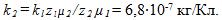
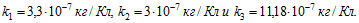
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuS O4 , NiSО4 и AgNО 3 . Плотность тока при электролизе j =40 А/м 2 , площадь катода в каждой ванне S = 500 см 2 . Электрохимические эквиваленты меди, никеля и серебра
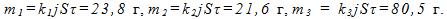
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l =0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля 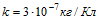 , его плотность
, его плотность 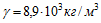
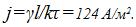
Решение:
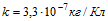
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0 =1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m = 0,316 г? Электрохимический эквивалент меди .
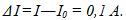
Решение:
По первому закону Фарадея m = kIτ , где I-ток в цепи; отсюда I = m /kτ =1,6 А, т.е. в показание амперметра надо внести поправку
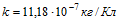
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R = 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
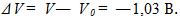
Решение:
По первому закону Фарадея m = klτ , где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ = 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
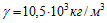
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I =1,8 А. Катодом служат n =12 ложек, каждая из которых имеет площадь поверхности S =50 см 2 . Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
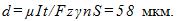
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl 2 ), во второй — раствор хлорного железа (FeCl 3 ). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда 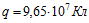 . Молярные массы железа и хлора
. Молярные массы железа и хлора 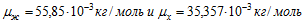 .
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
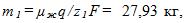
во второй ванне
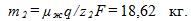
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
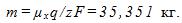
Источник: websor.ru