
Предлагаем вам сборку заданий 31 из реальных КИМов ЕГЭ 2018 по химии. Ответы вы найдёте внизу страницы.
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 30
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ:
- Для выполнения задания используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, кремнезём, нитрит калия. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: йодид калия, серная кислота, гидроксид алюминия, оксид марганца (IV), нитрат магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, оксид фосфора (V), оксид марганца (IV), фторид аммония, нитрат кальция. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: дихромат натрия, серная кислота, йодид натрия, силикат натрия, нитрат магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, углекислый газ, перманганат калия, фторид аммония, нитрат железа. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди (II). Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора (V), нитрат меди (II). Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, фтороводород, карбонат аммония, сульфат железа (II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома (III), оксид магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, сульфит калия, дихромат калия, серная кислота, гидроксид хрома (III), кремнезём. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, бром, нитрат бария, сульфат аммония, соляная кислота концентрированная, перманганат калия. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, сера, азотная кислота концентрированная, углекислый газ, фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома (III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ.
Ответы:
Вариант 1
Оксид фосфора(V). Фосфорные кислоты
Вариант 2
2K + + S 2- + 2H + + SO4 2- = H2S + 2K + + SO4 2-
Вариант 3
Вариант4
Вариант5
Вариант6
Вариант7
Вариант 8
H2S + Cu 2+ = CuS + 2H +
Вариант 9
Вариант 10
Вариант 11
6Na + + 6OH — + 2Al 3+ + 3SO4 2- = 2Al(OH)3 + 6Na + + 3SO4 2-
Вариант 12
Вариант 13
Вариант 14
Zn 2+ + 2NO3 — +2K + + 2OH — = Zn(OH)2 + 2K + + 2NO3 —
Вариант 15
2Ag + + 2F — + 2CH3COO — + Ca 2+ = 2CH3COO — + 2Ag + + CaF2
Вариант 16
Вариант 17
Mg 2+ + 2NO3 — + 2K + + 2F — = 2K + + 2NO3 — + MgF2
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Источник: www.yoursystemeducation.com
Задание с ответами: химия. ЕГЭ — 2018
Для выполнения задания используйте следующий перечень веществ: оксид фосфора (III), нитрат серебра, азотная кислота, бромид натрия, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Сведения для решения
Запишем уравнение реакции:

Составим электронный баланс:

Фосфор в степени окисления +3 является восстановителем, а азот в степени окисления +5 — окислителем.
Источник: vuz-24.ru
Презентация на тему Подготовка К ЕГЭ по химии задание №30 окислительно — восстановительные реакции
2 балла2 баллаЗадания №30 — 31 (ЕГЭ 2019 г.) (с единым контекстом)Экзаменуемому следует записать только по одному варианту ответа на задания 30 и 31!
- Главная
- Химия
- Подготовка К ЕГЭ по химии задание №30 окислительно — восстановительные реакции
Слайды и текст этой презентации
Слайд 1Подготовка К ЕГЭ по химии задание №30 окислительно – восстановительные реакции
Панфилова Анна
Евгеньевна
учитель химии МОУ «СОШ ст. Курдюм
им. Героя Советского Союза П.Т.

Слайд 22 балла
2 балла
Задания №30 — 31 (ЕГЭ 2019 г.) (с единым
контекстом)
Экзаменуемому следует записать
только по одному варианту ответа на задания

Слайд 3Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария,
гидроксид калия. Допустимо использование водных растворов веществ.
Задание №30 (ЕГЭ 2019

Слайд 4Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария,
гидроксид калия. Допустимо использование водных растворов веществ.
Задание №31 (ЕГЭ 2019

Слайд 5Задание №30 (ЕГЭ 2019 г.)
Проверяемые умения:
Определять степень окисления химических элементов,
окислитель и восстановитель;
Прогнозировать продукты окислительно-восстановительных реакций, в том числе с
учетом характера среды (кислой, щелочной, нейтральной);
Составлять уравнения окислительно-восстановительных реакций:
Составлять электронный баланс, на его основе расставлять коэффициенты в уравнениях реакций

Слайд 6

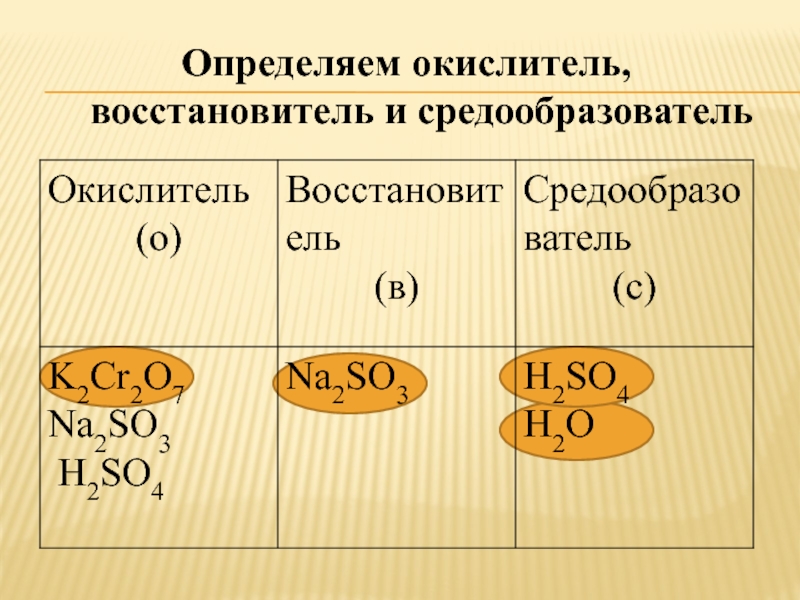
Слайд 7Записываем формулы веществ
K2Cr2O7 , K2CO3 , Na2SO3 , H2SO4 ,
SiO2
Определяем степени окисления атомов
K+12Cr+62O-27 , K+12C+4O-23
Na+12S+4O-23 , H+12S+6O-24 ,
Si+4O-22

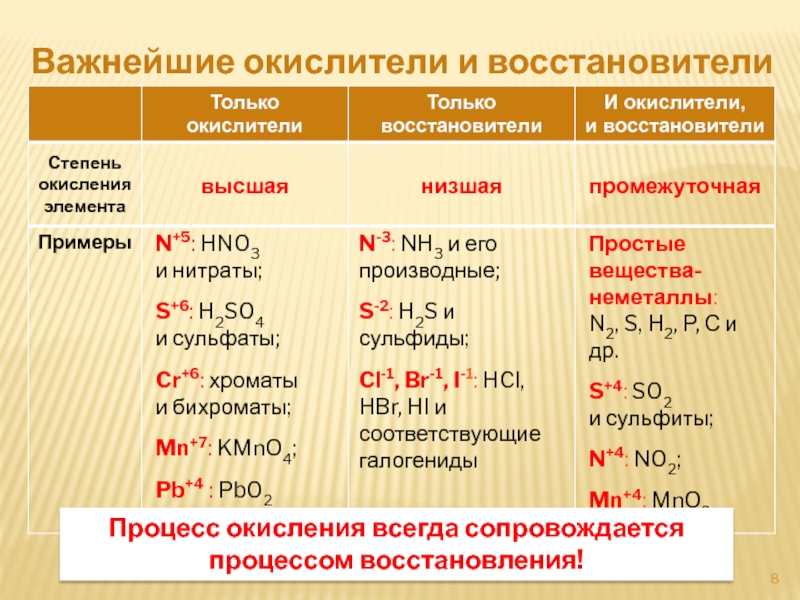
Слайд 8Важнейшие окислители и восстановители
Процесс окисления всегда сопровождается процессом восстановления!
Слайд 9Определяем окислитель, восстановитель и средообразователь
Слайд 10Окислительно-восстановительные свойства соединений хрома
зеленый
жёлтый

Слайд 11
Среда кислая
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3
+ K2SO4 + 4H2O

Слайд 12Среда нейтральная (слабощелочная за счет гидролиза сульфита)
4H2O = 3Na2SO4 + 2Cr(OН)3 + 2KOН

Слайд 13Алгоритм выполнения задания №30
1. Правильно записать формулы веществ из предложенного
перечня
2. Определить степени окисления элементов, входящих в состав веществ
3. Выбрать
вещество – окислитель, вещество – восстановитель, вещество – средообразователь
4. Спрогнозировать продукты ОВР с учетом характера среды
5. Составить уравнение ОВР
6. Составить электронный баланс, на его основе расставить коэффициенты в уравнении реакции
7. Указать окислитель и восстановитель

Слайд 14Подготовка к егэ №30

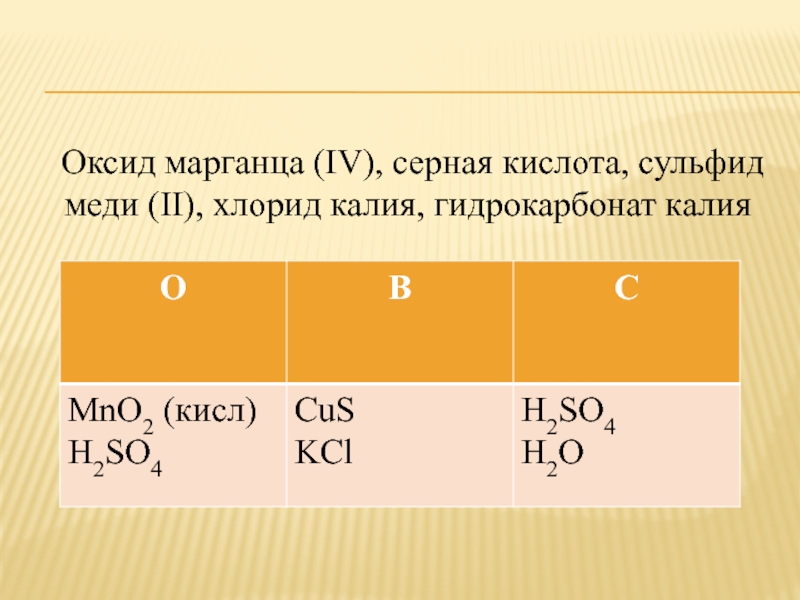
Слайд 15 Оксид марганца (IV), серная кислота, сульфид меди (II),
хлорид калия, гидрокарбонат калия
Слайд 16CuS + 4H2SO4 = CuSO4 + 4SO2 +4H2O
+ 2H2SO4 = MnSO4 + Cl2 + K2SO4 + 2H2O
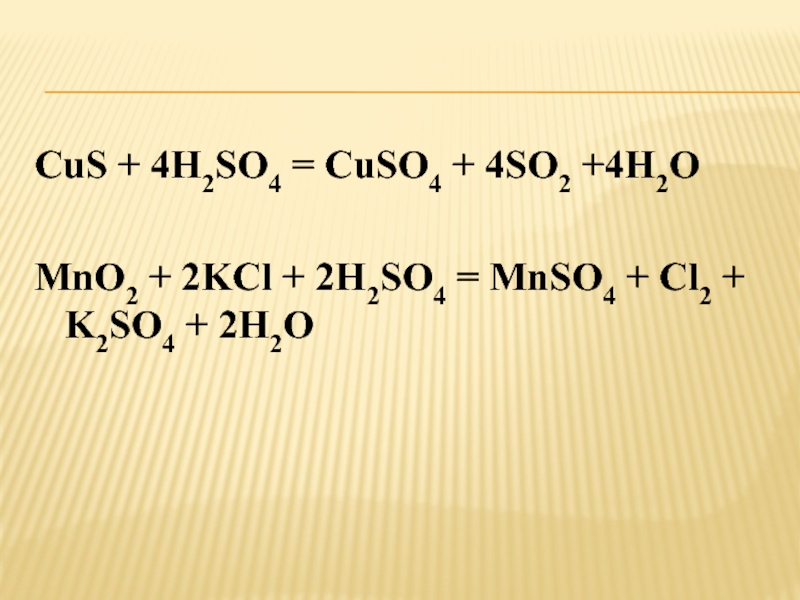
Слайд 17 Хлор, фтор, фтороводород, хлорат калия, гидроксид натрия.
= 2KCl + 3O2 НЕЛЬЗЯ!
Cl2 + H2O = HCl +
Cl2 + 2NaOH = NaCl + NaClO + H2O
KClO3 + F2 +2 NaOH = KClO4 + 2NaF + H2O

Слайд 18Задания для тренировки
1. KIO3 + … + H2SO4
→ I2 + K2SO4 + H2O 2. KNO2 + K2Cr2O7 +
… → KNO3 + Cr(NO3)3 + H2O 3. P + HClO3 + … → HCl + … 4. SO2 + K2Cr2O7 + … → K2SO4 + … + H2O 5. Al + K2Cr2O7 + … → … + Cr2(SO4)3 + K2SO4 + H2O 6. NH3 + KClO → N2 + KCl + … . 7. Cl2 + NH3· H2O → NH4Cl + N2 + … . 8. KMnO4 + NH3 → MnO2 + N2 + … + … 9. Zn + KNO3 + … → NH3 + K2ZnO2 + … . 10. SO2 + KMnO4 + … → MnSO4 + … + H2SO4 11. K2Cr2O7 + HCl (разб) + FeCl2 → FeCl3 + … + KCl + … . 12. KNO3 + K2CO3 + Cr2O3 → KNO2 + … + CO2 13. FeSO4 + H2SO4 + MnO2 → Fe2(SO4)3 + … + … . 14. NaBr + NaBrO3 + H2SO4 → … + Na2SO4 + H2O

Слайд 19 15. NaI + H2SO4 (конц) → … +
H2S + Na2SO4 + … 16. Na2O2 + FeSO4 + …
→ Fe2(SO4)3 + Na2SO4 + … 17. Be + NaOH + H2O → … + H2 18. H2O2 + Na3[Cr(OH)6] → … + H2O + NaOH 19. Na2Cr2O7 + H2S + H2SO4 → … + … + H2O + Na2SO4 20. H2S + K2Cr2O7 + H2SO4 → … + … + … + … 21. FeSO4 + H2O2 + H2SO4 → … + … 22. MnSO4 + NaClO + NaOH → MnO2 + … + … + … 23.
C + H2SO4(конц) → … + … + … 24. KMnO4 + Na2S + H2SO4 → … + … + Na2SO4 + K2SO4 + H2O 25. KMnO4 + K2S + H2O → … + … + KOH 26. NaMnO4 + Na2SO3 + … → Na2MnO4 + … + H2O 27. K2Cr O4 + (NH4)2S + KOH + H2O → … + S + NH3

Слайд 20Новый вариант №30 (фипи)
1. Иодид калия,
серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния.
2. сероводород, концентрированная азотная кислота, сульфат алюминия, оксид фосфора(V), нитрат меди(II).
3. пероксид водорода, гидроксид калия, оксид хрома(III), фосфат серебра, сульфат аммония.
4. дихромат калия, серная кислота, карбонат аммония, оксид кремния, нитрит калия.
5. хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния.
6. бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия.
7. нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния.

Слайд 21 8. сульфат аммония, гидроксид калия, перманганат калия, нитрит
калия, оксид меди(II).
9. концентрированная соляная кислота, оксид фосфора(V),
оксид марганца(IV), фторид аммония, нитрат кальция.
10. концентрированная соляная кислота, оксид углерода(IV), перманганат калия, фосфат калия, нитрат железа(III).
11. нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди(II).
12. хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома(III), оксид магния.
13. фтороводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота.
14. хромат натрия, серная кислота, гидрокарбонат магния, оксид фосфора(V), нитрит натрия.

Слайд 2215. гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота.
16. сульфит калия, дихромат калия, серная кислота, гидроксид хрома(III), оксид
кремния.
17. перманганат калия, иодид калия, фторид аммония, ацетат натрия, сульфат магния.
18. гипохлорит натрия, гидроксид натрия, фторид цинка, оксид хрома(III), оксид кремния.
19. сера, концентрированная азотная кислота, оксид углерода(IV), фторид серебра, ацетат кальция.
20. перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия.
Источник: theslide.ru