Гальванические элементы – это устройства для получения электрического тока за счет химических реакций, протекающих на электродах. При этом на электродах возникают разные по величине равновесные потенциалы, разность которых определяет электродвижущую силу (ЭДС) данного элемента.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух металлических пластин, погруженных в раствор электролита. В такой системе окисление протекает на одном металле, а восстановление на другом. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление – катодом.
В качестве примера рассмотрим медно-цинковый гальванический элемент, который называют элемент Даниэля-Якоби. Этот элемент состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка. Для предупреждения смешивания (диффузии) растворов между ними помещают солевой мостик (концентрированный раствор нейтральной соли, например КСl)
Электроды и гальванические элементы
Чтобы выяснить какой из электродов будет анодом, а какой катодом, надо сравнить значения их стандартных электродных потенциалов (Е 0 ). Электрод, у которого Е 0 меньше, будет анодом. В гальваническом элементе Даниэля-ЯкобиЕ 0 Zn2+/Zn < Е 0 Cu2+/Cu, поэтому цинковый электрод будет анодом.
Поэтому на цинковом электроде происходит окисление, а на медном электроде происходит восстановление:
Zn — 2е – → Zn 2+ (3.3)
Сu 2+ + 2е – → Cu (3.4)
Гальванический элемент принято записывать в виде электрохимической схемы (на примере элемента Даниэля-Якоби):
Сплошная вертикальная линия | обозначает границу металл – раствор, а двойная вертикальная || обозначает границу раздела между разными растворами электролитов, т.е. в данном случае солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Потенциал электрода рассчитывают по формуле Нернста:
где — электродный потенциал металла (М) в растворе, содержащем катионы (М n + );
— стандартный или нормальный потенциал рассматриваемой системы;
R – универсальная газовая постоянная, Дж/(моль×К);
Т — термодинамическая температура, К;
n – число электронов, участвующих в электродном процессе;
F — число Фарадея, Кл/моль;
а — активность ионов металла в растворе. Для разбавленных растворов коэффициент активности близок к единице и вместо активности можно пользоваться концентрацией ионов в растворе.
Если в уравнение (3.5) подставить значения постоянных R, F, принять температуру для стандартных условий (Т 0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:
Из уравнения (3.6) следует, что стандартный электродный потенциал (E 0 ) – это потенциал электрода при стандартных условиях: , Т=298 К.
Стандартные потенциалы различных металлов, измеренные по отношению к потенциалу стандартного водородного электрода, образуют ряд напряжения металлов (приложение 2).
Лекция 6 Водородный электрод в качестве электрода сравнения
При расчете ЭДС гальванического элемента от большего электродного потенциала вычитают меньший. Например, ЭДС элемента Даниэля-Якоби:
Рассмотрим пример решения задачи по расчету ЭДС гальванического
элемента (в контрольной работе № 1 это задача № 2)
Задача №2 (а) Вычислите ЭДС цинково-оловянного гальванического элемента, если образующие его электроды опущены в растворы солей с одинаковой активностью катиона.
Решение. Для решения задачи воспользуемся уравнением (3.7). Из этого уравнения ЭДС рассматриваемого гальванического элемента:
Поскольку электроды, образующие гальванический элемент опущены в растворы солей с одинаковой активностью катиона, то . Поэтому . Значения стандартных электродных потенциалов цинка и олова можем взять из ряда напряжения металлов (приложение 2). Тогда ЭДС цинково-оловянного гальванического элемента:
Задача №2 (б)Вычислите ЭДС серебряно-кадмиевого гальванического элемента, в котором активности ионов Ag + и Cd + соответственно равны 0,1 и 0,005 моль/дм 3 .
Решение. Для нахождения ЭДС серебряно-кадмиевого гальванического элемента необходимо вычислить потенциалы отдельных электродов. Их можно найти с помощью уравнения Нернста (3.6).
В соответствии с уравнением Нернста потенциал серебряного электрода:
Значение известно (приложение 2), n = 1, т.к. в электродном процессе участвует только один электрон. Тогда:
Для кадмиевого электрода можно записать уравнение:
Значение также известно (приложение 2) , а n = 2, т.к. в электродном процессе участвует два электрона. Тогда потенциал кадмиевого электрода:
При расчете ЭДС гальванического элемента от большего электродного потенциала вычитают меньший:
Вопросы к контрольной работе №2
1. Дисперсность и классификация коллоидных систем.
2. Поверхностное натяжение и смачивание. Адгезия.
3. Адсорбция. Изотерма адсорбции. Природа адсорбционных сил. Теория
4. Адсорбция на границе раствор- газ. Уравнение Гиббса. Правило Дюкло-
5. Адсорбция на границе твердое тело – раствор. Молекулярная, ионная и
6. Седиментационный анализ суспензий. Теоретические основы седимента-
7. Электрокинетические свойства коллоидных систем.
8. Двойной электрический слой и строение мицеллы.
9. Электрофоретический метод определения электрокинетического
10.Теоретические основы адсорбции на границе жидкость-газ.
Перечень вопросов к контрольной работе № 2 для каждого варианта
| Номер варианта (последняя цифра шифра) | 0; 1 | 2; 9 | 3; 8 | 4; 7 | 5; 6 |
| Номера вопросов |
Источник: allrefrs.ru
Электрохимические методы анализа
Потенциометрический метод анализа относится к электрохимическим. Это метод определения концентрации ионов в растворе, основанный на измерении потенциала электрода, погруженного в исследуемый раствор. Потенциал отдельного электрода измерить невозможно. Необходимо составить соответствующую гальваническую ячейку.
Она состоит из двух электродов, помещённых в анализируемый раствор. Потенциал одного из этих электродов – индикаторного – зависит от концентрации определяемого иона. Потенциал другого – электрода сравнения постоянен и не зависит от состава анализируемого раствора.
В аналитической практике используют две разновидности потенциометрического анализа. Первоая– прямая потенциометрия – измерение потенциала индикаторного электрода и нахождение концентрации определяемого иона по его величине. Вторая – потенциометрическое титрование — измерение потенциала индикаторного электрода в процессе титрования анализируемого раствора.
ЭЛЕКТРОДЫ СРАВНЕНИЯ И ИНДИКАТОРНЫЕ ЭЛЕКТРОДЫ
Слайд 1
Электроды сравнения
Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого сохраняется постоянным. Нормальный водородный электрод для практического использования не удобен. Поэтому в качестве электрода сравнения используют специально изготовляемые электроды, потенциалы которых остаются постоянными как при работе с ними, так и при их хранении.
Наибольшее применение имеет хлорсеребряный электрод, изготовленный из серебряной проволоки, покрытой тонким слоем хлорида серебра, помещённый в раствор хлорида калия. Также используют каломельный электрод сравнения, содержащий металлическую ртуть, каломель (Hg2CI2) и хлорид калия. Это электроды второго рода. Потенциал электродов второго рода зависит от концентрации анионов.
Слайд 2
Электрохимическая реакция – реакция на электроде
AgCl + e → Ag 0 + Cl —
Потенциал хлорсеребряного электрода равен
Слайд 3
Если такой электрод опустить в насыщенный раствор хлорида калия, то концентрация хлорид ионов будет постоянная и потенциал хлорсеребряного электрода будет постоянным, т.е. удовлетворять требованию электродов сравнения.
Индикаторные электроды.
Индикаторный электрод — электрод, потенциал которого зависит от концентрации определяемых ионов в растворе.
Требования к индикаторным электродам.
1). Должны быть обратимы по отношению к одному из ионов, участвующих в химической реакции.
2). Не должен взаимодействовать с ионами, находящимися в растворе, т.е. должен быть индифферентным.
3). Должен концентрационно правильно и мгновенно реагировать на изменение концентрации потенциалопределяющего иона.
В качестве индикаторных электродов в потенциометрическом методе анализе используется металлические и мембранные ионоселективные электроды (ИСЭ).
Металлические электроды. Это электроды первого рода. Они представляют металлический электрод, опущенный в раствор собственной соли. Например, серебряный электрод, это серебряная проволока, опущенная в раствор собственной соли (AgNO3), содержащей ионы серебра.
Слайд4
Реакция в растворе Ag + + Cl — → AgCl
Электрохимическая реакция на электроде
E = E 0 + 0,059 lg C (Ag + )
Таким образом, потенциал серебряного электрода зависит от природы металла (E o Ag+/Ag) и концентрации ионов серебра Ag+ в растворе, т.е. является индикаторным электродом для ионов серебра.
Серебряный электрод можно применять для определения ионов серебра.
Для определения ионов ртути (I) нужен ртутный электрод.
В общем виде потенциал электрода первого рода равен
Таким образом, потенциал металлического электрода зависит от концентрации потенциалопределяемых ионов в растворе.
Слайд5
Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем.
Их потенциал выражается уравнением Нернста
В этом случае металлы являются лишь переносчиками электронов от восстановленной формы к окисленной. Их потенциалы зависят от соотношения концентраций окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно – восстановительном титровании.
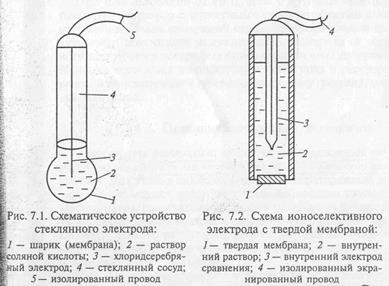
Ионоселективные мембранные электроды. Ионоселективным называется электрод на основе мембраны, потенциал которой линейно зависит от десятичного логарифма концентрации определяемого иона в растворе.
Основной частью такого электрода является полупроницаемая мембрана – тонкая плёнка растворов электролитов, твёрдый или стекловидный электролит.
При соприкосновении поверхности с раствором происходит обмен ионами между мембраной и раствором. Таким образом, если возникновение потенциала на металлических электродах связано с переносом электронов через границу раздела электрод – раствор, то в случае мембранных электродов – с обменом ионами между материалом мембраны и раствором.
Слайд 6
Потенциал ионоселективного электрода
где k – постоянная, зависящая от конструкции электрода:
знак ± зависит от заряда иона (плюс – для катионов, минус – для анионов); z – заряд иона; С(А) – концентрация иона.
В зависимости от материала мембранные электроды подразделяются на стеклянные, с твёрдой, с жидкой мембранами.
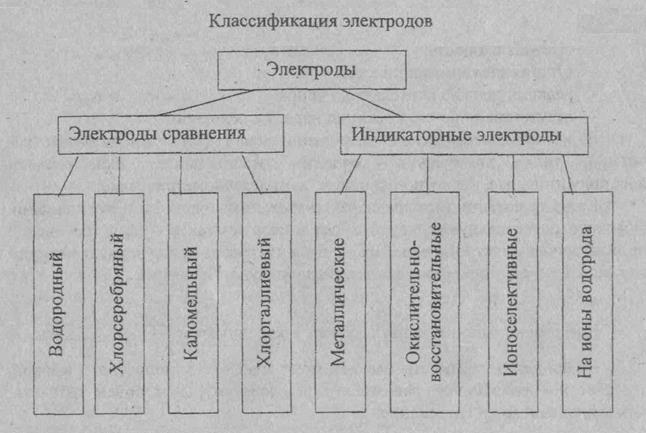
Стеклянный электрод – это один из давно известных мембранных электродов, широко используемых для определения pH, т.е. концентрации ионов водорода.
Слайд 7 (стеклянный электрод)
Этот электрод представляет небольшой стеклянный сосуд, к нижней части которого припаян шарик из стекла специального состава. В сосуд заливают 0,1 М раствор соляной кислоты. В этот внутренний раствор погружён хлорсеребряный электрод – серебряная проволока, покрытая хлоридом серебра. К серебряной проволоке припаян изолированный экранированный провод.
Стеклянный электрод обычно используют при измерениях pH с хлорсеребряным электродом сравнения.
Стеклянный шарик изготовлен из специального стекла, содержащий оксиды: натрия, кальция, лития, кремния.
При опускании стеклянного электрода в раствор, содержаний ионы водорода, идёт обменная реакция.
Слайд 8.
E = k – 0,059pH
где k = const зависит от сорта стекла и устройства электрода
Концентрация во внешней и внутренней частях мембраны разная. Поэтому на границе раздела стекло – исследуемый раствор возникает потенциал, который зависит от концентрации ионов водорода в исследуемом растворе, т.е. от pH.
Преимущества стеклянного электрода
1). На измерение pH не влияют посторонние ионы.
2). Потенциал устанавливается быстро.
3). Не отравляется.
4). Пригоден для измерения в широком диапазоне pH: от 1 до 14.
1). Хрупкость стеклянного шарика.
ЭЛЕКТРОДЫ С ТВЁРДЫМИ МЕМБРАНАМИ
В них используют тонкие пластины (мембраны) из веществ, мало растворимых и проводящих ток за счёт ионов. Например, фтор селективный электрод с мембраной из кристаллического три фторида лантана. Этим электродом можно измерять вторичную концентрацию фторид-ионов от 1 до 10 -6 моль/л.
ЭЛЕКТРОДЫ С ЖИДКИМИ МЕМБРАНАМИ
В них используют мембрану в виде пористой полимерной плёнки, пропитанной раствором электропроводного вещества в органическом растворителе. Один из ионов электродного вещества обменивается с ионом, находящимся в водном растворе. Такие электроды используются для определения нитрат ионов, хлорид-ионов, бромит-ионов, иодит-ионов, катионов калия, натрия, кальция и др.
Источник: infopedia.su
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ
Электрохимические цепи – системы из электродов, находящихся в одном и том же электролите, либо в контактирующих друг с другом различных электролитах. Иногда электрохимические цепи называют гальваническими цепями.
Электрохимические цепи принято изображать схемой:
– анод | электролит || электролит | катод +
| анода | катода | . |
В схеме граница раздела между металлом и раствором обозначается вертикальной чертой, а граница между растворами электролитов – двойной вертикальной или пунктирной чертой.
Электродвижущая сила электрохимической цепи равна разности электродных потенциалов катода и анода:
ЭДС, как и электродный потенциал, измеряется в вольтах.
Электрохимические цепи составляют основу химических источников тока.
Цепи князя Багратиона
Князь Багратион – племянник знаменитого полководца – начинал свою службу в инженерных войсках. В 1840 г., будучи в чине лейтенанта, он изобрёл гальванический элемент, впоследствии получивший название «цепь князя Багратиона постоянного действия». Этот элемент представлял собой горшок с землёй, пропитанной концентрированным раствором хлорида аммония NH4C1 (нашатыря), в которую на некотором расстоянии втыкали медную и цинковую пластины. Такой элемент давал ток на протяжении нескольких месяцев.
Комбинации различных электродов дают различные электрохимические цепи.
Химические цепи получают, комбинируя электроды I и (или) II рода. Источником энергии в таких цепях является энергия протекающей химической реакции.
К гальваническим элементам такого типа относится элемент Вольта(вольтов столб) – первый химический источник постоянного тока, в котором цинковый и медный электроды помещены в раствор серной кислоты. Электрохимическая схема этого элемента:
– Zn | H2SO4 | Cu +.
На аноде происходит окисление цинка, на катоде – восстановление ионов водорода:
Примерами химических цепей являются также элемент Даниеля – Якоби, который состоит из цинкового и медного электродов I рода (рис. 3), и элемент Лекланше (см. раздел «Сухой элемент»).
| Якоби Борис Семёнович (Герман Мориц) (1801 – 1874 гг.) – российский физик, электротехник и физикохимик, академик Петербургской академии наук. Родился в Потсдаме. Учился в Берлинском и Гёттингенском университетах. Работал в Дерптском университете, руководил научно-техническими работами в различных ведомствах Петербурга. Основные работы посвящены электромагнетизму и электрохимии. Основоположник электрохимических исследований в России. Открыл гальванопластику. Изучил явления, происходящие в медно-цинковом элементе, и дал им правильное объяснение. Вывел формулу, связывающую силу тока с параметрами, характеризующими электрическую цепь. Высказал идеи о величине максимальной работы, которую можно получить от химического источника тока. | |
| Даниель Джон Фредерик (1790–1845) – английский профессор химии. Разработал химический источник постоянного тока – «элемент Даниеля». Во время экспериментов с батареей из 70 ячеек получил электрическую дугу большой интенсивности, которая вызвала серьёзные повреждения глаз Даниеля и наблюдателей. |  |

Рис. 3. Элемент Даниеля-Якоби:
1 – солевой мостик; 2 – гальванометр
Электрохимическая схема элемента Даниеля – Якоби:
– Zn | ZnSO4 || CuSO4 | Cu + ,
ЭДС определяют по уравнению
Во время работы этого гальванического элемента окисление цинка приводит к появлению дополнительных ионов Zn 2+ в анодном отделении. Восстановление ионов Сu 2+ вызывает появление избыточного отрицательного заряда в растворе в катодном отделении. Принцип электронейтральности соблюдается благодаря миграции ионов через «солевой мостик».
Солевой мостик представляет собой U-образную трубку, содержащую раствор какого-либо электролита, например NH4NO3 или KNO3, ионы которого не реагируют с другими ионами в гальваническом элементе, а также с материалами, из которых сделаны электроды. Концы U-образной трубки закрывают стекловатой, чтобы электролит не выливался из неё. При протекании на электродах процессов окисления и восстановления ионы из солевого мостика проникают в анодное и катодное отделения гальванического элемента, чтобы нейтрализовать образующиеся там заряды. Отрицательно заряжённые ионы (анионы) мигрируют по направлению к аноду, а положительно заряжённые – к катоду.
Электродвижущая сила химической цепи зависит в основном от разности стандартных электродных потенциалов, поэтому при разработке электрохимических систем такого типа используют электроды с сильно различающимися значениями стандартных электродных потенциалов.
Концентрационные цепи состоят из двух одинаковых по природе электродов, отличающихся концентрацией растворов электролитов. Источником электрической энергии в таких цепях является энергия переноса электролита из раствора с большей концентрацией в раствор с меньшей концентрацией.
Например, рассмотрим процессы, происходящие в концентрационной цепи, состоящей из серебряных электродов I рода, то есть серебряных пластин, погружённых в растворы азотнокислого серебра различной концентрации. При условии, что С1 < С2 левый электрод – анод, а правый электрод – катод:
– Ag | AgNO3 || AgNO3 | Ag + .
| С1 | С2 |
На аноде происходит окисление
Электроны освобождаются и поступают во внешнюю цепь. Ионы серебра переходят в раствор, и их концентрация в анодном отделении увеличивается.
На катоде происходит восстановление
При этом ионы серебра забирают с катода электроны и превращаются в нейтральные атомы, которые осаждаются на катоде.
Электродвижущая сила такой цепи определяется по формуле
Концентрационные цепи работают до тех пор, пока сохраняется различие в концентрациях растворов электролитов в катодном и анодном отделениях. На практике такие цепи используют только для теоретических исследований.
Окислительно-восстановительные цепи состоят из двух различных окислительно-восстановительных электродов.
– Pt | Sn 4+ , Sn 2+ || Fe 3+ , Fe 2+ | Pt + ,
А: Sn 2+ – 2ē ® Sn 4+ ;
Источник: mykonspekts.ru