Анодная медь является сложным многокомпонентным сплавом. Обычно она содержит, %: 99,5-99,8 меди, до 0,015 серы, столько же железа, до 0,5 никеля, до 0,05 свинца, до 0,01 висмута, до 0,2 мышьяка, до 0,06 селена+теллура, до 0,03(300г/т) золота и до 0,5(5000 г/т) серебра. Электролитическое рафинирование меди преследует две цели:
1) Получение меди высокой чистоты (99,90-99,99% меди)
2) Извлечение попутно с рафинированием благородных металлов и других ценных компонентов (селен, теллур, никель, висмут и др.)
Электролитическое рафинирование меди основано на различии ее электрохимических свойств и содержащихся в ней примесей. Медь – это электроположительный металл, ее нормальный потенциал +0,34В.
Для осуществления электролитического рафинирования меди аноды, отлитые после огневого рафинирования, помещают в электролизные ванны, заполненные сернокислым электролитом
Между анодами в ваннах располагаются тонкие медные листы – катодные основы. При включении ванн в сеть постоянного тока происходит электрохимическое растворение меди на аноде, перенос катионов через электролит и осаждение ее на катоде.
Снятие посеребрения электролизом в растворе нитрата аммония#chemistry #серебро
Примеси меди при этом в основном распределяются между шламом(твердым осадком на дне ванн) и электролитом. В результате электролитического рафинирования получают:
– Шлам, содержащий благородные металлы, селен, теллур
– Загрязненный электролит, часть которого используют для получения медного и никелевого купороса.
Кроме того, вследствие неполного электрохимического растворения анодов, получают анодные остатки (анодный скрап).
Анодный процесс : Cu – 2e = Cu 2+
Катодный процесс: Cu 2+ + 2e = Cu
Электроположительный потенциал меди позволяет выделить медь на катоде из кислых растворов без опасения выделения водорода. Введение в электролит наряду с медным купоросом свободной серной кислоты существенно повышает электропроводность раствора.
Промышленные электролиты обычно содержат 30-50 г/л Cu 2+ и 120-170 г/л свободной серной кислоты. Для улучшения качества катодной поверхности, в электролиты вводят разнообразные поверхностноактивные (коллоидные) добавки – клей (чаще столярный), желатин, сульфидный щелок, тиомочевину и так далее. Добавки непрерывно вводят в циркулирующий электролит, обычно применяя одновременно две добавки. На одну тонну катодной меди расходуют 15-40 г клея, 15-20 г желатина, 20-60 г сульфидных щелоков или 60-100 г тиомочевины.
Температура электролита составляет 55-65С. Основными требованиями, предъявляемыми к электролиту, является его высокая электропроводность и чистота, однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок обязательно содержат растворенные примеси, содержавшиеся до этого в анодной меди.
Примеси, более электроотрицательные чем медь (никель, железо, цинк и др.) практически полностью переходят в электролит. Исключение составляет только никель, около 5% которого осаждается в шлам. Более электроположительные по сравнению с медью примеси (благородные металлы) переходят в шлам. Золото на 99,5% от его содержания в анодах, а серебро – на 98.
Серебро. Восстановление медью. Будет ли 999? Добыл красный кислород?
Основными характеристиками, определяющими параметры и показатели электролиза меди являются:
– Выход металла по току
– Напряжение на ванне
– Удельный расход электроэнергии.
Плотность тока выражается в амперах на единицу поверхности электрода (D=I/S). Единицы измерения – А/м 2 катода.
По закону Фарадея, на каждый А*ч электричества осаждается 1 электрохимический эквивалент металла. Для меди он равен 1,1857 г/А*ч. Следовательно, с увеличением плотности тока производительность процесса электролиза растет. Чаще всего заводы работают при плотности тока 240-300 А/м 2 , но можно довести плотность тока до 500 А/м 2 .
Степень использования тока на основной электрохимический процесс называется выходом металла по току. Выход по току может быть выражен в долях единиц или в процентах. На величину потерь тока влияют: утечки тока, возникающие в результате заземления в цепи, утечки тока через циркуляционные трубопроводы электролита, короткие замыкания между электродами, побочные химические и электрические процессы, нагревание электролита и контактов.
С этой целью введено понятие коэффициента использования тока или, как принято в заводской практике, “выход по току”, который рассчитывается как отношение фактически полученного количества меди к теоретически возможному при данных условиях электролиза (сила тока, продолжительность электролиза)
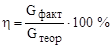
Напряжение на ванне составляет от 0,35 до 0,46 В.
Удельный расход электроэнергии – 280-370кВт*час/тонну меди
В настоящее время для электролиза меди в основном используются цельнолитые железобетонные ванны ящичного типа. Внутри электролизные ванны облицовывают винипластом. Ванны установлены на столбах с изоляторами из стекла, фарфора или текстолита на высоте 4-5м от 0 отметки. Под ваннами расположены насосы, трубопроводы и сборники электролита.
Для спуска шлама и раствора в днищах имеется отверстие с пробкой. Если стоков не делают, ванны разгружают с помощью насосов.
Электролизные ванны объединяют в блоки по 5-20 штук, а блоки – в серии. В электрическую схему питания постоянным током ванны в блоках и блоки в сериях включены последовательно, а электроды в отдельных ваннах – параллельно. Эта система включения ванн и электродов получила название мультипль. Аноды отливают с ушками, которыми они опираются на токоподводящие шины и борта ванн.
Средняя толщина анода 35-45 мм, масса – до 350кг. Для обеспечения равномерного растворения анодов по высоте электролита, их отливают клиновидной формы с утолщением кверху. Катодные основы изготавливают из медных листов, размер катодной основы превышает размер анода по длине на 25-50 мм, по ширине на 50-60 мм. Катодные основы подвешивают в ваннах на медных трубчатых штангах.
Расстояние от боковых кромок катодов до стенок ванн около 300 мм, до днища ванны 400-600 мм, число анодов, завешиваемых в одну ванну, на разных заводах колеблется от 29 до 48 штук. Число катодов в ванне всегда на 1 больше числа анодов, что обеспечивает равномерное растворение всех анодов, включая крайние. Расстояние между осями одноименных электродов – около 110мм, соответственно, между анодом и катодом – примерно 35-40 мм.
Электролит обычно подают в нижнюю зону ванны, а отводят сверху. В зависимости от применяемой плотности тока и массы анодов, каждую партию катодов наращивают в течение 6-10 суток. За это время катоды достигают толщины 8-10 мм. Срок срабатывания анодов соответствует 2-3 заменам катодов и достигает 30 суток. Загрузку в ванны анодов осуществляют мостовым краном.
Извлеченные из ванн катоды направляют на промывку от электролита, загрязняющего их серой. Промывку ведут последовательно оборотными растворами и чистой горячей водой. Отмытые катоды переплавляют с получением слитков для волочения проволоки (вайербарсы) или медной катанки. Отработанные аноды(анодные остатки) переплавляют в анодных печах.
Выгрузку анодного шлама и полный слив электролита осуществляют периодически после полного срабатывания нескольких партий анодов(в зависимости от выхода шлама). Для выпуска шлама две соседние ванны выключают(шунтируют) наложением специальных медных шунт. После этого, из ванны извлекают электроды, сливают электролит и на дне остается слой сгущенного шлама.
Его сливают и смывают в специальные емкости. После разгрузки ванны ее зачищают от обвалившихся кусочков меди, уплотнившегося шлама, и промывают. Шлам пропускают через рокот для отделения крупной фракции меди, после чего фильтруют и направляют на специальную переработку.
Технико-экономические показатели процесса:
1) Содержание меди в анодах, % 99-99,8
2) Масса анодов, кг 175-350
3) Время растворения анодов, сутки 18-27
4) Выход анодных остатков, % 17-20
5) Время наращивания катодов, сутки 6-9
6) Масса катода, кг 70-140
7) Выход шлама, % 0,8 – 8,5
8) Состав электролита, г/л Cu 2+ 50, H2SO4 125-230, коллоидные добавки 30-300
9) Температура электролита, С 55-65
10) Скорость циркуляции, л/мин 6-15
11) Катодная плотность тока А/м 2 180-300
12) Напряжение на ванне, В 0,25-0,4
13) Расход электроэнергии кВт*ч/т кат меди 230-350
Источник: www.mykmgn.ru
Электрохимические процессы при электролизе меди и поведение примесей
Лекция 22. Электрохимические процессы при электролизе меди и поведение примесей Вопрос. 1. Электродные процессы. В основе электролитического рафинирования меди лежит процесс, при котором происходит растворение загрязненной (анодной) меди и осаждение чистой меди на катоде, а имеющиеся в анодной меди примеси распределяются между раствором и шламом. Данная электрохимическая система может быть представлена следующим образом: + Сuс примесями | СиSO4, Н2SO4, Н2O, ПАВ, Сu + | Сu -. где ПАВ — поверхностно-активное вещество. Рассмотрим сначала систему, в которую входят катод и анод из чистой меди и электролит, представляющий собой водный раствор сульфата меди и серной кислоты, гипотетически исключив вероятность образования ионов Сu + + Сu | СuSO4, Н2SO4, Н2O | Сu -. Компоненты раствора дают при электролитической диссоциации следующие ионы: СuSO4 ↔Сu 2+ + SO4 2- ; (5.27)
Рекомендуемые материалы
Маран Программная инженерия
Программная инженерия
Техническое задание
Инженерная графика
Управление человеческими ресурсами
Управление персоналом
399 249 руб.
Отчет по практике + презентация. Стек технологий LAMP
Производственная практика: технологическая практика
Поделитесь ссылкой:
Рекомендуемые лекции
- Как подготовиться к ядерному взрыву или радиоактивному заражению
- Осадки, снежный покров, почвенная влага
- 12 Режущий инструмент для обработки цилиндрических поверхностей
- 14 Теплообмен при турбулентном движении жидкости в трубах
- 65 Ознакомление участников процесса с материалами уголовного дела в связи с окончанием досудебного следствия
Свежие статьи
Как записать вебинар — 6 простых способов

Обзор программы Экранная Студия. Как записать видео с экрана

Как и где студенту составить резюме?

Правила оформления презентации для студентов в 2023 году
Источник: studizba.com
Электролиз

Электролиз – процесс, при котором электрическая энергия преобразуется в химическую. Этот процесс протекает на электродах под действием постоянного тока. Каковы продукты электролиза расплавов и растворов, и что входит в понятие «электролиз».
Электролиз расплавов солей
Электролиз – это окислительно-восстановительные реакции протекающие на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
Хаотическое движение ионов под действием тока делается упорядоченным. Анионы движутся к положительному электроду (аноду) и окисляются на нем, отдавая электроны. Катионы движутся к отрицательному полюсу (катоду) и восстанавливаются на нем, принимая электроны.
Электроды могут быть инертными (металлическими из платины или золота или неметаллическими из угля или графита) или активными. Анод в этом случае растворяется в процессе электролиза (растворимый анод). Его изготавливают из таких металлов, как хром, никель, цинк, серебро, медь и т. д.
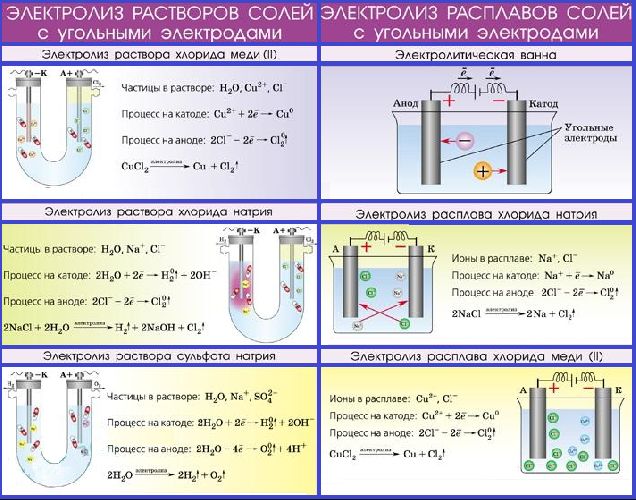
При электролизе расплавов солей, щелочей, оксидов катионы металлов разряжаются на катоде с образованием простых веществ. Электролиз расплавов является промышленным способом получения таких металлов, как натрий, калий, кальций (электролиз расплавов солей) и алюминий (электролиз расплава оксида алюминия Al2O3 в криолите Na3AlF6, используемом для облегчения переведения оксида в расплав). Например, схема электролиза расплава поваренной соли NaCl происходит так:
NaCl Na + + Cl –
Катод (–) (Na + ): Na + + е = Na 0
Анод (–) (Cl – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2
2Na+ +2Cl- = электролиз 2Na + 2Cl2
2NaCl = электролиз 2Na + Cl2
Одновременно с получением щелочного металла натрия при электролизе соли получают хлор.
Электролиз растворов солей
Если электролизу подвергаются растворы солей, то, наряду с ионами, образующимися при диссоциации соли, окисляться или восстанавливаться на электродах может и вода.
Существует определенная последовательность разряжения ионов на электродах в водных растворах.
1. Чем выше стандартный электродный потенциал металла, тем легче он восстанавливается. Иначе говоря, чем правее стоит металл в электрохимическом ряду напряжений, тем легче его ионы будут восстанавливаться на катоде. При электролизе растворов солей металлов от лития до алюминия включительно на катоде всегда восстанавливаются молекулы воды:
2H2O+2e=H2+2OH-
Если электролизу подвергаются растворы солей металлов, начиная с меди и правее меди, на катоде восстанавливаются только катионы металлов. При электролизе солей металлов от марганца MN до свинца Pb могут восстанавливаться как катионы металлов, так, в некоторых случаях, и вода.
2. На аноде окисляются анионы кислотных остатков (кроме F-). Если электролизу подвергаются соли кислородосодержащих кислот, то анионы кислотных остатков остаются в растворе, окисляется вода:
2H2O-4e=O2+4H+
3. Если анод растворимый, то происходит окисление и растворение самого анода:
Пример: электролиз водного раствора сульфата натрия Na2SO4:

Так происходит электролиз, если катодное и анодное пространства разделены. Если же они не разделены происходит электролиз воды:
2H2O=(Na2SO4)= 2H2+O2
Электролиз используют для покрытия металла медью и золотом
Что мы узнали?
По химии 11 класса обязательной является тема «Электролиз». Суть процесса заключается в том, что беспорядочное движение ионов в электролите под действием электрического поля превращается в направленное.
Источник: obrazovaka.ru