Существуют определенные принципы и правила заполнения электронами энергетических уровней и подуровней:
1. Принцип минимума полной энергии атома, согласно которому заселение электронами АО происходит так, чтобы полная энергия атома была минимальной. Экспериментально установлена следующая последовательность заполнения АО:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p . .
2. На одной АО может находиться не более двух электронов, причем их спины в этом случае должны быть антипараллельными.
3. В пределах данного энергетического подуровня электроны заполняют АО постепенно, вначале по одному (сначала все вакантные, а уже затем — по два), причем ориентация всех неспаренных электронов должна быть одинаковой, т.е. такой
Практически в любом атоме внешними являются только s- и p-АО (рис. 2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов. Внешний электронный слой, содержащий восемь электронов (в случае гелия — два) называется завершенным.
Графические схемы строения электронной оболочки за 4 минуты. [Урок 6]
Рис. 2.7. Электронно-графические схемы для атомов K (а) и S (б)
Электронные конфигурации атомов элементов 4-го периода периодической системы
Значения энергий разных энергетических подуровней для различных атомов не являются постоянными, а зависят от заряда ядра Z атома элемента: для атомов элементов с Z = 1–20 Е 3d > E 4s и Е 3d > E 4p ; для атомов элементов с Z ≥ 21 наоборот: Е 3d < E 4s и Е 3d < E 4p (рис. 2.8). Кроме того, чем больше Z, тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z, пересекаются.
Рис. 2.8. Диаграмма энергетических подуровней атомов элементов с Z = 1–20 (а), Z ≥ 21 (б)
Электронные конфигурации атомов (основное состояние) K и Са следующие (см. рис. 2.8):
19K: 1s 22s 22p 63s 23p 64s 1,
20Ca: 1s 22s 22p 63s 23p 64s 2.
Начиная со скандия (Z = 21) заполняется 3d-подуровень, а во внешнем слое остаются 4s-электроны. Общая электронная формула атомов элементов от Sс до Zn — 3d 1−104s 1−2. Например:
21Sс: [Ar] 3d 14s 2,
25Mn: [Ar] 3d 54s 2,
28Ni: [Ar] 3d 84s 2.
30Zn: [Ar] 3d 104s 2.
Для хрома и меди наблюдается проскок (провал) 4s-электрона на 3d-подуровень: Cr — 3d 54s 1, Cu — 3d 104s 1. Такой проскок с ns- на (n − 1)d-подуровень наблюдается также у атомов других элементов (Mo, Ag, Au, Pt) и объясняется близостью энергий ns- и (n − 1)d-подуровней, а также стабильностью наполовину и полностью заполненных d-подуровней.
Дальше в 4-м периоде после 10 d-элементов следуют от Ga ([Ar] 3d 104s 24p 1) до Kr ([Ar] 3d 104s 24p 6) p-элементы.
Образование катионов d-элементов связано с потерей сначала внешних ns-, затем (n − 1)d-электронов, например:
Ti: 3d 24s 2→−2e− Ti2+: 3d 2→−1e− Ti3+: 3d 1
Mn: 3d 54s 2→−2e− Mn2+: 3d 5→−2e− Mn4+: 3d 3
Отметим, что в формулах электронных конфигураций принято записывать сначала все электроны с меньшим значением n, а затем переходить к указанию электронов с более высоким значением главного квантового числа. Поэтому порядок заполнения и порядок записи энергетических подуровней для 3d-элементов не совпадают. Например, в электронной формуле атома скандия 3d-орбиталь указана до 4s-орбитали, хотя раньше заполняется 4s-орбиталь.
Строение атома. Как составить электронную и электронно-графическую формулы?
Возникает закономерный вопрос: почему в атомах 3d-элементов раньше заполняется 4s-подуровень, хотя его энергия больше энергии 3d-подуровня? Почему, например, атом Sc не имеет в основном состоянии электронную конфигурацию 1s 22s 22p 63s 23p 63d 3?
Это происходит потому, что соотношение энергий различных электронных состояний атома не всегда совпадает с соотношением энергий отдельных энергетических подуровней. Энергия 4s-подуровня для 3d-элементов больше энергии 3d-подуровня, но энергия состояния [Ar] 3d14s2 меньше энергии состояния [Ar] 3d 3.
Объясняется это тем, что межэлектронное отталкивание, а соответственно и энергия всего состояния для конфигурации . 3d 3 (с тремя электронами на одном и том же энергетическом подуровне) больше, чем для конфигурации . 3d 14s 2 (с тремя электронами, находящимися на разных энергетических уровнях).
Как написать электронно-графическую формулу | Сделай все сам.
Дабы обучиться составлять электронно-графические формулы, значимо осознать теорию строения ядерного ядра. Ядро атома составляют протоны и нейтроны. Вокруг ядра атома на электронных орбиталях находятся электроны.

- — ручка;
- — бумага для записей;
- — периодическая система элементов (таблица Менделеева).
Инструкция
1. Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой энергии:1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На одной орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.
2. Конструкцию электронных оболочек выражают с поддержкой графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один либо два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.

3. Разглядите правило составления электронно-графической формулы на примере марганца. Обнаружьте марганец в таблице Менделеева. Его порядковый номер 25, значит в атоме 25 электронов, это элемент четвертого периода.
4. Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните ступенчато 1s, 2s, 2p, 3s, 3p, 4s ярусы, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти ярусы заполнены всецело.

5. У вас осталось еще пять электронов и незаполненный 3d-ярус. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с идентичными спинами расположите в ячейках вначале по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в всей ячейке.

6. Электронно-графические формулы наглядно показывают число неспаренных электронов, которые определяют валентность.
При создании теоретических и фактических работ по математике, физике, химии студент либо школьник сталкивается с необходимостью вставки особых символов и трудных формул. Располагая приложением Word из офисного пакета Microsoft, дозволено набрать электронную формулу всякий трудности.

Инструкция
1. Откройте новейший документ в Microsoft Word. Присвойте ему наименование и сбережете в той же папке, где у вас лежит работа, дабы в грядущем не искать.
2. Перейдите на вкладку «Вставка». Справа обнаружьте символ ?, а рядом надпись «Формула». Нажмите на стрелочку. Появится окно, в котором вы можете предпочесть встроенную формулу, скажем, формулу квадратного уравнения.
3. Нажмите на стрелку и на верхней панели появятся самые различные символы, которые вам могут потребоваться при написании определенно этой формулы. Изменив ее так, как надобно вам, вы можете сберечь ее. С этого момента она будет выпадать в списке встроенных формул.
4. Если вам необходимо перенести формулу в текст, тот, что позднее надобно поместить на сайте, то кликните на энергичном поле с ней правой кнопкой мыши и выберите не высокопрофессиональный, а линейный метод написания. В частности, формула все того же квадратного уравнения в данном случае примет вид:x=(-b±?(b^2-4ac))/2a.
5. Иной вариант написания электронной формулы в Word – через конструктор. Зажмите единовременно клавиши Alt и =. У вас сразу появится поле для написания формулы, а в верхней панели откроется конструктор. Тут вы можете предпочесть все знаки, которые могут потребоваться для записи уравнения и решения всякий задачи.
6. Некоторые символы линейной записи могут быть неясными читателю, неизвестному с компьютерной символикой. В этом случае самые трудные формулы либо уравнения имеет толк сберечь в графическом виде. Для этого откройте самый легкой графический редактор Paint: «Пуск» — «Программы» — «Paint». После этого увеличьте масштаб документа с формулой так, дабы она заняла каждый экран.
Это нужно, дабы сохраненное изображение имело наибольшее разрешение. Нажмите на клавиатуре PrtScr, перейдите в Paint и нажмите Ctrl+V.
7. Обрежьте все лишнее. В результате у вас получится добротное изображение с необходимой формулой.
Источник: consei.ru
Серебро электронно графическая формула
Au (золото) — элемент с прядковым номером 79 в периодической системе. Находится в VI периоде. Температура плавления: 1064.4 ℃. Плотность: 19.32 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Au является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 9
Но в реальности происходит проскок одного электрона с орбитали 6s внешнего слоя на орбиталь 5d пред-внешнего слоя:
Электронная формула атома золота в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10
Электронная формула атома золота в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1
Сокращенная электронная конфигурация Au:
[Xe] 4f 14 5d 10 6s 1
Ниже приведена электронно-графическая схема атома золота

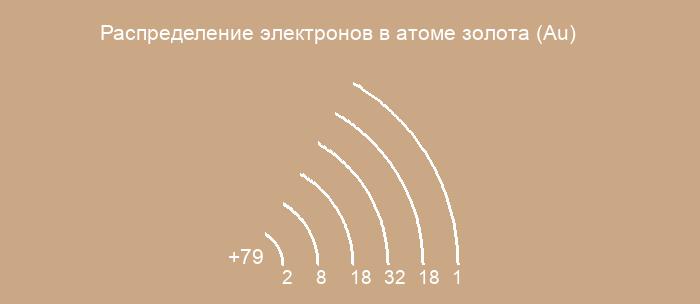
Валентные электроны золота
Количество валентных электронов в атоме золота — 11.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 6 | +1/2 | ||
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | +1/2 | |
| d | 5 | 2 | 1 | +1/2 |
| d | 5 | 2 | 2 | +1/2 |
| d | 5 | 2 | -2 | -1/2 |
| d | 5 | 2 | -1 | -1/2 |
| d | 5 | 2 | -1/2 | |
| d | 5 | 2 | 1 | -1/2 |
| d | 5 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять золото: -1, +1, +2, +3, +5
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Строение атома серебра
Общие сведения о строении атома серебра
Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 427 электронов.
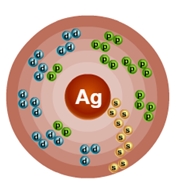
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
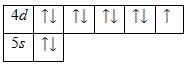
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Примеры решения задач
| Задание | Сколько атомных орбиталей d-подуровня заполнено у элемента с порядковым номером 23? Запишите его электронную формулу. |
| Решение | На d-подуровне имеется пять орбиталей, на каждой из которых может одновременно находиться 2 электрона (в сумме 10). Элемент с порядковым номером 23 — это ванадий (V). Запишем электронную конфигурацию его атома в основном состоянии: |
1s 2 2s 2 2p 6 3s 2 3p 6 3 d 3 4 s 2 .
В атоме ванадия заполнены 3 орбитали 3d-подуровня.
| Задание | Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Запишите их электронные формулы. |
| Ответ | Запишем электронные конфигурации атомов хлора и марганца в основном состоянии: |
Атому хлора до завершения внешнего энергетического уровня не хватает всего 1-го электрона, поэтому он обладает сильно выраженными неметаллическими свойствами. Марганцу для этих же целей потребуется гораздо больше электронов, поэтому, ему проще отдать свои валентные электроны при химическом взаимодействии, чем принять их – явный признак металлических свойств.
Электронная конфигурация атома серебра (Ag)
Ag (серебро) — элемент с прядковым номером 47 в периодической системе. Находится в V периоде. Температура плавления: 961.9 ℃. Плотность: 10.49 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Ag является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 9
Но в реальности происходит проскок одного электрона с орбитали 5s внешнего слоя на орбиталь 4d пред-внешнего слоя:
Электронная формула атома серебра в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10
Электронная формула атома серебра в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Сокращенная электронная конфигурация Ag:
[Kr] 4d 10 5s 1
Ниже приведена электронно-графическая схема атома серебра


Валентные электроны серебра
Количество валентных электронов в атоме серебра — 11.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 5 | +1/2 | ||
| d | 4 | 2 | -2 | +1/2 |
| d | 4 | 2 | -1 | +1/2 |
| d | 4 | 2 | +1/2 | |
| d | 4 | 2 | 1 | +1/2 |
| d | 4 | 2 | 2 | +1/2 |
| d | 4 | 2 | -2 | -1/2 |
| d | 4 | 2 | -1 | -1/2 |
| d | 4 | 2 | -1/2 | |
| d | 4 | 2 | 1 | -1/2 |
| d | 4 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять серебро: +1, +2, +3
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Серебро Ag
Серебро в таблице менделеева занимает 47 место, в 5 периоде.
| Символ | Ag |
| Номер | 47 |
| Атомный вес | 107.8682000 |
| Латинское название | Argentum |
| Русское название | Серебро |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема серебра
Ag: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10
Короткая запись:
Ag: [Kr]5s 1 4d 10
Порядок заполнения оболочек атома серебра (Ag) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Серебро имеет 47 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
1 электрон на 5s-подуровне
10 электронов на 4d-подуровне
Степень окисления серебра
Атомы серебра в соединениях имеют степени окисления 3, 2, 1, 0.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы серебра
Валентность Ag
Атомы серебра в соединениях проявляют валентность III, II, I.
Валентность серебра характеризует способность атома Ag к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ag
Квантовые числа определяются последним электроном в конфигурации, для атома Ag эти числа имеют значение N = 4, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):

Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Электронная конфигурация атома вольфрама (W)
W (вольфрам) — элемент с прядковым номером 74 в периодической системе. Находится в VI периоде. Температура плавления: 3407 ℃. Плотность: 19.26 г/см 3 .
Электронная формула атома вольфрама в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4
Электронная формула атома вольфрама в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 4 6s 2
Сокращенная электронная конфигурация W:
[Xe] 4f 14 5d 4 6s 2
Ниже приведена электронно-графическая схема атома вольфрама


Валентные электроны вольфрама
Количество валентных электронов в атоме вольфрама — 6.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 6 | +1/2 | ||
| s | 6 | -1/2 | ||
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | +1/2 | |
| d | 5 | 2 | 1 | +1/2 |
Степени окисления, которые может проявлять вольфрам: -2, -1, +1, +2, +3, +4, +5, +6
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Электронная конфигурация атома иридия (Ir)
Ir (иридий) — элемент с прядковым номером 77 в периодической системе. Находится в VI периоде. Температура плавления: 2410 ℃. Плотность: 22.56 г/см 3 .
Электронная формула атома иридия в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7
Электронная формула атома иридия в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 7 6s 2
Сокращенная электронная конфигурация Ir:
[Xe] 4f 14 5d 7 6s 2
Ниже приведена электронно-графическая схема атома иридия


Валентные электроны иридия
Количество валентных электронов в атоме иридия — 9.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 6 | +1/2 | ||
| s | 6 | -1/2 | ||
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | +1/2 | |
| d | 5 | 2 | 1 | +1/2 |
| d | 5 | 2 | 2 | +1/2 |
| d | 5 | 2 | -2 | -1/2 |
| d | 5 | 2 | -1 | -1/2 |
Степени окисления, которые может проявлять иридий: -3, -1, +1, +2, +3, +4, +5, +6, +7, +8
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Источник: ollimpia.ru
Презентация на тему Составление электронных формул и электронно-графических схем строения атома








может быть 2 электрона, отметим их и вычтем из 24.
Осталось разместить 22 электрона. Заполняется следующий 2s подуровень, на нем может быть 2 электрона. Проделаем аналогичные операции.
Дошли до 3d подуровня, на нем максимально может быть 10 электронов, но осталось только 4, их и помещаем.
Порядок заполнения энергетических уровней в атоме.
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4р6 …
2. По образцу составь электронную формулу.
Эту часть выполнили идем дальше
Слайд 5 Определи: По порядку ли идут энергетические уровни. Если уровни

идут по порядку, то так их и оставь. Если уровни
идут не по порядку, то перепиши их, расставив по мере возрастания.
Нет. 4s и 3d подуровни идут не по порядку.
Надо переписать и расставить их по мере возрастания.
Идем дальше — еще одна особенность
Слайд 6 «Провал электрона»
Если d- подуровень близок к полному заполнению:

(d9 – не хватает одного электрона до d10), или
к заполнению наполовину: (d4 – не хватает одного электрона до d5) на него часто «проваливается» электрон с s – подуровня.
Исправляем
Второй пункт выполнили переходим к следующему
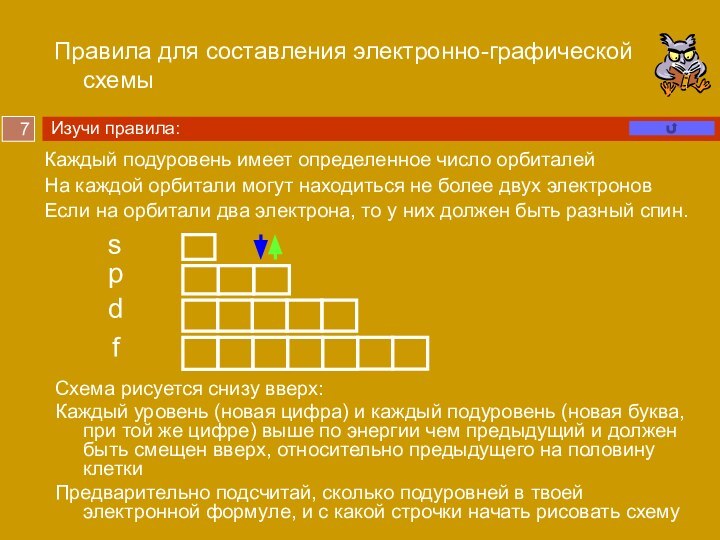
Слайд 7 Правила для составления электронно-графической схемы
Каждый подуровень имеет определенное

число орбиталей
На каждой орбитали могут находиться не более двух
электронов
Если на орбитали два электрона, то у них должен быть разный спин.
Схема рисуется снизу вверх:
Каждый уровень (новая цифра) и каждый подуровень (новая буква, при той же цифре) выше по энергии чем предыдущий и должен быть смещен вверх, относительно предыдущего на половину клетки
Предварительно подсчитай, сколько подуровней в твоей электронной формуле, и с какой строчки начать рисовать схему
Слайд 8 3. Составь электронно-графическую схему
Cr
24

всегда можно посмотреть правила
7 подуровней, отступаем вниз на (7:2
≈ 4) – на 4 клетки
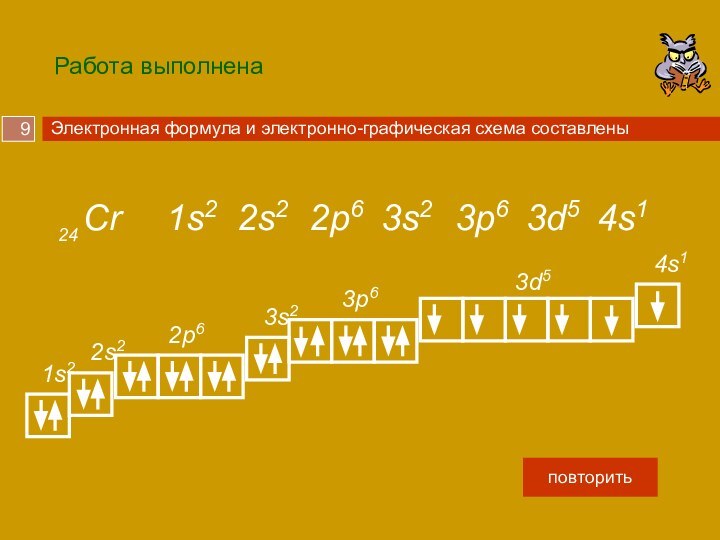
Слайд 9 Работа выполнена
Cr
24

2p6
3d5
1s2
2p6
3s2
4s1
3p6
3d5
2s2
Электронная формула и электронно-графическая схема составлены
повторить
Слайд 10 Последовательность заполнения подуровней: 1s2 2s2 2p6 3s2 3p6 4s2

3d10 4p6 5s2 4d10 6s2 4f14 5d10 6p6 7s2
5f14 6d10 7p6 …
Орбитали можно показывать не только клеточками, но и линиями.
В атомах элементов V-VII периодов могут встретиться и другие случаи «провала» электронов, не подчиняющиеся простым правилам. Составленные формулы надо проверять по справочным данным
При возбуждении атома его внешние электроны могут распариваться и переходить на ближайшие свободные подуровни.
При составлении электронных формул и схем элементов V-VII периодов, учти:
Источник: findtheslide.com