Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
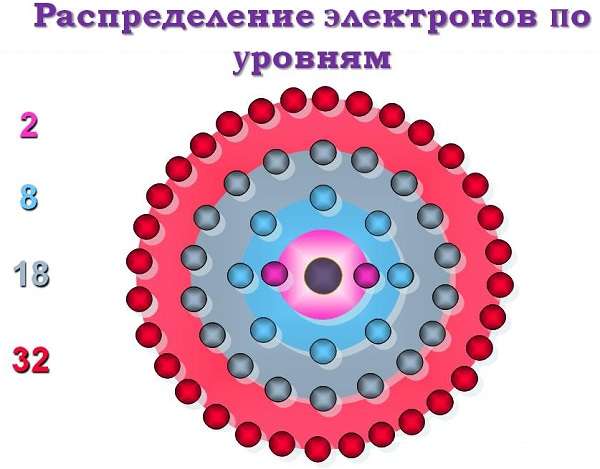
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 427 электронов.
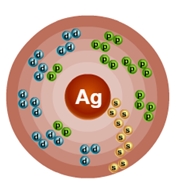
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
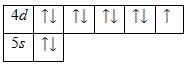
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Примеры решения задач
| Задание | Сколько атомных орбиталей d-подуровня заполнено у элемента с порядковым номером 23? Запишите его электронную формулу. |
| Решение | На d-подуровне имеется пять орбиталей, на каждой из которых может одновременно находиться 2 электрона (в сумме 10). Элемент с порядковым номером 23 — это ванадий (V). Запишем электронную конфигурацию его атома в основном состоянии: |
1s 2 2s 2 2p 6 3s 2 3p 6 3 d 3 4 s 2 .
Энергетические уровни. 8 класс.
В атоме ванадия заполнены 3 орбитали 3d-подуровня.
| Задание | Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Запишите их электронные формулы. |
| Ответ | Запишем электронные конфигурации атомов хлора и марганца в основном состоянии: |
Атому хлора до завершения внешнего энергетического уровня не хватает всего 1-го электрона, поэтому он обладает сильно выраженными неметаллическими свойствами. Марганцу для этих же целей потребуется гораздо больше электронов, поэтому, ему проще отдать свои валентные электроны при химическом взаимодействии, чем принять их – явный признак металлических свойств.
Электронная конфигурация атома серебра (Ag)
Ag (серебро) — элемент с прядковым номером 47 в периодической системе. Находится в V периоде. Температура плавления: 961.9 ℃. Плотность: 10.49 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Ag является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 9
Но в реальности происходит проскок одного электрона с орбитали 5s внешнего слоя на орбиталь 4d пред-внешнего слоя:
Электронная формула атома серебра в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10
Электронная формула атома серебра в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Сокращенная электронная конфигурация Ag:
[Kr] 4d 10 5s 1
Ниже приведена электронно-графическая схема атома серебра


Валентные электроны серебра
Количество валентных электронов в атоме серебра — 11.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 5 | +1/2 | ||
| d | 4 | 2 | -2 | +1/2 |
| d | 4 | 2 | -1 | +1/2 |
| d | 4 | 2 | +1/2 | |
| d | 4 | 2 | 1 | +1/2 |
| d | 4 | 2 | 2 | +1/2 |
| d | 4 | 2 | -2 | -1/2 |
| d | 4 | 2 | -1 | -1/2 |
| d | 4 | 2 | -1/2 | |
| d | 4 | 2 | 1 | -1/2 |
| d | 4 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять серебро: +1, +2, +3
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Серебро, свойства атома, химические и физические свойства
Серебро, свойства атома, химические и физические свойства.










107,8682(2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Серебро — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 47. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), пятом периоде периодической системы.
Физические свойства серебра
Атом и молекула серебра. Формула серебра. Строение атома серебра:
Серебро (лат. Argentum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ag и атомным номером 47. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), пятом периоде периодической системы.
Серебро – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Как простое вещество серебро при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула серебра одноатомна.
Химическая формула серебра Ag.
Электронная конфигурация атома серебра 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 . Потенциал ионизации (первый электрон) атома серебра равен 731 кДж/моль (7,576234(25) эВ).
Строение атома серебра. Атом серебра состоит из положительно заряженного ядра (+47), вокруг которого по пяти оболочкам движутся 47 электронов. При этом 46 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку серебро расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома серебра на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона.
Серебро относится к элементам d-семейства.
Радиус атома серебра (вычисленный) составляет 165 пм.
Атомная масса атома серебра составляет 107,8682(2) а. е. м.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Изотопы и модификации серебра:
Свойства серебра (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Серебро |
| 102 | Прежнее название | |
| 103 | Латинское название | Argentum |
| 104 | Английское название | Silver |
| 105 | Символ | Ag |
| 106 | Атомный номер (номер в таблице) | 47 |
| 107 | Тип | Металл |
| 108 | Группа | Драгоценный, переходный металл, металл платиновой группы |
| 109 | Открыт | Известно с древних времен |
| 110 | Год открытия | до 5000 года до н. э. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 7,9·10 -6 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10 -8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10 -8 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10 -7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000014 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0 |
205* Эмпирический радиус атома серебра согласно [1] и [3] составляет 144 пм.
206* Ковалентный радиус серебра согласно [1] и [3] составляет 145±5 пм и 134 пм соответственно.
401* Плотность серебра согласно [3] и [4] составляет 10,5 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления серебра согласно [3] и [4] составляет 961,95 °С (1235,1 K, 1763,51 °F) и 960,5 °С (1233,65 K, 1760,9 °F) соответственно.
403* Температура кипения серебра согласно [3] и [4] составляет 2211,85 °C (2485 K, 4013,33 °F) и 2167 °С (2440,15 K, 3932,6 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) серебра согласно [3] и [4] составляет 11,95 кДж/моль и 11,3 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) серебра согласно [3] и [4] составляет 254,1 кДж/моль и 251,5 кДж/моль соответственно.
410* Молярная теплоёмкость серебра согласно [3] составляет 25,36 Дж/(K·моль).
Источник: ollimpia.ru
Электронная конфигурация атомов и ионов
В химии есть очень увлекательный, но сложный раздел – электронная конфигурация атомов и ионов.
Молекулу любого из элементов таблицы Менделеева можно изучить с точки зрения как физики, так и химии.
Дивный молекулярный мир на атомном уровне отличается от привычного. Разберем подробно, как образуется электронная формула элементов.
Строение «электронных» оболочек атомов
Для лучшего понимания электронных окружающих ядро оболочек, нужно знать об ионе – частице, в основе которой, кроме электронов, присутствуют так называемые протоны.

Если число протонов больше числа электронов, то такой атом называется катионом (положительный заряд). В противном случае атом называется анионом (заряд отрицательный).
Каждый из электронов занимает свой собственный уровень относительно ядра.
Конфигурация электронов для отдельно взятого атома может строиться в порядке атомных чисел. В качестве первоначального элемента выбирается водород, а далее продолжается добавление одного протона к ядру согласно с подсхемой и местом в периодической таблице, пока не опишутся все химические элементы.
Такая процедура называется принципом Aufbau (Ауфбау). Название принципа происходит от немецкого слова и переводится «построить».
Можно сделать вывод, что появление ионов связано с моментом, когда атомы получают или теряют заряды. Катион (положительно заряженный ион) образуется, когда один или несколько зарядов удаляются из «родительского атома».
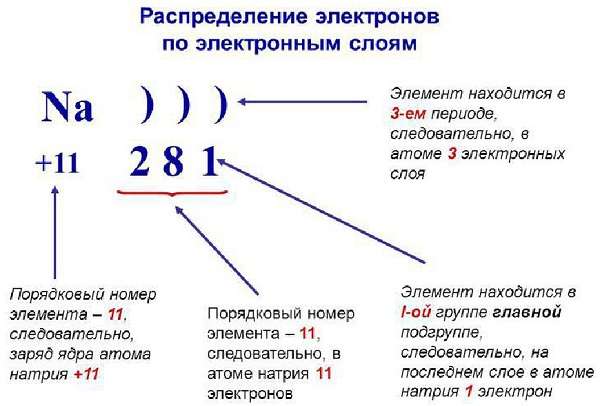
Распределение электронных зарядов по уровням
Как уже говорилось выше, молекула любого элемента периодической таблицы – это своеобразный микрокосмос, где в разные стороны (спины) двигаются заряженные частицы (лептон). По-английски spin означает «вращение». Их полуцелые «спины» были описаны Вольфгангом Паули в 1925 году.
Всего принципов построения графических распределительных схем существует три:
- Принцип ограничений, который сформирован швейцарским физиком В. Паули. На одном электронном уровне ядра может быть два лептона с разным направлением вращения (если один вращается против часов стрелки, то другой по часовой). Опыты в адронном коллайдере доказали этот факт.
- Второй строительный принцип говорит, что лептоны стремятся занять уровни по мере возрастания энергетического запаса.
- Третий гласит, что любой электрон «любит» только себя и плохо переносит «соседей» по орбитали. Иными словами, сначала электроны занимают свободные клетки (в графическом исполнении формулы), а уже по второму кругу занимают свободные места.
Теперь рассмотрим состав «квартир» для лептонов. В зависимости от уровня и энергии, орбитальные места можно разделить на четыре формы:
- Эс (s) имеет форму круга и способен на одном уровне вместить только два заряда ядра.
- Пи (p) готов предоставить три «места» для шести лептонов.
- Де (d) предоставляет пять «мест» – 10 заряженных частиц.
- Эф (f) самый щедрый на «места», их число равно семи – соответственно 14 парных частиц.
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
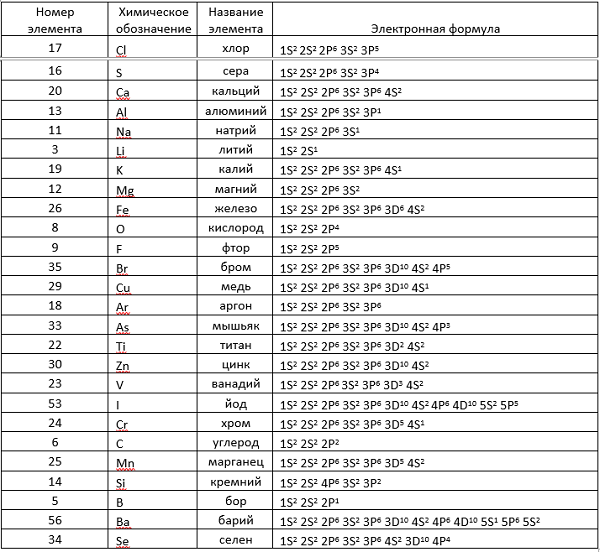
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
В таблице Менделеева его номер восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).

Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
Начинаем распределять электроны Ar:
- a) поскольку аргон находится в третьем периоде, то у него три подуровня. Смотрим в учебник химии и находим, что это p-элемент,
- b) запишем формулу: 1 s, 2 s, 2 p, 3 s, 3 p,
- c) теперь рисуем орбитальные ячейки и заполняем их.
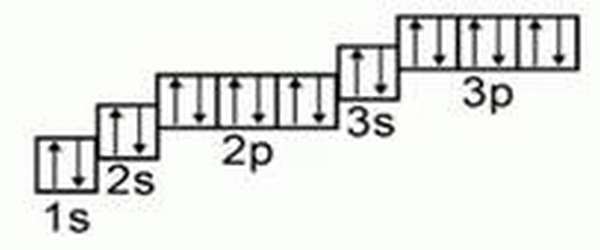
Графическое изображение формулы аргона

Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов.
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.
Источник: tvercult.ru
Энергетические уровни атомов
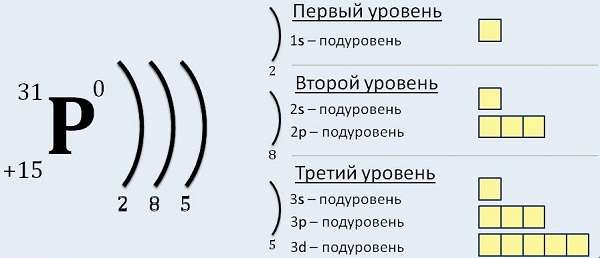
Чем ближе к атомному ядру находится электронная оболочка атома, тем сильнее притягиваются ядром электроны и тем больше их энергия связи с ядром. Поэтому расположение электронных оболочек удобно характеризовать энергетическими уровнями и подуровнями и распределением по ним электронов. Число электронных энергетических уровней равно номеру периода, в котором находится данный элемент. Сумма чисел электронов на энергетических уровнях равна порядковому номеру элемента.
Электронная структура атома представлена на рис. 1.9 в виде диаграммы распределения электронов по энергетическим уровням и подуровням. Диаграмма состоит из электронных ячеек, изображенных квадратами. Каждая ячейка символизирует одну электронную орбиталь, способную принять два электрона с противоположными спинами, обозначаемыми стрелками вверх и вниз.

Рис. 1.9. Распределение электронов но энергетическим уровням и подуровням атомов 1—4-го периодов таблицы элементов
Электронная диаграмма атома построена в последовательности повышения номера энергетического уровня. В том же направлении повышается энергия электрона и понижается энергия его связи с ядром. Для наглядности можно представить, что ядро атома находится «внизу» диаграммы. Число электронов в атоме элемента равно числу протонов в ядре, т.е. порядковому номеру элемента в периодической таблице.
Первый энергетический уровень состоит всего из одной орбитали, которую обозначают символом s. Эту орбиталь заполняют электроны водорода и гелия. У водорода один электрон, и водород одновалентен. У гелия два парных электрона с противоположными спинами, гелий имеет нулевую валентность и не образует соединений с другими элементами. Энергии химической реакции недостаточно для того, чтобы возбудить атом гелия и перевести электрон на второй уровень.
Второй энергетический уровень состоит из .«-подуровня и /.(-подуровня, имеющего три орбитали (ячейки). Литий третий электрон посылает на 2«-подуровень. Один непарный электрон обусловливает одновалентность лития. Бериллий вторым электроном заполняет тот же подуровень, поэтому в невозбужденном состоянии у бериллия два парных электрона. Однако незначительной энергии возбуждения оказывается достаточно для того, чтобы перевести один электрон на ^-подуровень, что делает бериллий двухвалентным.
Подобным образом происходит дальнейшее заполнение 2р-под- уровня. Кислород в соединениях двухвалентен. Более высокие валентности кислород не проявляет из-за невозможности распаривания электронов второго уровня и перевода их на третий энергетический уровень.
В отличие от кислорода сера, расположенная под кислородом в той же подгруппе, может проявлять в своих соединениях валентности 2, 4 и 6 благодаря возможности распаривания электронов третьего уровня и перемещения их на ^-подуровень. Заметим, что возможны и другие валентные состояния серы.
Элементы, у которых заполняется s-подуровень, называются «-элементами. Аналогично образуется последовательность р-элементов. Элементы s- и р-подуровней входят в главные подгруппы. Элементы побочных подгрупп — это ^-элементы (неправильное название — переходные элементы).
Удобно подгруппы обозначать символами электронов, благодаря которым образовались входящие в подгруппу элементы, например s’-подгруппа (водород, литий, натрий и др.) или //-подгруппа (кислород, сера и др.).
Если периодическую таблицу построить так, чтобы номера периодов повышались снизу вверх, а в каждую электронную ячейку помещать сначала по одному, а затем по два электрона, получится длиннопериодная периодическая таблица, напоминающая по форме диаграмму распределения электронов по энергетическим уровням и подуровням.
Источник: studme.org