Все вещества состоят из атомов. Слово «атом» придумали задолго до наступления нашей эры. Но тогда считалось, что атом – самая крошечная частица, меньше которой ничего нет. Но наука доказала, что в атоме есть более мелкие частиц: протон, нейтрон и электрон. Протон и нейтрон находятся в ядре атома, каждая эта частица имеет массу в 1 единицу.
Протон имеет заряд +1, нейтрон заряда не имеет. А ещё в атоме есть электрон, который летает вокруг ядра. Он маленький и весит так мало, что его вклад ничтожен, поэтому его массой можно пренебречь. А вот заряд у электрона есть, он отрицательный и равен -1 . Всё это подробно изложено в статье «Строение атома» . Ну а теперь переходим к вопросу, как понять, как устроен атом конкретного элемента, например, кислорода или кальция.
Итак, напоминаю, что атомы – нейтральны, они никогда не имеют заряда (или, иначе говоря, у них заряд 0). Но при этом в атоме есть протоны с зарядом +1, нейтроны с зарядом 0 и электроны с зарядом -1. Чтобы общий заряд атома был 0, нужно сделать так, чтобы в нём число положительных зарядов равнялось числу отрицательных.
Энергетические уровни. 8 класс.
То есть в атоме число протонов (а именно они имеют заряд +1) равняется числу электронов (они имеют заряд -1). Это важно! И этот очевидный факт нужно понять и запомнить.
Сколько в атоме протонов, столько и электронов!
Почему мы тут не учли нейтроны? Потому что сейчас они нам не важны, ведь их заряд 0, поэтому на заряд атома они не влияют.
Теперь переходим к самому главному. Как же узнать число протонов и электронов в атоме ? Для этого мы берём гигантскую шпаргалку, которая у вас всегда перед глазами в любом учебнике химии или кабинете химии. Это таблица Менделеева. Кстати, из неё можно узнать очень-очень много, но об этом позже.
Фото из открытых источников
Так вот. Смотрим на порядковый номер элемента (Здесь представлен фрагмент таблицы, и на картинке порядковые номера обведены синими кружками). Порядковый номер элемента – это заряд ядра.
Порядковый номер элемента в таблице Менделеева – это заряд ядра.
Но вы же помните, что ядро у нас состоит из положительно заряженных протонов и нейтронов без заряда. Значит, заряд ядра определяют только протоны, только у них есть заряд. Каждый протон имеет заряд +1. Следовательно, общий заряд ядра и показывает, сколько в ядре протонов. И чтобы было понятно, вот примеры (и используйте, рассматривая их, периодическую таблицу, которая есть в любом учебнике химии).
Пример 1.
Порядковый номер бора 5. То есть заряд ядра атома бора +5. Один протон имеет заряд +1. Сколько нужно протонов, чтобы получить заряд +5? Пять протонов. И да, в ядре атома бора 5 протонов.
Пример 2.
Порядковый номер алюминия 13. Рассуждая как выше, получаем, что в ядре атома алюминия 13 протонов, а заряд ядра +13.
Пример 3.
Порядковый номер аргона 18. Значит, протонов в ядре атома аргона 18, а заряд ядра +18.
Разобрались? Но чуть раньше мы говорили, что атом нейтрален, у него заряд 0! А теперь говорим, что у нас есть ядро, например, бора, у которого заряд +3. Всё верно, ведь вокруг ядра вращаются отрицательно заряженные электроны. Каждый электрон имеет заряд -1, и благодаря им атом получает общий заряд 0. Давайте снова перейдём к примерам.
Как решать 1 задание из ЕГЭ по химии «Электронная конфигурация атома»
Итак, снова про бор. Его порядковый номер 5, и мы уже поняли, что заряд ядра атома бора +5, и в нём 5 протонов. Сколько нам нужно электронов (каждый из которых имеет заряд -1), чтобы получить в сумме 0? Конечно же, 5! Потому что 5 плюсов и 5 минусов это и есть о! То есть число протонов всегда равно числу электронов.
Ещё один пример и более наглядно.
Посмотрим пристально на кальций. Его порядковый номер 20. Как и любого другого атома, у него есть ядро, в которое входят протоны и нейтроны, и электроны, которые вращаются вокруг ядра. Порядковый номер 20 говорит нам, что в ядре атома кальция находятся 20 протонов (каждый имеет заряд +1, а 20 протонов имеют заряд +20). Чтобы заряд атома кальция был 0, нужно 20 минусов.
И это действительно так: вокруг ядра атома кальция вращаются 20 электронов.
Таким образом, если репетитор по химии или учитель в школе спрашивает, сколько в таком-то атоме протонов и электронов, действуем так:
1. Находим элемент в таблице Менделеева.
2. Смотрим на порядковый номер.
3. Порядковый номер = числу протонов в ядре = числу электронов.
Например, такой хитрый вопрос (на егэ по химии он не попадётся, но для тренировки решим). А сколько протонов и электронов содержится в атоме олова? Быстро ищем олово в таблице Менделеева. Порядковый номер олова – 50. И отвечаем моментально: в атоме олова 50 протонов и 50 электронов.
Вот и всё.
И тут можно снова задаться вопросом о нейтронах. Зачем же они в ядре и на что они влияют? А про это говорим в следующий раз.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: dzen.ru
Если заряд электрона порядковый номер золота

Если заряд электрона –1,6∙10-19 Кл, порядковый номер золота в таблице Менделеева 79, молярная масса золота 0,197 кг/моль, число Авогадро 6,02∙1023 моль-1, то электрический заряд всех электронов, содержащихся в слитке золота массой 100 г, равен A) 38,6∙10-5 Кл. B) 36,8∙105 Кл. C) 38,6∙105 Кл. D) 36,8∙10-5 Кл. E) 386∙105 Кл
Ответ проверен экспертом
3 (2 оценки)

triolana 6 лет назад
Светило науки — 553134 ответа — 388270 раз оказано помощи
Число атомов золота найдем из формулы:
m/M = N/Na
N=m*Na/M = 0,100*6,02*10²³ / 0,197 = 3,06*10²³ атомов золота
В одном атоме 79 электронов. Учитывая заряд электрона, найдем электрический заряд всех электронов:
q = 79*1,6*10⁻¹⁹*3,06*10²³ ≈ 38,6*10⁵ Кл
Источник: vashurok.com
Строение атома

Для удобства будем использовать планетарную модель строения атома Н. Бора, согласно которой в центре атома располагается положительно заряженное ядро, состоящее из протонов и нейтронов, а вокруг двигаются электроны по «орбитам» и образуют электронную оболочку
Вся необходимая для построения модели атома информация находится в Периодической системе химических элементов Д.И. Менделеева:
-
Порядковый номер элемента равен количеству протонов (р + ) в ядре этого атома, так у лития три протона, у бериллия – четыре, а у натрия одиннадцать. Известно, что атом – нейтральная частица, количество протонов в ней всегда будет равно количеству электронов. Поэтому порядковый номер определяет не только заряд ядра, но и общее количество электронов на всех орбиталях атома этого элемента.
Строение атома
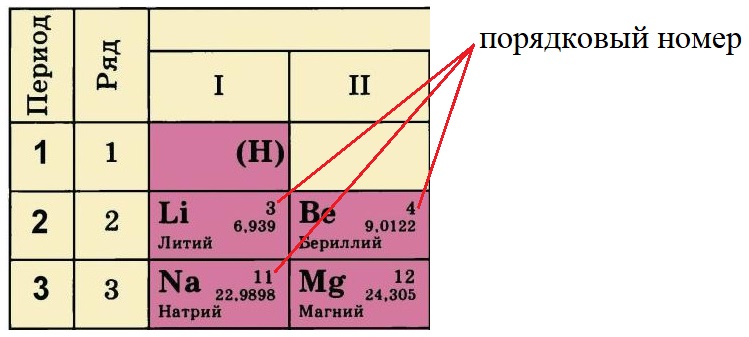
Порядковый номер в таблице Менделеева
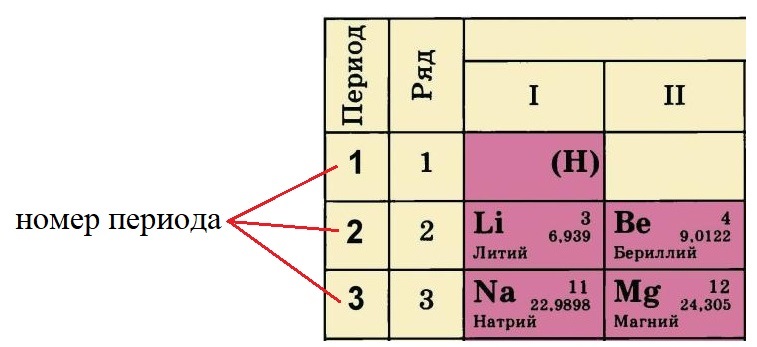
- Номер периода, в котором располагается данный элемент, показывает, на каком количестве уровней находятся электроны. Так, электроны лития и бериллия располагаются на двух уровнях, а натрия и магния – на трёх.
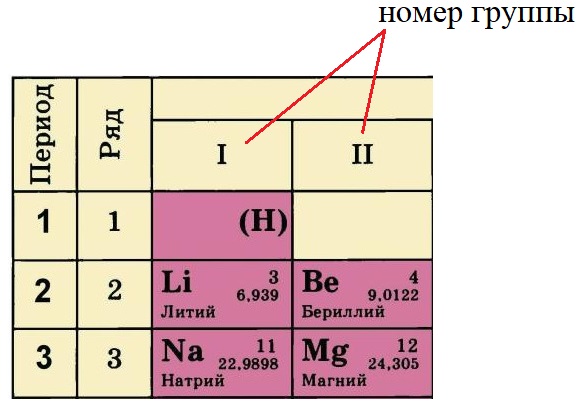
- Номер группы, в котором стоит элемент определяет количество электронов на внешнем уровне (валентные электроны). У лития и натрия по одному электрону на внешнем уровне, а у бериллия и магния – по два. Это правило действует только на элементы А-подгрупп.
А-подгруппа и Б-подгруппа.
Как определить, какой элемент относится к А-подгруппе, а какой – к B (Б)-подгруппе?
Некоторые таблицы содержат эту информацию:
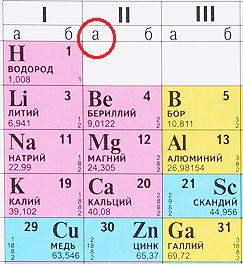
Но большинство таблиц имеет только обозначения групп. Что делать в таком случае? Всё просто: ориентируйтесь по элементам второго периода, они все являются элементами А-подгрупп (литий, бериллий, бор, углерод, азот, кислород, фтор, неон), те элементы, что располагаются прямо под ними тоже относятся к А-подуровню:
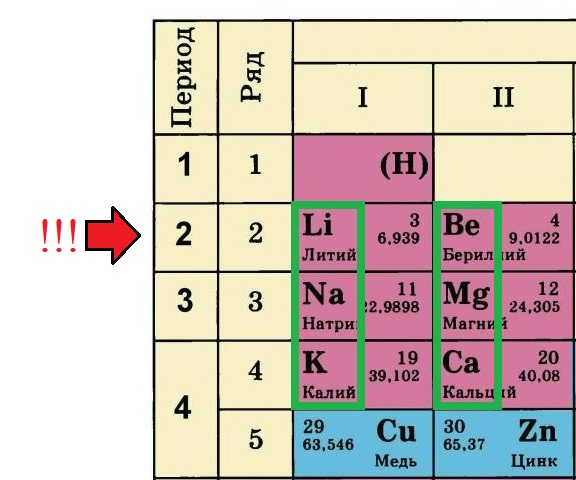
В данном примере зеленым прямоугольником выделены элементы А-подгрупп, так как с них начинается второй период ПС. А значок меди и цинка расположен с другой стороны, это элементы В-подгрупп.
Пример построения модели атома.
Теперь попробуем составить электронную конфигурацию атома бериллия. Последовательность действий отображена цифровыми обозначениями на рисунке, изображающем фрагмент ПС:
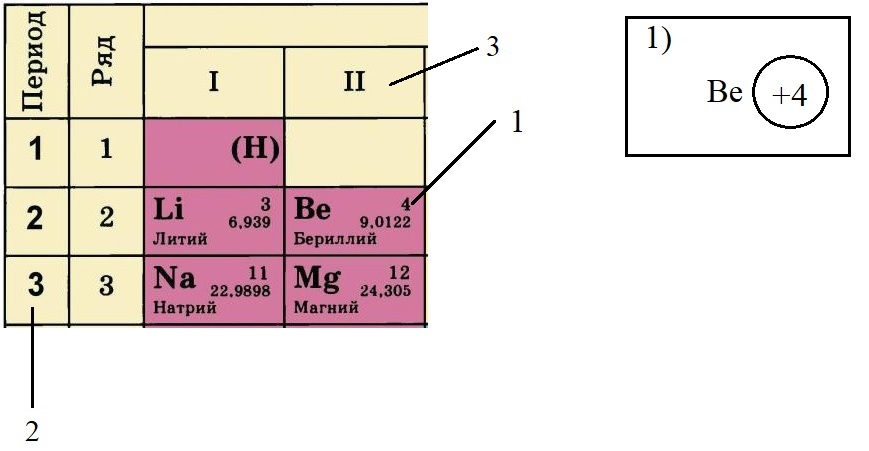
- По порядковому номеру определяем заряд ядра, записываем в круг после символа элемента. Помним, что это еще и количество электронов.
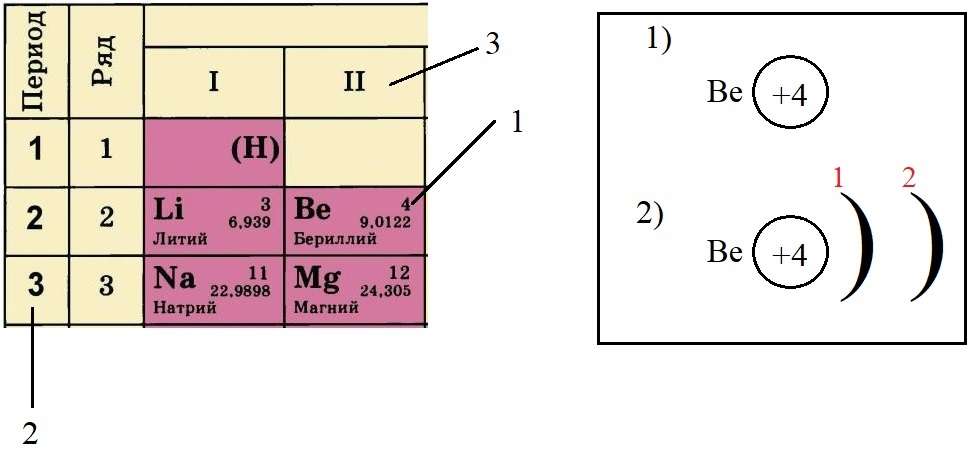
- Определяем количество энергетических уровней, оно равно номеру периода, в котором стоит элемент. Бериллий стоит во втором периоде, значит, у него два энергетических уровня:
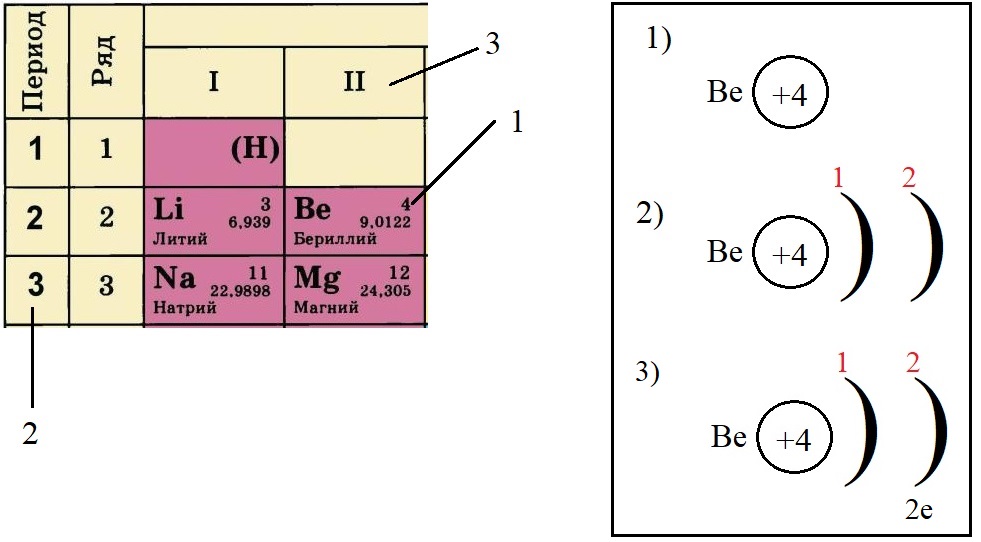
- Определяем количество электронов на внешнем уровне, оно равно номеру группы. Бериллий стоит во второй группе, у него два электрона на внешнем слое:
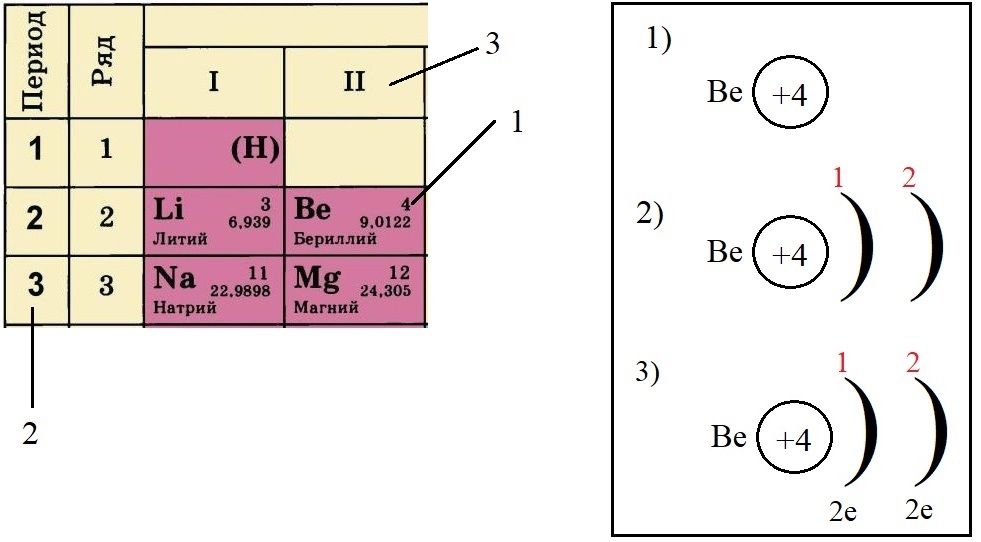
- Не трудно догадаться, что если всего у бериллия должно быть четыре электрона, два из которых находятся на внешнем слое, то оставшиеся два находятся на внутреннем слое:
Максимальное количество электронов на уровнях
Чтобы строить электронные конфигурации более крупных атомов, необходимо ввести еще несколько данных. Начнем с максимального количества электронов на определенном уровне, это количество показано на рисунке:

Стоит помнить, что это лишь максимальное количество, большинство элементов не имеют на каждом уровне такого количества электронов.
Так же следует помнить, что какой бы номер не имел бы внешний уровень, на нем максимальное количество электронов не должно превышать восьми.
Следует учитывать, что предвнешний слой следует заполнять последним, чтобы избежать ошибок.
Рассмотрим данные правила на примере построения конфигурации атома кальция.
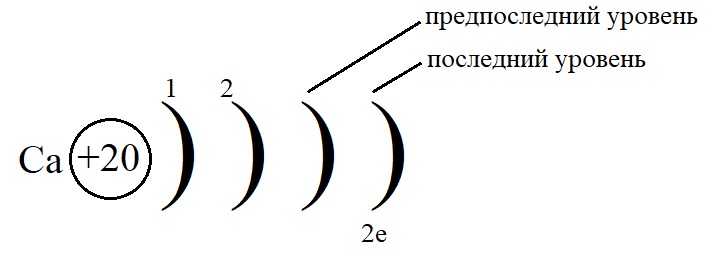
- Порядковый номер кальция – 20, у него 20 протонов в ядре и 20 электронов на орбиталях. Кальций стоит во второй группе, значит, на внешнем слое у него 2 электрона.
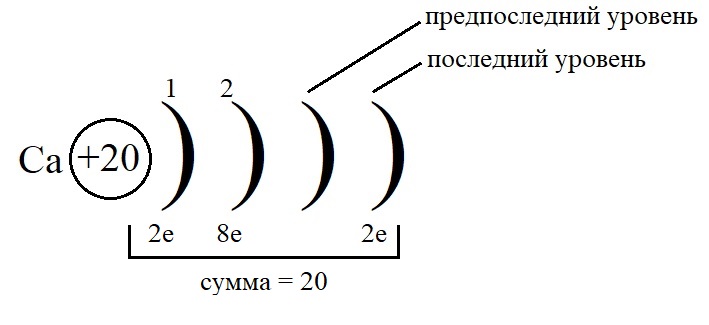
- Остальные уровни, кроме предвнешнего, заполняем по максимальному количеству на этих слоях:
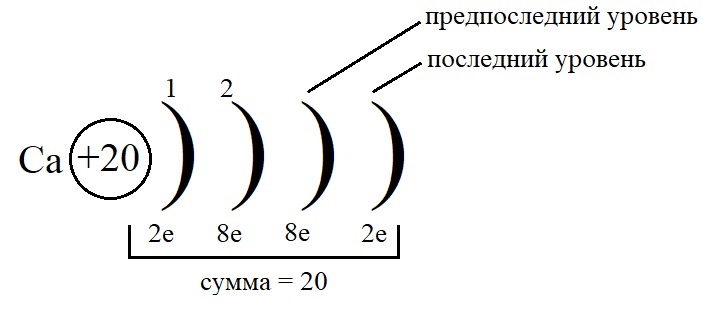
- Как показано на рисунке, общее количество электронов должно быть равным двадцати, а пока мы распределили только двенадцать, значит, на предпоследнем уровне необходимо поставить восемь электронов:
Каждый энергетический уровень можно разбить на подуровни (орбитали). Их существует 4 вида: s-, p-, d-, f-орбитали. Они характеризуют область пространства, в которой электрон находится с наибольшей вероятностью.
Источник: onlineclass.space