А3. Уксусная кислота в отличие от ацетальде-гида образует водородные связи. Это обусловливает:
1) уменьшение температуры кипения;
2) повышение растворимости в воде;
3) появление окраски;
4) понижение растворимости в воде.
А4. Верны ли следующие суждения о свойствах фенола?
А. Фенол вступает в реакцию «серебряного зеркала».
Б. Фенол реагирует с соляной кислотой. 1) Верно только А.
2) Верно только Б.
3) Верны оба суждения.
4) Оба суждения неверны.
А5. Веществом Х в цепочке превращений
А6. Реакция, описываемая схемой
относится к реакциям:
А7. Как распознать этиленгликоль? Уравнение реакции, цвет раствора.
1) А8. Объем водорода (н. у.), полученный при
действии натрия на 4,6 г этанола по уравнению ре-акции 2C2 H5OH + 2Na → 2C2 H5ONa + H2, составил:
| 1) | 11,2 л; | 3) 2,24 л; |
| 2) | 1,12 л; | 4) 22,4 л. |
Качественная реакция на фенол
В1. Установите соответствие между формулой соединения и классом органических веществ.
Формула соединения
Класс органических веществ
Источник: helpiks.su
Фенол вступает в реакцию серебряного зеркала фенол реагирует с соляной кислотой
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
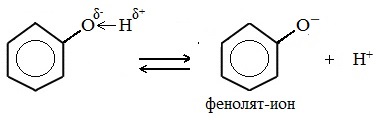
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.

1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
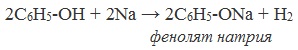
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
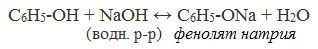
Видеоопыт «Взаимодействие фенола с раствором щелочи»
9.3. Фенол: Химические свойства
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов.
Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
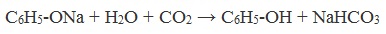
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
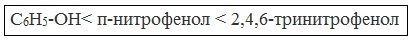
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
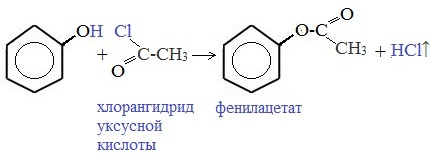
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
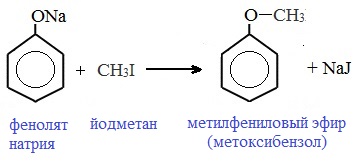
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
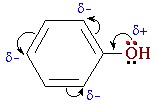
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
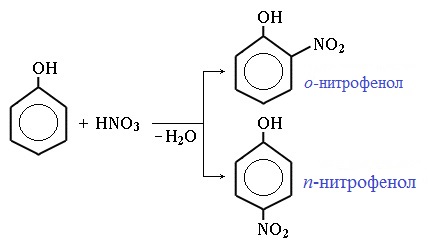
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
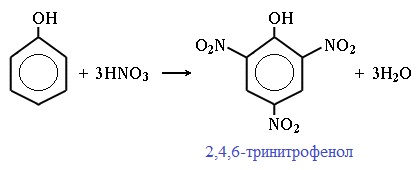
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
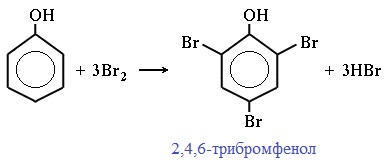
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер:
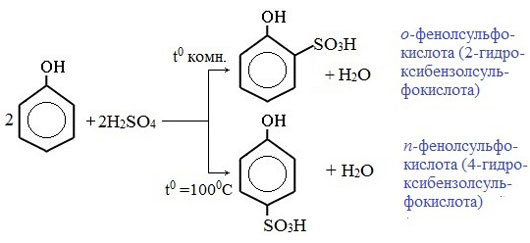
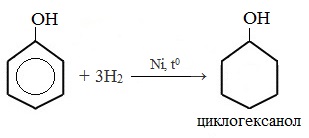
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
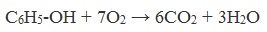
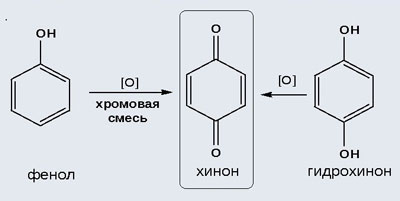
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
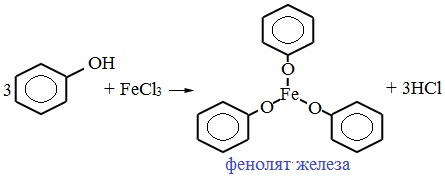
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
 Рубрики: Фенолы
Рубрики: Фенолы  Теги: Фенолы
Теги: Фенолы
Обожаю ваш сайт. Но в этом году в других источниках встретила утверждение, что «фенол НЕ изменяет цвет индикатора».Однако, если в пособиях разного уровня утверждалось, что «фенол диссоциирует на катион водорода. », то КАК это было доказано? Только реакцией с щёлочью? Я не имею возможности на опыте проверить, но была уверена в том, что р-р фенола «достаточно кислота» и МЕНЯЕЕТ цвет лакмуса. КАК быть?
Людмила) 1. Подобно кислотам фенол в водных растворах диссоциирует по кислотному типу: на фенолят-ионы и ионы водорода. Фенол диссоциирует обратимо, НО… силы его кислотных свойств достаточно, чтобы изменить окрасу индикатора (в растворе фенола лакмус краснеет). Старинное название фенола – карболовая кислота.
2. Кислотные свойства фенола проявляются при взаимодействии его активными металлами и с их гидроксидами с образованием фенолятов (солей фенола). C6H5OH+NaOH=C6H5ONa+H2O 3. Феноляты легко разлагаются под действием кислот, даже такой слабой, как угольная. Из этого следует, что фенол – более слабая кислота, чем H2CO3. C6H5ONa + СО2 + Н2О → С6Н5ОН + NaHCO3 4. Феноляты подвергаются гидролизу, как соли слабой кислоты и сильного основания.
Источник: himija-online.ru
Тема №22 «Характерные свойства фенолов»
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Поделиться в Facebook
Твитнуть в Twitter
Характерные свойства фенолов
Оглавление
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил С6Н5—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т. е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:

Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:

Существуют и другие многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом С6Н5ОН. Название этого вещества и легло в основу названия всего класса — фенолы.

Физические свойства фенолов
Фенол — твердое, бесцветное кристаллическое вещество, t° = 43 °С, t° = 181 °С, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!


Химические свойства фенолов
Кислотные свойства. Атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:

Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.

Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).

Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола.
В отличие от бензола для бромирования фенола не требуется добавления катализатора (бромида железа (III)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:

Эта реакция, так же как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и параизомеров нитрофенола:

При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол — пикриновая кислота, взрывчатое вещество:

3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:

4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:

В молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:

Реакция поликонденсации, т. е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:

Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами.
Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот. Они обладают высокими диэлектрическими свойствами.
Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Таким образом, фенол и продукты на его основе находят широкое применение.
Шпаргалка
Справочный материал для прохождения тестирования:
Источник: chem-mind.com