Даны четыре занумерованные пробирки с растворами следующих веществ: азотная кислота, нитрат серебра, хлорид натрия, фосфат натрия. В какой пробирке какой раствор содержится – неизвестно, но установлено, что: 1) при сливании растворов из 2й и 4й пробирок получается осадок, растворяющийся при добавлении раствора из 1й пробирки; 2) при сливании растворов 2-го и 3-го получается осадок, не растворяющийся при добавлении раствора из 1й пробирки. Определите, какие растворы находятся в пробирках 1,2,3 и 4й. Напишите уравнения всех упоминаемых в задаче реакций.
Ответ:
1 пробирка – азотная кислота HNO3 2 пробирка – раствор нитрата серебра AgNO3 3 пробирка – раствор хлорида натрия NaCl 4 пробирка – раствор фосфата натрия Na3PO4 1) При сливании растворов нитрата серебра и фосфата натрия образуется осадок фосфата серебра, растворимый в азотной кислоте

фосфат натрия и нитрат серебра
Похожие готовые решения по химии:
- Соль обладает следующими свойствами: при нагревании ее с избытком щелочи выделяется аммиак, а при добавлении раствора хлорида
- Сколько граммов хлора прореагировало с йодидом калия, если при этом получилось 25,4 г йода?
- Один металл можно обнаружить следующим образом: каплю раствора его соли помещают на чистую медную пластинку
- На основании данных зависимости поверхностного натяжения водных растворов поверхностно-активных веществ (ПАВ) от концентрации
- Рассчитайте молярность раствора (ρ = 1,07 г/см3 ), содержащего 10% NaCl.
- Имеются две склянки без надписей: в одной из них – разбавленная соляная кислота, а в другой – разбавленная серная кислота
- Как с помощью одного реактива отличить между собой хлорид калия и сульфид калия? Напишите уравнения реакций
- Реакция между железом и сульфатом меди выражается уравнением: Fe + CuSO4 → Cu + FeSO4 Сколько граммов меди может быть вытеснено
- К раствору, содержащему глюкозу, добавлено 25 мл 0,1 н. стандартного раствора йода и раствор КОН. Смесь выдержана в затемненном месте, добавлена соляная
- Образуется ли осадок карбоната кальция при смешивании равных объемов растворов хлорида кальция и карбоната калия, если их исходные
- Соль обладает следующими свойствами: при нагревании ее с избытком щелочи выделяется аммиак, а при добавлении раствора хлорида
- Рассчитать концентрацию и активность ионов водорода в растворе хлороводородной кислоты, если водородный показатель раствора равен 2.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Качественная реакция фосфат натрия+нитрат серебра
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник: www.evkova.org
Вариант 2
1. Напишите уравнения реакций: а) фосфора с хлором; б) фосфора с магнием; в) раствора фосфата натрия с раствором нитрата серебра (в молекулярной и ионной формах).
2. Поясните, почему фосфор встречается в природе только в виде соединений, тогда как находящийся с ним в одной группе азот — главным образом в свободном виде.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ответы и решения:

2. Фосфор очень реакционноспособное вещество, а молекула азота устойчива и химически малоактивна
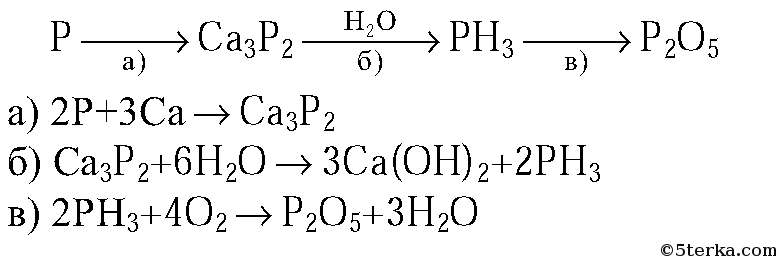
Источник:

Решебник по химии за 9 класс (А.М.Радецкий, 2011 год),
задача №2
к главе «Тема III. Подгруппа азота. Работа 3. Фосфор и его соединения».
Источник: 5terka.com
ГДЗ Химия 8 класс класс Габриелян. Лабораторный опыт 26. Номер №1
В три пробирки с растворами хлорида, фосфата и иодида натрия добавьте по нескольку капель раствора нитрата серебра. Что наблюдаете? Запишите уравнения реакций.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. Лабораторный опыт 26. Номер №1
Решение
Хлорид натрия − NaCl
Фосфат натрия − N a 3 P O 4
Йодид натрия − NaI
Нитрат серебра − A g N O 3
Запишем уравнения реакций:
1 ) NaCl + A g N O 3 = AgCl + N a N O 3
Наблюдается образование белого творожистого осадка − хлорида серебра.
2 ) N a 3 P O 4 + 3 A g N O 3 = A g 3 P O 4 + 3 N a N O 3
Наблюдается образование ярко−желтого осадка − фосфата серебра.
3 ) NaI + A g N O 3 = Agl + N a N O 3
Наблюдается образование желтого осадка − йодида серебра.
Источник: reshalka.com